浙江金华十校2021-2022学年高一上学期期末调研考试化学试题
试卷更新日期:2022-03-04 类型:期末考试
一、单选题
-
1. H2O是地球上分布最广泛的物质。H2O的摩尔质量为( )A、10 B、18 C、10g·mol-1 D、18g·mol-12. 下列物质的俗名与化学式对应正确的是( )A、铁红— B、生石灰— C、苛性钠— D、漂白液有效成分—3. 下列关于我国飞机所用的材料中,主要成分属于金属材料的是( )
 A、座椅滑轨——铝锂合金 B、轮胎——橡胶 C、尾翼主盒——碳纤维 D、风挡——玻璃4. 完成下列实验需用如图所示仪器的是( )
A、座椅滑轨——铝锂合金 B、轮胎——橡胶 C、尾翼主盒——碳纤维 D、风挡——玻璃4. 完成下列实验需用如图所示仪器的是( ) A、制备少量气体 B、溶解少量固体 C、配置的溶液 D、配制溶液5. 下列变化中只涉及物理变化的是( )A、铁粉作食品的抗氧化剂 B、氯气加压制液氯 C、过氧化钠作呼吸面具的供氧剂 D、盐酸除锈6. 当光束通过下列分散系时,能产生丁达尔效应的是( )A、AgNO3溶液 B、KOH溶液 C、Fe(OH)3胶体 D、稀H2SO47. 常温下实现下列转化,一定要加入其它物质作还原剂的是( )A、 B、 C、 D、8. 下列化学用语表示正确的是( )A、氯气的分子结构模型:
A、制备少量气体 B、溶解少量固体 C、配置的溶液 D、配制溶液5. 下列变化中只涉及物理变化的是( )A、铁粉作食品的抗氧化剂 B、氯气加压制液氯 C、过氧化钠作呼吸面具的供氧剂 D、盐酸除锈6. 当光束通过下列分散系时,能产生丁达尔效应的是( )A、AgNO3溶液 B、KOH溶液 C、Fe(OH)3胶体 D、稀H2SO47. 常温下实现下列转化,一定要加入其它物质作还原剂的是( )A、 B、 C、 D、8. 下列化学用语表示正确的是( )A、氯气的分子结构模型: B、硫原子的结构示意图:
B、硫原子的结构示意图: C、的电离方程式:
D、用电子式表示的形成过程:
C、的电离方程式:
D、用电子式表示的形成过程: 9. 下列物质中存在共价键的是( )A、NH3 B、Na2O C、MgCl2 D、K2S10. 下列有关实验安全的叙述不正确的是( )A、观察活泼金属与反应时,需要戴护目镜 B、标准符号
9. 下列物质中存在共价键的是( )A、NH3 B、Na2O C、MgCl2 D、K2S10. 下列有关实验安全的叙述不正确的是( )A、观察活泼金属与反应时,需要戴护目镜 B、标准符号 示意“毒性物质”
C、浓溶液沾到手上应立即用大量水冲洗
D、中学实验室中可以将未用完的钠、钾和白磷等放回原试剂瓶
11. 下列说法不正确的是( )A、氯化钠溶液中存在水合钠离子和水合氯离子 B、“月壤”中含有 , 该原子的中子数是5 C、红磷、白磷都是磷元素的同素异形体 D、在合金中加入适量稀土金属,能大大改善合金的性能12. 下列反应的离子方程式书写正确的是( )A、碳酸钡与盐酸反应: B、用小苏打治疗胃酸过多: C、碳酸氢铵溶液与足量的氢氧化钠溶液反应: D、用铝与溶液反应疏通污水管道:13. 下列各组离子在无色透明溶液中能大量共存的是( )A、 B、 C、 D、14. 下列几种类推结论符合事实的是( )A、碳酸钠溶于水放热,则碳酸氢钠溶于水也放热 B、可改写为 , 则也可改写为 C、是氧化还原反应,则也是氧化还原反应 D、溶于生成 , 则也能溶于生成15. 某学生以铁丝和Cl2为原料进行下列三个实验。下列从分类角度分析不正确的是( )
示意“毒性物质”
C、浓溶液沾到手上应立即用大量水冲洗
D、中学实验室中可以将未用完的钠、钾和白磷等放回原试剂瓶
11. 下列说法不正确的是( )A、氯化钠溶液中存在水合钠离子和水合氯离子 B、“月壤”中含有 , 该原子的中子数是5 C、红磷、白磷都是磷元素的同素异形体 D、在合金中加入适量稀土金属,能大大改善合金的性能12. 下列反应的离子方程式书写正确的是( )A、碳酸钡与盐酸反应: B、用小苏打治疗胃酸过多: C、碳酸氢铵溶液与足量的氢氧化钠溶液反应: D、用铝与溶液反应疏通污水管道:13. 下列各组离子在无色透明溶液中能大量共存的是( )A、 B、 C、 D、14. 下列几种类推结论符合事实的是( )A、碳酸钠溶于水放热,则碳酸氢钠溶于水也放热 B、可改写为 , 则也可改写为 C、是氧化还原反应,则也是氧化还原反应 D、溶于生成 , 则也能溶于生成15. 某学生以铁丝和Cl2为原料进行下列三个实验。下列从分类角度分析不正确的是( ) A、实验①铁丝过量时产物为FeCl2 B、实验②中玻璃棒的作用为搅拌加速溶解 C、实验①、②涉及化合物均为电解质 D、实验③发生化学变化,最终得到的分散系为胶体16. 短周期主族元素X、Y、Z的原子序数依次增大:X原子最外层电子数是次外层电子数的3倍,Y是短周期中金属性最强的元素,Z与X位于同一主族。下列叙述正确的是( )A、原子半径r(Z)>r(Y)>r(X) B、X的简单气态氢化物的热稳定性比Z弱 C、X、Y、Z三种元素可形成化合物Y2ZX4 D、Y形成的最高价氧化物的水化物是弱碱17. 下列说法不正确的是( )A、侯德榜是我国著名化工专家,发明了侯氏制碱法 B、门捷列夫提出了元素周期律,编制出第一张元素周期表 C、玻尔发现原子中存在电子,电子在原子核外空间的一定轨道上绕核做高速圆周运动 D、舍勒发现了一种黄绿色气体,戴维确认该气体为氯气18. 下列叙述中正确的是( )A、菠菜和黑木耳等食品中富含铁元素 B、铁与水不发生反应,因此钢水注入模具前,模具不需要干燥处理 C、在一定物质的量浓度溶液配制中,定容时俯视,导致所配制溶液浓度偏小 D、在做焰色试验时,应用硫酸洗净铂丝19. 已知铷和铯分别位于元素周期表第五周期ⅠA族和第六周期ⅠA族。下列说法不正确的是( )A、铯原子的最外层电子数是1 B、铷比铯的金属性弱 C、铯比铷的原子序数大32 D、硝酸铯是离子化合物20. 下列说法不正确的是( )A、氯化氢溶于水破坏的微粒间作用力为共价键 B、氯气比氢气容易液化,是因为氯气分子间作用力较强 C、三氯化磷分子中磷原子和氯原子最外电子层都具有8电子的稳定结构 D、硫酸氢钠固体溶于水破坏离子键,电离出钠离子和硫酸氢根离子21. 近期科学家首次用X射线激光技术观察到与在催化剂表面生成的历程(部分微粒未画出)。反应过程如下图,下列说法正确的是( )
A、实验①铁丝过量时产物为FeCl2 B、实验②中玻璃棒的作用为搅拌加速溶解 C、实验①、②涉及化合物均为电解质 D、实验③发生化学变化,最终得到的分散系为胶体16. 短周期主族元素X、Y、Z的原子序数依次增大:X原子最外层电子数是次外层电子数的3倍,Y是短周期中金属性最强的元素,Z与X位于同一主族。下列叙述正确的是( )A、原子半径r(Z)>r(Y)>r(X) B、X的简单气态氢化物的热稳定性比Z弱 C、X、Y、Z三种元素可形成化合物Y2ZX4 D、Y形成的最高价氧化物的水化物是弱碱17. 下列说法不正确的是( )A、侯德榜是我国著名化工专家,发明了侯氏制碱法 B、门捷列夫提出了元素周期律,编制出第一张元素周期表 C、玻尔发现原子中存在电子,电子在原子核外空间的一定轨道上绕核做高速圆周运动 D、舍勒发现了一种黄绿色气体,戴维确认该气体为氯气18. 下列叙述中正确的是( )A、菠菜和黑木耳等食品中富含铁元素 B、铁与水不发生反应,因此钢水注入模具前,模具不需要干燥处理 C、在一定物质的量浓度溶液配制中,定容时俯视,导致所配制溶液浓度偏小 D、在做焰色试验时,应用硫酸洗净铂丝19. 已知铷和铯分别位于元素周期表第五周期ⅠA族和第六周期ⅠA族。下列说法不正确的是( )A、铯原子的最外层电子数是1 B、铷比铯的金属性弱 C、铯比铷的原子序数大32 D、硝酸铯是离子化合物20. 下列说法不正确的是( )A、氯化氢溶于水破坏的微粒间作用力为共价键 B、氯气比氢气容易液化,是因为氯气分子间作用力较强 C、三氯化磷分子中磷原子和氯原子最外电子层都具有8电子的稳定结构 D、硫酸氢钠固体溶于水破坏离子键,电离出钠离子和硫酸氢根离子21. 近期科学家首次用X射线激光技术观察到与在催化剂表面生成的历程(部分微粒未画出)。反应过程如下图,下列说法正确的是( )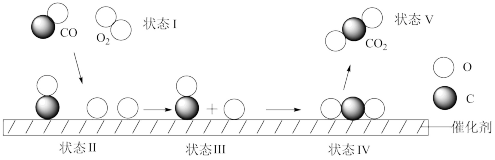 A、状态Ⅰ→状态Ⅱ发生了化学变化 B、和O生成的过程涉及电子转移 C、是具有非极性共价键的直线形分子 D、状态Ⅲ→状态Ⅴ表示与的反应22. 下列实验装置进行的相应实验,达不到实验目的的是( )
A、状态Ⅰ→状态Ⅱ发生了化学变化 B、和O生成的过程涉及电子转移 C、是具有非极性共价键的直线形分子 D、状态Ⅲ→状态Ⅴ表示与的反应22. 下列实验装置进行的相应实验,达不到实验目的的是( ) A、用图1所示装置除去CO2中含有的少量HCl气体 B、用图2所示装置加热蒸发NaCl饱和溶液制备NaCl晶体 C、用图3所示装置制取少量CO2气体 D、用图4所示装置除去少量黄河水中的泥沙23. 利用废旧镀锌铁皮制备胶体粒子的流程图如下:
A、用图1所示装置除去CO2中含有的少量HCl气体 B、用图2所示装置加热蒸发NaCl饱和溶液制备NaCl晶体 C、用图3所示装置制取少量CO2气体 D、用图4所示装置除去少量黄河水中的泥沙23. 利用废旧镀锌铁皮制备胶体粒子的流程图如下:
已知:镀锌铁皮就是铁皮表面镀上一层锌;溶于强碱时生成。下列有关说法正确的是( )
A、用氢氧化钠溶液处理废旧镀锌铁皮,主要目的是为了处理铁皮表面的油污 B、“酸溶”的离子方程式为 C、“氧化”后溶液中所存在的离子有: D、最后一步“反应”中的作用是将部分还原成24. 设NA为阿伏加德罗常数的值,下列说法不正确的是( )A、4.6gNa 与含 0.1molHCl 的稀盐酸充分反应,转移电子数目为 0.2 NA B、质量为 3.0g 的 15N2 和 C18O 混合物中含有中子数为 1.6NA C、常温常压下,1.12L 的 CO2 和 SO2 混合气体中,含有氧原子的数目小于 0.1NA D、在 1L相同浓度的硫酸钾和硫酸铁混合液中K+浓度为 0.2 mol·Lˉ1 , 则溶液中 SO42-的数目为0.3NA25. 固体粉末可能由中的几种等物质的量混合而成,进行如下实验:①取固体溶于足量水中,得到澄清透明溶液,将溶液分为三等份。
②在第一份溶液中滴加足量稀盐酸无明显现象,再滴加足量溶液,过滤、洗涤、干燥,得到233g固体。
③在第二份溶液中滴加溶液无明显现象,继续滴加双氧水,溶液显血红色。
④在第三份溶液中滴加足量溶液,过滤、洗涤、灼烧,得到固体。
下列说法正确的是( )
A、固体粉末中肯定没有 B、根据④中的沉淀颜色能判断固体粉末中是否含有 C、固体粉末中肯定含有 D、上述实验无法确定固体粉末是否含有 , 需进一步通过焰色试验确定二、填空题
-
26. 请按要求完成下列填空。(1)、下列给定的物质中:① ②铝条 ③熔融氯化钠 ④乙醇。属于电解质的是(填编号)。(2)、写出金属钠投入水中反应的化学方程式。(3)、比较沸点:(填“>”“<”“=”)。27. 化学与人类生活、生产和社会可持续发展密切相关,请回答下列问题。(1)、Ⅰ春秋末期工艺官书《考工记》中记载有“涑帛”的方法,即利用含有碳酸钠的水溶液来洗涤丝帛。
请写出碳酸钠水溶液中通入气体的化学方程式。
(2)、用的溶液吸收 , 所得溶液中和物质的量浓度之比为。(3)、Ⅱ.如图为铁及其化合物的“价一类”二维图。
图中①处填 , ②处填。
(4)、某小组在探究性质的实验(实验1)时,观察到溶液变红,片刻红色褪去,有气体生成。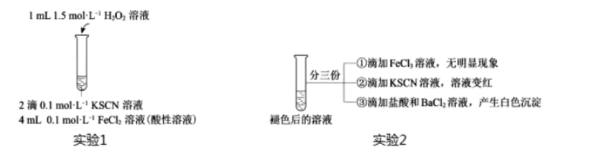
用实验2探究“红色褪去”的原因,则红色褪去的原因是。
28. 向含有一定量盐酸和的混合溶液中逐滴滴加溶液,产生沉淀的质量m与加入的物质的量n之间的关系如图所示,按要求填空: (1)、段产生的沉淀为(填写化学式)。(2)、原混合溶液中。
(1)、段产生的沉淀为(填写化学式)。(2)、原混合溶液中。三、综合题
-
29. 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答问题:
族
周期
ⅠA
0
1
①
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
②
③
④
3
⑤
⑥
⑦
⑧
(1)、镁元素在周期表中的位置是。(2)、②的最高价氧化物的结构式为。(3)、④⑤元素可形成既含离子键又含非极性共价键的离子化合物,写出该化合物的电子式:;写出⑥的最高价氧化物与⑤的最高价氧化物对应的水化物反应的离子方程式。(4)、W是第四周期与④同主族的元素。据此推测W不可能具有的性质是____(填字母)。A.最高化合价为A、简单气态氢化物比稳定 B、最高价氧化物对应水化物的酸性比硫酸弱 C、单质在常温下可与氢气化合(5)、已知X为第ⅡA族元素(前四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,写出Y的原子序数(用含a的代数式表示)。30. 固体化合物X由3种元素组成.某学习小组进行了如下实验:
已知:A为二元化合物,其标况下的密度2.86g/L;Z加盐酸得到蓝色溶液:B加硫酸产生白色沉淀。请回答:
(1)、A的分子式。(2)、化合物X含有元素(填元素符号),X的化学式。(3)、实验室常将通过热的固体Z制备氮气,该反应的化学方程式是。31. 已知氯气与碱反应时,产物受温度的影响。实验室中利用如图装置(部分装置省略)制备和 , 并探究其氧化还原性质。
回答下列问题:
(1)、仪器a的名称是。(2)、装置A产生氯气的化学方程式为。(3)、装置B的作用为。(4)、装置D中发生反应的离子方程式为。(5)、装置E可选用试剂____(填标号)。A、溶液 B、溶液 C、澄清石灰水 D、稀硫酸(6)、探究、的氧化能力
操作:向1号和2号试管中,分别滴加适量中性溶液。
现象:1号试管溶液颜色不变,2号试管溶液变为棕色。
结论:该条件下氧化能力(填“大于”或“小于”)。