新疆吐鲁番市2021-2022学年高一上学期期末考试化学试题
试卷更新日期:2022-03-04 类型:期末考试
一、单选题
-
1. 当光束通过下列物质时,不会出现丁达尔效应的是( )
①Fe(OH)3胶体 ②水 ③蔗糖溶液 ④FeCl3溶液 ⑤云、雾
A、②④⑤ B、③④⑤ C、②③④ D、①③④2. 下列四种基本反应类型中,一定是氧化还原反应的是( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应3. 中国科学家首次实现了两个异核原子(1个 原子和1个 原子)的量子受控非门和量子纠缠,下列有关 的说法正确的是( )A、质子数为87 B、核外电子数为37 C、中子数为37 D、质量数为504. 元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )A、左下方区域的金属元素 B、右上方区域的非金属元素 C、金属元素和非金属元素分界线附近的元素 D、稀有气体元素5. 在地壳中含量排第一的金属元素是( )A、铁 B、氧 C、硅 D、铝6. 下列物质中,不能由单质之间直接化合生成的是( )A、 B、 C、 D、7. 配制100mL1.0mol·L-1Na2CO3溶液,下列操作正确的是( )A、称取10.6g无水碳酸钠,置于100mL容量瓶中,加水溶解、定容 B、称取10.6g无水碳酸钠置于烧杯中,加入100mL蒸馏水,搅拌、溶解 C、转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中 D、定容后,塞好瓶塞,反复倒转、摇匀8. 在1molNa2SO4中含有Na+的数目约为个( )A、1.204×1024 B、2 C、1.204×1023 D、6.02×10239. 下列说法中,正确的是( )A、22.4LN2中一定含有1molN2 B、80gNaOH溶解在1L水中,所得溶液中溶质的物质的量浓度为2mol/L C、在标准状况下,20mLNH3和60mLO2所含分子个数比为1∶3 D、18gH2O在标准状况下的体积约为22.4L10. 将30 mL0.5 mol/LNaOH溶液加水稀释到500 mL,稀释后NaOH的物质的量浓度为( )A、0.03 mol/L B、0.3 mol/L C、0.05 mol/L D、0.04 mol/L11. 下列反应的方程式书写正确的是( )A、钠和冷水反应:Na+2H2O=Na++2OH-+H2↑ B、硫酸和氢氧化钡反应:H++SO+Ba2++OH-=BaSO4↓+H2O C、金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑ D、铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑12. 下列各组中的离子,能在溶液中大量共存的是( )A、K+、H+、SO、OH- B、Na+、Ca2+、CO、NO C、Na+、H+、Cl-、CO D、Na+、Cu2+、Cl-、SO13. 把铁片放入下列溶液中,铁片溶解,溶液质量增加,但没有气体放出的是( )A、稀硫酸 B、Fe2(SO4)3溶液 C、CuSO4溶液 D、AgNO3溶液14. 下列关于F、Cl、Br、I的比较,不正确的是( )A、它们的原子核外电子层数随核电荷数的增加而增多 B、单质的氧化性随核电荷数的增加而减弱 C、它们的氢化物的稳定性随核电荷数的增加而增强 D、单质的颜色随核电荷数的增加而加深15. 下列物质中,只含有非极性共价键的是( )A、NaOH B、NaCl C、Cl2 D、H2S16. 某无色溶液中加入铝片后有氢气产生,则下列离子在该溶液中一定能大量共存的是( )A、NH、Na+、Cl-、HCO B、H+、Cu2+、NO、Cl- C、Fe3+、Al3+、Cl-、SO D、K+、Na+、SO、Cl-17. 下列关于物质性质的比较,不正确的是( )A、酸性强弱: B、原子半径大小: C、碱性强弱: D、金属性强弱:18. 海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用以达到富集的目的,化学反应为Br2+SO2+2H2O=2HBr+H2SO4 , 下列说法正确的是( )。A、Br2在反应中表现氧化性 B、SO2在反应中被还原 C、Br2在反应中失去电子 D、1 mol氧化剂在反应中得到1 mol电子19. 下列有关物质及成分、性质和用途都正确的是( )选项
物质及成分
性质
用途
A
小苏打(Na2CO3)
与酸反应产生二氧化碳
作发酵粉
B
胃舒平[Al(OH)3 ]
与酸发生中和反应
做胃酸中和剂
C
磁性氧化铁(Fe2O3)
难溶于水,颜色为红色
制造红色涂料
D
蓝矾(CuSO4·5H2O)
蓝色
检验水蒸气
A、A B、B C、C D、D20. 如图所示,在A处通入未经干燥的氯气,当关闭B阀时,C处的红布条看不到明显现象:当打开B阀后,C处的红布条逐渐褪色:则D瓶中盛放的溶液可能是( )①饱和NaCl溶液
②NaOH溶液
③H2O
④浓硫酸
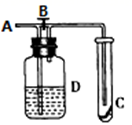 A、①② B、①③ C、②④ D、③④
A、①② B、①③ C、②④ D、③④二、填空题
-
21. 下面是同学们熟悉的物质:①O2 ②H2O ③MgCl2 ④HCl ⑤NaF ⑥CO2 ⑦CH4 ⑧CaO ⑨NaOH;这些物质中,属于盐的是(填序号,下同);属于共价化合物的是;只含有离子键的是。22. 我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑。在该反应中,还原剂是(填化学式)。23. 按要求回答下列问题:(1)、写出Fe2(SO4)3的电离方程式。(2)、写出下列物质的电子式:①MgCl2;②N2。(3)、写出2H++CO=CO2↑+H2O相对应的一个化学方程式。24. CO和CO2是碳的两种重要氧化物。(1)、在标准状况下,11.2LCO的物质的量是。(2)、标准状况下,11g CO2的体积是。(3)、相同质量的CO和CO2所含的氧原子个数比是。25. 表中列出了A~R这9种元素在周期表中的位置:
周期
族
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
2
E
F
3
A
C
D
G
R
4
B
H
请回答下列问题。
(1)、表中部分元素的元素符号分别是:E , H。(2)、R的原子结构示意图为。(3)、D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是。(4)、A,B,C三种元素按原子半径由大到小的顺序排列为。(5)、F元素与氢元素组成10个电子的分子的化学式为 , 在常温下该分子可与B发生反应,所得溶液的pH7(填“>”、“<”、“=”)。三、综合题
-
26. 各物质间的转化关系如下图所示,请完成下列空白。
 (1)、写出B和D的化学式: B;D。(2)、写出E转变为F的化学方程式: 。(3)、向G溶液中加入A,写出反应的离子方程式: 。
(1)、写出B和D的化学式: B;D。(2)、写出E转变为F的化学方程式: 。(3)、向G溶液中加入A,写出反应的离子方程式: 。