四川省资阳市2021-2022学年高一上学期期末考试化学试题
试卷更新日期:2022-03-04 类型:期末考试
一、单选题
-
1. 2022 年北京冬奥会火炬“飞扬”的外壳采用了轻质耐高温碳纤维材料。这种材料属于( )A、黑色金属材料 B、有机合成材料 C、传统硅酸盐材料 D、新型无机非金属材料2. 科学家的不懈努力推进着社会的不断发展。我国科学家屠呦呦的突出贡献是( )A、提出侯氏制碱法 B、发明光导纤维 C、领衔人工合成结晶牛胰岛素 D、发现并提取新型治疟药物青蒿素3. 赏心悦目的雕花玻璃是用下列物质中的一种对玻璃进行刻蚀而制成的,这种物质是( )A、盐酸 B、烧碱 C、氢氟酸 D、纯碱4. 下列有关说法不正确的是( )A、新制氯水保存在棕色细口瓶中 B、Na2CO3 俗名纯碱 C、盛放碱液的试剂瓶用玻璃塞 D、除去NaHCO3溶液中的Na2CO3通入过量的CO25. 化学与生产、生活、社会密切相关,下列有关说法中不正确的是( )A、普通玻璃是以纯碱、石灰石和石英砂为原料经高温烧结而制成 B、Na2O2 可作载人深潜器的供氧剂 C、明矾溶于水生成Al(OH)3胶体,可对水消毒杀菌 D、大型节庆活动中燃放的绚丽“焰火”与元素的“焰色”反应有关6. 等质量的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,充分反应后放出的氢气在同温同压下体积之比为( )A、1∶1 B、1∶6 C、2∶3 D、3∶27. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下,22.4 LCCl4中含有的CCl4分子数为NA B、标准状况下,18g 水中含有的电子数目为10 NA C、常温常压下,2.24 L CO2和CO的混合气体中含有的碳原子数目为0.1 NA D、1 molL的Na2SO4溶液中含有Na+ 数目为2 NA8. 下列关于实验事故或药品的处理方法中,正确的是( )A、必须将未用完的钠、钾放回原试剂瓶 B、氯气泄漏时,用肥皂水浸湿毛巾捂住嘴和鼻,顺风向地势低处逃离 C、实验室失火均可用水扑灭 D、浓硫酸沾在皮肤上,立即用大量氢氧化钠溶液冲洗9. 下列表示氧化还原反应中电子转移的方向和数目正确的是( )A、
 2NaCl
B、
2NaCl
B、 C、
C、 D、
D、 +2H2O
10. 科学家发现一种新型氮分子,其化学式为N4 , 在相同条件下,等质量的N4和N2具有相同的( )A、分子数 B、原子数 C、体积 D、物质的量11. 下列溶液中,氯离子浓度最大的是( )A、10 mL 2 mol·L-1的MgCl2溶液 B、100 mL 2.5 mol·L-1的NaCl溶液 C、200 mL 6 mol·L-1的KClO3溶液 D、150 mL 1 mol·L-1的AlCl3溶液12. 芯片是中美经贸摩擦的焦点之一、 制造芯片的高纯硅可以用下述方法制取(反应条件略),下列说法不正确的是( )
+2H2O
10. 科学家发现一种新型氮分子,其化学式为N4 , 在相同条件下,等质量的N4和N2具有相同的( )A、分子数 B、原子数 C、体积 D、物质的量11. 下列溶液中,氯离子浓度最大的是( )A、10 mL 2 mol·L-1的MgCl2溶液 B、100 mL 2.5 mol·L-1的NaCl溶液 C、200 mL 6 mol·L-1的KClO3溶液 D、150 mL 1 mol·L-1的AlCl3溶液12. 芯片是中美经贸摩擦的焦点之一、 制造芯片的高纯硅可以用下述方法制取(反应条件略),下列说法不正确的是( ) A、自然界中没有硅单质 B、制造芯片的高纯硅具有一定的导电性 C、SiO2 是两性氧化物 D、反应①、②、③均为氧化还原反应13. 下列离子方 程式的书写正确的是( )A、向Ba(OH)2溶液中加入稀H2SO4: Ba2+ +2OH- +2H+ + SO=BaSO4↓+ 2H2O B、钠与硫酸铜溶液反应: 2Na+ Cu2+= Cu+ 2Na+ C、澄清的石灰水与稀盐酸反应: Ca(OH)2 + 2H+= Ca2+ + 2H2O D、碳酸氢钙与过量NaOH溶液反应: Ca2+ + HCO + 2OH- = CaCO3↓ + H2O14. 下列各组离子在指定 条件下一定能大量共存的是( )A、无色溶液中: NH、Cu2+、 SO、 OH- B、含有Al3+的溶液: OH-、AlO、Na+、K+ C、酸性溶液中: K+、Na+、 SO、 Cl- D、含有CO的溶液: H+、Ca2+、 NO、Cl-15. “84” 消毒液对新型冠状病毒具有消杀作用。下图为某品牌“84”消毒液使用说明的一部分,下列说法不正确的是( )
A、自然界中没有硅单质 B、制造芯片的高纯硅具有一定的导电性 C、SiO2 是两性氧化物 D、反应①、②、③均为氧化还原反应13. 下列离子方 程式的书写正确的是( )A、向Ba(OH)2溶液中加入稀H2SO4: Ba2+ +2OH- +2H+ + SO=BaSO4↓+ 2H2O B、钠与硫酸铜溶液反应: 2Na+ Cu2+= Cu+ 2Na+ C、澄清的石灰水与稀盐酸反应: Ca(OH)2 + 2H+= Ca2+ + 2H2O D、碳酸氢钙与过量NaOH溶液反应: Ca2+ + HCO + 2OH- = CaCO3↓ + H2O14. 下列各组离子在指定 条件下一定能大量共存的是( )A、无色溶液中: NH、Cu2+、 SO、 OH- B、含有Al3+的溶液: OH-、AlO、Na+、K+ C、酸性溶液中: K+、Na+、 SO、 Cl- D、含有CO的溶液: H+、Ca2+、 NO、Cl-15. “84” 消毒液对新型冠状病毒具有消杀作用。下图为某品牌“84”消毒液使用说明的一部分,下列说法不正确的是( )主要成分:次氯酸钠(NaClO)
注意事项:
①本品为外用消毒剂,不可内服。
②本品对金属制品有腐蚀作用,对棉纺织
品有漂白脱色作用。
③密闭、避光、避热、置于阴凉处保存。
A、NaClO要与空气中的水、二氧化碳反应,应密封保存 B、“84” 消毒液能用不锈钢容器盛放 C、NaClO 与双氧水的漂白原理相同 D、“84” 消毒液和洁厕灵(主要成分是盐酸)不能混合使用16. 下列反应条件或反应物用量改变,对生成物没有影响的是( )A、Na与O2 B、AlCl3溶液与NaOH溶液 C、Na2CO3 溶液与盐酸 D、Na2O2 与H2O17. 下列实验装置不能达到实验目的是( )A
B
C
D
实验




结论
吸收氯化氢
该装置可用于收集H2
检验碘离子
证明酸性强弱顺序为: HCl>H2CO3>H2SiO3
A、A B、B C、C D、D18. 已知30mL浓度为0.5mol·L-1的Na2SO3溶液恰好与50mL浓度为0.1mol·L-1的KRO4溶液完全反应转化为Na2SO4。则R元素在产物中的化合价是( )A、+1 B、+2 C、+3 D、+419. 下列各组物质给定条件下不能由一步反应实现的是( )A、CaCl2(溶液) CaCO3 CaO B、Al2O3 AlCl3 Al(OH)3 C、NaHCO3( 固体) Na2CO3 NaOH D、Fe FeCl3 Fe(OH)320. H2S 和空气的混合气体通入FeCl3、FeCl2、CuCl2 的混合溶液中反应回收S,其物质转化如图所示。已知: I. H2S是弱酸; II. CuS不溶于水和普通酸。下列说法正确的是( ) A、在图示的转化中,化合价不变的元素只有铜 B、回收硫的总反应为: 2H2S + O2=2H2O+2S↓ C、过程①的离子反应为: S2- + Cu2+=CuS↓ D、由图示的转化可得出氧化性的强弱顺序: Fe3+>O2>S21. 向含有一定量的Fe、FeO、Fe2O3的混合物中,加入100mL 2mol/L的盐酸,恰好使混合物完全溶解,放出448mL(标准状况)气体,向溶液中滴加KSCN溶液无血红色出现,则将所得溶液中Fe2+完全氧化需要Cl2 (标准状况)的体积为( 不考虑KSCN的氧化)( )A、1.12L B、2.8L C、2.24L D、8.4L22. 取A、B两份等物质的量浓度的NaOH溶液,每份100mL,先分别向A、B中通入不等量的CO2 , 再继续向两溶液中逐滴加入0. 1mol/L的盐酸,产生如图所示关系。下列说法不正确的是( )
A、在图示的转化中,化合价不变的元素只有铜 B、回收硫的总反应为: 2H2S + O2=2H2O+2S↓ C、过程①的离子反应为: S2- + Cu2+=CuS↓ D、由图示的转化可得出氧化性的强弱顺序: Fe3+>O2>S21. 向含有一定量的Fe、FeO、Fe2O3的混合物中,加入100mL 2mol/L的盐酸,恰好使混合物完全溶解,放出448mL(标准状况)气体,向溶液中滴加KSCN溶液无血红色出现,则将所得溶液中Fe2+完全氧化需要Cl2 (标准状况)的体积为( 不考虑KSCN的氧化)( )A、1.12L B、2.8L C、2.24L D、8.4L22. 取A、B两份等物质的量浓度的NaOH溶液,每份100mL,先分别向A、B中通入不等量的CO2 , 再继续向两溶液中逐滴加入0. 1mol/L的盐酸,产生如图所示关系。下列说法不正确的是( ) A、A曲线中的P点发生的离子反应为H+ +CO =HCO B、加盐酸之前B溶液中的溶质是氢氧化钠和碳酸钠 C、B曲线最终产生的CO2体积为33.6 mL D、原NaOH溶液的物质的量浓度为0.075 mol/L
A、A曲线中的P点发生的离子反应为H+ +CO =HCO B、加盐酸之前B溶液中的溶质是氢氧化钠和碳酸钠 C、B曲线最终产生的CO2体积为33.6 mL D、原NaOH溶液的物质的量浓度为0.075 mol/L二、填空题
-
23. 现有六种物质:①KHSO4固体 ②铝 ③CO2 ④氨水 ⑤液态HCl ⑥熔融Al2(SO4)3(1)、上述物质中,属于非电解质的是(填序号,下同),除②以外, 能导电的是;将⑤加入到④中溶液的导电能力变化是(填“增强”、“减弱”或“基本不变”)。(2)、⑥的电离方程式为。(3)、碳酸氢钠溶液与①的水溶液反应的离子方程式为。24. 为治理汽车尾气中的NO和CO对环境的污染,可在汽车排气管上安装催化转化器,发生如下反应: 2NO + 2CON2+2CO2。(1)、上述反应的还原剂是 , 氮元素的化合价(填“升高”或“降低”)。(2)、若反应中消耗了2molNO,则生成N2在标准状况下的体积为L,转移电子的数目为。25. 下表是某儿童在医院临床检验结果报告单的部分数据:
分析项目
检测结果
单位
参考范围
锌
115.92
μmol/L
66~ 120
铁
7.95
mmol/L
7.52~11.82
钙
0.68
mmol/L
1.55~2.10
血糖
5.0
mmol/L
3.61-6.11
根据上表的数据,回答下列问题。
(1)、该儿童元素含量偏低。(填元素符号)(2)、报告单中“mmol/L" 是 ( 填“质量”、“体积”或“浓度”)的单位。(3)、检测人的血液中葡萄糖(简称血糖,分子式: C6H12O6)的含量。葡萄糖的摩尔质量为。如果以医学中惯用单位“mg/dL”来表示,该儿童的血糖值是mg/dL (已知: 1 L=10 dL )。三、综合题
-
26. 现实验室需80 mL 1.84 mol·L-1的稀硫酸,用质量分数为98%、密度为1.84g·cm-3的浓硫酸配制。请回答下列问题:(1)、盛放浓硫酸的试剂瓶标签上应印有下列警示标记中的B和____(填字母)。A、
 B、
B、 C、
C、 D、
D、 (2)、经计算,需要用量筒量取上述浓硫酸的体积为mL。(3)、可供选用的仪器有:
(2)、经计算,需要用量筒量取上述浓硫酸的体积为mL。(3)、可供选用的仪器有:A.胶头滴管 B.药匙 C.烧杯 D.烧瓶 E.量筒 F.托盘天平
配制该稀硫酸时,需要选用上面的哪些仪器 ( 填字母),还缺少的仪器有玻璃棒、(写仪器名称)。
(4)、对所配制的稀硫酸进行测定,发现其浓度小于1.84mol·L-1 , 原因可能是____。A、用量筒量取浓硫酸时,仰视刻度线 B、容量瓶用蒸馏水洗涤后未经干燥 C、将稀释后的溶液立即转入容量瓶 D、转移溶液时,不慎有少量溶液洒出 E、定容时,俯视容量瓶刻度线 F、定容摇匀后,发现凹液面最低处低于刻度线,再补加几滴蒸馏水至刻度线27. 某实验小组用下列装置制备高铁酸钾( K2FeO4 )并探究其性质,制备原理为:3Cl2+2Fe(OH)3+ 10KOH=2K2FeO4+6KCl+8H2O。(夹持装置略)
查阅资料:①K2FeO4 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2。②ClO-能将盐酸氧化成氯气。
(1)、I K2FeO4 的制备仪器a的名称为 , D中的NaOH溶液可以用代替(填入对应字母)。
A.蒸馏水 B.澄清石灰水 C.石灰乳 D.饱和食盐水
(2)、检验气体发生装置A气密性的方法是; 该装置中生成黄绿色气体的化学反应方程式为。(3)、制备K2FeO4需要在(填“酸性”“碱性”或“中性”)环境中进行,根据上述K2FeO4的制备实验得出:氧化性Cl2FeO (填“>”或“<”)。装置C中Cl2还会与过量的KOH发生反应,请写出其离子反应方程式。(4)、II.探究K2FeO4的性质实验方案:用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液。取少量该溶液于试管中,滴加过量盐酸后发现有Cl2产生。
①为确保氧化Cl-的物质只能是FeO , 则用KOH溶液洗涤的目的是。
②由(4)的实验得出Cl2和FeO的氧化性强弱关系与I中制备K2FeO4实验时得出的结论相反,其可能的原因是。
28. 为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体( FeSO4·7H2O)并回收铜。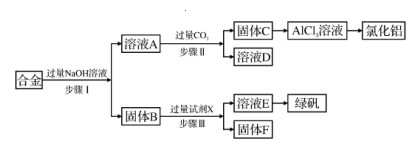
请回答下列问题:
(1)、步骤I的离子反应方程式为。(2)、试剂X是。(填名称)(3)、步骤I、II、III中均需进行的实验操作是。(4)、步骤II的化学方程式为。(5)、固体F是( 填化学式)。(6)、某研究性学习小组为测定溶液E (有少量已变质)的组成,进行了如下实验:①取少量待测溶液,加入适量淀粉KI溶液,溶液变为蓝色,该反应的离子方程式为 , 说明FeSO4溶液已变质。
②取50.0mL待测溶液,加入足量盐酸酸化的的BaCl2溶液,得23.3 g白色沉淀,则溶液中c(SO)=。