陕西省西安市阎良区2021-2022学年高一上学期期末考试化学试题
试卷更新日期:2022-03-04 类型:期末考试
一、单选题
-
1. 化学与科技、生活紧密相关。下列说法正确的是( )A、“温室效应”、“光化学烟雾”的形成都与氮氧化物有关 B、SO2有毒,所以不能用作食品添加剂 C、新型冠状病毒粒子直径约60 ~ 220 nm,介于溶液和胶体之间 D、“奋斗者号”潜水器使用的固体浮力材料由空心玻璃微球填充高强树脂制成,属于复合材料2. 向盛有FeCl3溶液的试管中滴入KSCN溶液,溶液呈( )A、红色 B、黄色 C、蓝色 D、浅绿色3. 古诗词是古人为我们留下的宝贵精神财富,下列诗句不涉及氧化还原反应的是( )A、炉火照天地,红星乱紫烟 B、千淘万漉虽辛苦,吹尽狂沙始到金 C、熬胆矾铁釜,久之亦化为铜 D、爆竹声中一岁除,春风送暖入屠苏4. 下列各种混合物中,能用分液漏斗进行分离的是( )A、酒精和水 B、水和四氯化碳 C、碘和四氯化碳 D、汽油和植物油5. 下列有关试剂保存的说法中不正确的是( )A、浓硝酸不需密封保存 B、液氯贮存在钢瓶中 C、存放液溴的试剂瓶中应加水封 D、漂白粉要密封存放于干燥阴凉处6. 某溶液中含有大量的下列离子:、、和M离子,经测定、、和M离子的物质的量之比为2∶4∶1∶1,则M离子可能是下列中的( )A、 B、 C、 D、7. 配制400mL0.100mol/L的KCl溶液,下列说法正确的是( )
 A、上述实验操作步骤的符合题意顺序为:④①②③ B、容量瓶需要用自来水、蒸馏水洗涤,干燥后才可用 C、实验中需称量2.98 g KCl固体 D、定容时,若仰视容量瓶的刻度线,使配得的KCl溶液浓度偏低8. 材料与化学密切相关。下列物质与材料对应关系不正确的是( )A、铁碳合金——生铁 B、硅酸盐——陶瓷 C、晶体硅——光导纤维 D、氧化镁——耐高温材料9. 某实验小组通过下图所示实验,探究Na2O2与水的反应:
A、上述实验操作步骤的符合题意顺序为:④①②③ B、容量瓶需要用自来水、蒸馏水洗涤,干燥后才可用 C、实验中需称量2.98 g KCl固体 D、定容时,若仰视容量瓶的刻度线,使配得的KCl溶液浓度偏低8. 材料与化学密切相关。下列物质与材料对应关系不正确的是( )A、铁碳合金——生铁 B、硅酸盐——陶瓷 C、晶体硅——光导纤维 D、氧化镁——耐高温材料9. 某实验小组通过下图所示实验,探究Na2O2与水的反应: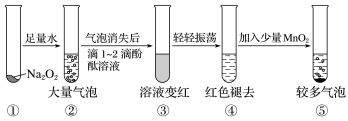
下列说法中正确的是( )
A、②中的大量气泡的主要成分是氢气 B、③中溶液变红,说明有酸性物质生成 C、④中现象可能是由于溶液中含有强氧化性物质造成的 D、⑤中MnO2的主要作用是降低了水中氧气的溶解度10. 设NA为阿伏加德罗常数的值,下列叙述中正确的是( )A、标准状况下,22.4 LSO3中含3 NA个氧原子 B、0.1 mol/L的Na2CO3溶液中Na+数目为0.2 NA C、3 mol铁与足量水蒸气在高温下完全反应,转移电子的数目为8 NA D、常温常压下,28 g C2H4 、CO的混合气体中含有碳原子的数目为1.5 NA11. 下列反应的化学方程式或离子方程式书写正确的是( )A、切开的金属Na暴露在空气中表面逐渐变暗:2Na+O2=Na2O2 B、铜片与稀HNO3反应生成气体3Cu +8H++2NO=3Cu2+ +2NO2↑+4H2O C、将铜丝插入浓硫酸中:Cu+H2SO4=CuSO4+ H2↑ D、实验室制备FeSO4时需加入少量铁粉:2Fe3++Fe=3Fe2+12. 下列铁单质及其化合物的性质与用途具有对应关系的是( )A、Fe2O3能与酸反应,可用作红色颜料 B、K2FeO4具有强氧化性,可用于水体的消毒 C、FeSO4具有还原性,可用作补血剂 D、铁粉具有磁性,可用作食品袋内的抗氧化剂13. 2021年末,新型冠状病毒使西安按下了“暂停键”。在此期间,环境消毒是极其关键的,“84”消毒液是常用的消毒剂之一。下列说法正确的是( )A、“84”消毒液属于纯净物 B、“84”消毒液除能杀菌消毒外,还可作漂白剂 C、“84”消毒液与洁厕灵(主要成分为盐酸)一起使用,能增强消毒效果 D、“84”消毒液杀菌消毒过程中并未发生氧化还原反应14. 下列实验装置不能达到实验目的的是( )A、 验证NH3易溶于水
B、
验证NH3易溶于水
B、 较长时间观察Fe( OH)2白色沉淀
C、
较长时间观察Fe( OH)2白色沉淀
C、 验证SO2的氧化性
D、
验证SO2的氧化性
D、 除去Cl2中含有的少量HCl
15. 海洋生物参与氮循环过程如图所示(其它含氮物质不参与反应)。下列说法不正确的是( )
除去Cl2中含有的少量HCl
15. 海洋生物参与氮循环过程如图所示(其它含氮物质不参与反应)。下列说法不正确的是( ) A、以上六种含氮微粒,一共呈现了氮的五种价态 B、反应①~⑤中只有1个非氧化还原反应 C、反应③中若N2H4与O2反应,则N2H4作还原剂 D、反应③和⑤若生成等质量的N2 , 反应③转移的电子数多16. 下列实验操作能达到实验目的的是( )
A、以上六种含氮微粒,一共呈现了氮的五种价态 B、反应①~⑤中只有1个非氧化还原反应 C、反应③中若N2H4与O2反应,则N2H4作还原剂 D、反应③和⑤若生成等质量的N2 , 反应③转移的电子数多16. 下列实验操作能达到实验目的的是( )选项
实验操作
实验目的
A
用洁净的玻璃棒蘸取待测液滴到pH试纸上,变色后与标准比色卡对照
测定0.01 mol·L-1 NaClO溶液的pH
B
向Fe(NO3)2溶液中滴加酸化的H2O2溶液
证明Fe2+能被H2O2氧化
C
将Cl2依次通过干燥的有色布条和湿润的有色布条
证明Cl2没有漂白性,HClO有漂白性
D
将一小块金属钠加入CuSO4溶液中
比较Na和Cu的活动性强弱
A、A B、B C、C D、D二、填空题
-
17. 现有以下物质:①Na2O2固体、②液氨、③NaOH、④熔融KHSO4、⑤Fe(OH)3胶体、⑥铜、⑦CO2、⑧CH3COOH、⑨蔗糖。(1)、以上物质中属于电解质的是(填序号,下同);属于单质的是。(2)、制备⑤时,在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴 , 继续煮沸至液体呈透明的红褐色,停止加热;然后向其中逐滴滴入过量盐酸,实验现象为。(3)、写出①和⑦反应的化学方程式。(4)、③的溶液不能装在带磨口玻璃塞的试剂瓶中,用离子方程式说明其原因。18. 根据氮及其化合物的转化关系回答下列问题:
 (1)、X的化学式为 , 从化合价上看,X 具有性(填“氧化”或“还原”)。(2)、实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为;下列试剂不能用于干燥NH3的是 (填字母)。
(1)、X的化学式为 , 从化合价上看,X 具有性(填“氧化”或“还原”)。(2)、实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为;下列试剂不能用于干燥NH3的是 (填字母)。A.浓硫酸 B.碱石灰 C.NaOH固体 D.无水CaCl2
(3)、工业上以NH3、空气、水为原料生产硝酸分为三步:①NH3→NO的化学方程式为。
②NO→NO2实验现象是。
③NO2+H2O→HNO3氧化剂与还原剂物质的量之比为。
三、综合题
-
19. 某工业废水中存在大量的Na+、Cl-、Cu2+、SO , 欲除去其中的Cu2+、SO , 设计工艺流程如图所示:
 (1)、试剂a溶液为 , 试剂 b溶液为。(2)、操作X为 , 试剂 a、b(填“能”或“不能”)对调顺序。(3)、如果在工业废水中直接加入氢氧化钡溶液,写出发生反应的离子方程式。(4)、如何检验废水中的SO已除尽(写出对应的操作及现象)。20. 铁、铝、钠是三种重要的金属。回答下列问题:(1)、I氯化铁溶液常用作印刷电路铜板的腐蚀剂。
(1)、试剂a溶液为 , 试剂 b溶液为。(2)、操作X为 , 试剂 a、b(填“能”或“不能”)对调顺序。(3)、如果在工业废水中直接加入氢氧化钡溶液,写出发生反应的离子方程式。(4)、如何检验废水中的SO已除尽(写出对应的操作及现象)。20. 铁、铝、钠是三种重要的金属。回答下列问题:(1)、I氯化铁溶液常用作印刷电路铜板的腐蚀剂。写出该反应的离子方程式 , 从腐蚀废液中回收金属铜还需要的试剂是。
(2)、II.KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如图所示:
试剂①应选用(填字母),反应的化学方程式为。
a.HCl溶液 b. H2SO4溶液 c.氨水 d. NaOH溶液
(3)、向30 mL1 mol/L 的KAl(SO4)2溶液中逐渐加入浓度为4 mol/L的NaOH溶液,若产生0.78 g白色沉淀,则加入NaOH溶液的体积可能为mL或mL。(4)、III.现有一不纯的小苏打样品(含杂质NaCl、Na2CO3 10H2O),为测定NaHCO3的质量分数,设计如图所示的实验装置(部分夹持仪器未画出)。
实验步骤如下:
①按图组装好实验装置并检查气密性。
②称取定质量的样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2 , 关闭K3 , 缓缓鼓入空气数分钟。
④关闭活塞K1、K2打开K3 , 点燃酒精灯加热至不再产生气体。
⑤打开活塞K1 , 缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C和U形管D的质量。
若无装置E,则会导致测得NaHCO3的质量分数(填“偏大”、“偏小”或“无影响”)。
(5)、步骤③的目的是。(6)、若实验中称取样品的质量为50.0g,反应后C、D装置增加的质量分别为12.6g、8.8g,则混合物中NaHCO3的质量分数为。21. 硫酸是重要的化工原料,某兴趣小组对浓硫酸的性质进行如下探究。(1)、棉布上滴浓H2SO4后破洞。体现了浓H2SO4的(填“脱水”“吸水”或“强氧化”、下同)性;在冷的浓H2SO4中放入铁片无明显现象,体现了浓H2SO4的性。为了检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊。(已知淀粉溶液遇I2变蓝)
 (2)、装置A中发生反应的化学方程式为。(3)、实验时,装置C中的现象为。(4)、此实验成败的关键在于控制反应产生气体的速率不能过快,因此设计了虚框部分的装置,正确的操作顺序是(填序号)。
(2)、装置A中发生反应的化学方程式为。(3)、实验时,装置C中的现象为。(4)、此实验成败的关键在于控制反应产生气体的速率不能过快,因此设计了虚框部分的装置,正确的操作顺序是(填序号)。①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b
③打开止水夹a和c,关闭止水夹b
(5)、若要检验浓硫酸与木炭在加热条件下生成的水蒸气,可在装置之间加上一个盛有无水CuSO4的硬质玻璃管。(6)、当D中产生现象时,可以说明使E中澄清石灰水变浑浊的是CO2 , 而不是SO2;写出D中发生反应的化学方程式。(7)、当D中反应转移电子0.3mol时,参加反应的气体体积(标准状况下)为L。