江苏省淮安市2021-2022学年高一上学期期末考试化学试题
试卷更新日期:2022-03-04 类型:期末考试
一、单选题
-
1. 2021年5月9日,我国第一所培养“碳中和”领域专门人才的新型研究型学院——西北大学榆林碳中和学院成立。下列措施或方法无助于实现“碳中和”的是( )A、可用碳酸钠溶液捕捉(吸收) B、煤中添加石灰石,以减少二氧化硫对环境的污染 C、开发新型光伏电池材料,提高太阳能电池的光电转换效率 D、开发新型催化剂直接利用太阳能和水制备氢气,制造氢能汽车2. 注射新冠疫苗能有效防止感染新冠病毒,装载疫苗的玻璃瓶是硼硅药用玻璃瓶,生产硼硅玻璃的主要原料是SiO2、Na2B4O7·10H2O、SiO2属于下列物质类型中的( )A、酸 B、碱 C、盐 D、氧化物3. 下列物质属于电解质的是( )A、氯水 B、酒精 C、KNO3固体 D、石墨4. 反应:可用于联合制碱。下列表示反应中相关微粒的化学用语正确的是( )A、的电子式:
 B、氯原子的结构示意图:
B、氯原子的结构示意图: C、中子数为10的氧原子:
D、电离:
5. 下列有关物质性质与用途对应关系正确的是( )A、溶液呈碱性,可用于治疗胃酸过多 B、次氯酸具有强氧化性,可用于杀菌消毒 C、具有还原性,可用于纸浆漂白 D、明矾易溶于水,可用作净水剂6. 下列生活中常见物质主要成分的化学式表示正确的是( )A、纯碱- B、钡餐- C、熟石灰- D、胆矾-7. 室温下,下列各组离子在指定溶液中能大量共存的是( )A、溶液:、、、 B、溶液:、、、 C、溶液:、、、 D、溶液:、、、8. 下列图示对应的操作规范的是( )A、称量
C、中子数为10的氧原子:
D、电离:
5. 下列有关物质性质与用途对应关系正确的是( )A、溶液呈碱性,可用于治疗胃酸过多 B、次氯酸具有强氧化性,可用于杀菌消毒 C、具有还原性,可用于纸浆漂白 D、明矾易溶于水,可用作净水剂6. 下列生活中常见物质主要成分的化学式表示正确的是( )A、纯碱- B、钡餐- C、熟石灰- D、胆矾-7. 室温下,下列各组离子在指定溶液中能大量共存的是( )A、溶液:、、、 B、溶液:、、、 C、溶液:、、、 D、溶液:、、、8. 下列图示对应的操作规范的是( )A、称量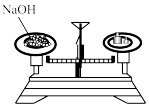 B、过滤
B、过滤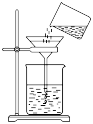 C、将剩余钠放回试剂瓶
C、将剩余钠放回试剂瓶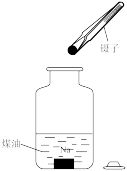 D、转移溶液
D、转移溶液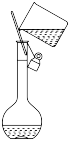 9. 下列指定的离子方程式正确的是( )A、氯气溶于水: B、碳酸钙溶于醋酸: C、钠和水反应: D、硫酸与氢氧化钡溶液反应:10. 下列关于NaHCO3和Na2CO3说法正确的是( )A、用澄清石灰水鉴别NaHCO3和Na2CO3 B、NaHCO3固体中含少量Na2CO3杂质,可通过加热的方法除去 C、向同浓度NaHCO3和Na2CO3溶液中滴加几滴酚酞,NaHCO3的红色较深 D、相同温度下,0.1 mol/L的两种盐溶液分别与同浓度的稀盐酸反应,NaHCO3较剧烈11. 在题给条件下,下列选项所示的物质间转化能实现的是( )A、 B、 C、浓硫酸 D、12. 下列分离混合物的方法中不正确的是( )A、使浑浊的食盐水变澄清——过滤 B、从溴水中分离出溴——萃取、分液 C、从酒精和水的混合物中分离出酒精——蒸馏 D、把硝酸钾和氯化钾从同一溶液中分离开来——蒸发结晶13. 关于海水资源的综合利用,下列说法不正确的是( )A、海水中含量最高的盐是NaCl B、电解饱和食盐水可以制得金属钠 C、从海水中提取的镁可用于制造火箭、飞机 D、食用含碘丰富的海产品可防治甲状腺肿大14. 下列对浓硫酸的叙述中,正确的是( )A、常温下不能用铁、铝容器盛放浓硫酸,因为铁、铝是活泼金属 B、浓硫酸和碳单质加热反应,表现出强氧化性 C、浓硫酸具有吸水性,可以使蔗糖脱水炭化 D、滴加浓硫酸使胆矾由蓝色晶体变为无色粉末,属于物理变化15. ClO2和亚氯酸钠(NaClO2)都是广泛使用的漂白剂、消毒剂。高浓度 ClO2气体易发生爆炸,在生产、使用时需用其他气体进行稀释。某工厂生产 ClO2和NaClO2的工艺流程为∶
9. 下列指定的离子方程式正确的是( )A、氯气溶于水: B、碳酸钙溶于醋酸: C、钠和水反应: D、硫酸与氢氧化钡溶液反应:10. 下列关于NaHCO3和Na2CO3说法正确的是( )A、用澄清石灰水鉴别NaHCO3和Na2CO3 B、NaHCO3固体中含少量Na2CO3杂质,可通过加热的方法除去 C、向同浓度NaHCO3和Na2CO3溶液中滴加几滴酚酞,NaHCO3的红色较深 D、相同温度下,0.1 mol/L的两种盐溶液分别与同浓度的稀盐酸反应,NaHCO3较剧烈11. 在题给条件下,下列选项所示的物质间转化能实现的是( )A、 B、 C、浓硫酸 D、12. 下列分离混合物的方法中不正确的是( )A、使浑浊的食盐水变澄清——过滤 B、从溴水中分离出溴——萃取、分液 C、从酒精和水的混合物中分离出酒精——蒸馏 D、把硝酸钾和氯化钾从同一溶液中分离开来——蒸发结晶13. 关于海水资源的综合利用,下列说法不正确的是( )A、海水中含量最高的盐是NaCl B、电解饱和食盐水可以制得金属钠 C、从海水中提取的镁可用于制造火箭、飞机 D、食用含碘丰富的海产品可防治甲状腺肿大14. 下列对浓硫酸的叙述中,正确的是( )A、常温下不能用铁、铝容器盛放浓硫酸,因为铁、铝是活泼金属 B、浓硫酸和碳单质加热反应,表现出强氧化性 C、浓硫酸具有吸水性,可以使蔗糖脱水炭化 D、滴加浓硫酸使胆矾由蓝色晶体变为无色粉末,属于物理变化15. ClO2和亚氯酸钠(NaClO2)都是广泛使用的漂白剂、消毒剂。高浓度 ClO2气体易发生爆炸,在生产、使用时需用其他气体进行稀释。某工厂生产 ClO2和NaClO2的工艺流程为∶
ClO2发生器中反应为(未配平),下列有关该反应的说法中,正确的是( )
A、反应中 Na2SO3是氧化剂 B、反应中 ClO2是氧化产物 C、每生成1 mol ClO2转移2 mol 电子 D、参加反应的NaClO3和Na2SO3的物质的量之比为2:116. 和亚氯酸钠()都是广泛使用的漂白剂、消毒剂。高浓度气体易发生爆炸,在生产、使用时需用其他气体进行稀释。某工厂生产和的工艺流程为:
下列关于生产流程的相关说法,不正确的是( )
A、工业上将制成固体,便于贮存和运输 B、“操作A”包括过滤、洗涤、干燥 C、生产时向发生器中通入空气,可避免发生危险 D、吸收器中生成的离子方程式为:17. 下列说法正确的是( )A、用饱和溶液除去气体中的 B、利用丁达尔效应可以鉴别氢氧化铁胶体和氯化铁溶液 C、配制溶液需称取固体9.6g D、溶液与溶液中前者大18. 根据下列实验操作和现象所得到的结论正确的是( )选项
实验操作和现象
实验结论
A
向某溶液中加入溶液并加热,产生能使湿润红色石蕊试纸变蓝的气体
该溶液中一定含有
B
向某白色粉末中滴加稀盐酸,产生能使澄清石灰水变浑浊的气体
该粉末一定是碳酸盐
C
向某无色溶液滴加盐酸酸化的溶液,产生白色沉淀
该溶液中一定含
D
用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色
该溶液中一定不含
A、A B、B C、C D、D二、综合题
-
19. 随着原子序数的递增,A~G七种短周期元素的最高正价或最低负价与原子序数的关系如图所示。
 (1)、G元素在周期表中的位置为。(2)、元素A与C形成 分子的电子式为 , B元素的单质的结构式为。(3)、A、B、F三种元素的原子半径由大到小的顺序是。(填元素符号)(4)、D元素最高价氧化物的水化物所含的化学键有(填化学键类型),D元素最高价氧化物的水化物与E元素的最高价氧化物的水化物反应的离子方程式是。(5)、元素C、G形成的简单气态氢化物中, 与 的稳定性较强的是(填化学式)。(6)、最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷( )是37号元素,相对原子质量是85,位于ⅠA族。关于铷的下列说法中不正确的是____(填序号)。A、与水反应比钠更剧烈 B、与水能剧烈反应并释放出 C、单质 具有很强的氧化性 D、的碱性比同浓度的 弱20. 实验室里可用如下图所示的装置制取氯酸钾、次氯酸钠,并验证氯水的性质。
(1)、G元素在周期表中的位置为。(2)、元素A与C形成 分子的电子式为 , B元素的单质的结构式为。(3)、A、B、F三种元素的原子半径由大到小的顺序是。(填元素符号)(4)、D元素最高价氧化物的水化物所含的化学键有(填化学键类型),D元素最高价氧化物的水化物与E元素的最高价氧化物的水化物反应的离子方程式是。(5)、元素C、G形成的简单气态氢化物中, 与 的稳定性较强的是(填化学式)。(6)、最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷( )是37号元素,相对原子质量是85,位于ⅠA族。关于铷的下列说法中不正确的是____(填序号)。A、与水反应比钠更剧烈 B、与水能剧烈反应并释放出 C、单质 具有很强的氧化性 D、的碱性比同浓度的 弱20. 实验室里可用如下图所示的装置制取氯酸钾、次氯酸钠,并验证氯水的性质。
图中a为氯气发生装置,c的试管中盛有15mL30%的溶液,并置于热水浴中,d的试管中盛有15mL 8%的溶液,并置于冰水浴中,f为的发生装置。
(1)、制取氯气时,在烧瓶中先加入一定量的固体,再通过(填写仪器名称)向烧瓶中加入适量的浓盐酸。(2)、装置b的作用是。(3)、f装置中反应的化学方程式为。(4)、比较制取氯酸钾和次氯酸钠的条件,两者的差异是。(5)、反应完毕经冷却后,c装置的试管中有大量晶体析出,图中符合该晶体溶解度随温度变化规律的曲线是(选填字母);从c装置的试管中分离该晶体的操作是(填写实验操作名称)。 (6)、将d中余气与f中产生的气体通入e中,产生的现象为。(7)、该实验有一处明显的缺点是。21. 认识含硫物质的性质及转化规律,能帮助我们更好地认识自然和保护环境。(1)、模拟酸雨的形成原因。将气体通入蒸馏水中,取出部分溶液并用计测定其 , 每隔10min读数一次,所得数据如下:
(6)、将d中余气与f中产生的气体通入e中,产生的现象为。(7)、该实验有一处明显的缺点是。21. 认识含硫物质的性质及转化规律,能帮助我们更好地认识自然和保护环境。(1)、模拟酸雨的形成原因。将气体通入蒸馏水中,取出部分溶液并用计测定其 , 每隔10min读数一次,所得数据如下:时间(min)
0
10
20
30
40
4.95
4.94
4.86
485
485
随着时间的推移,逐渐变小的原因是(用化学方程式表示)。
(2)、防治对环境的污染。①从物质分类角度看,属于酸性氧化物。工业上常用将转化为亚硫酸盐,写出所得亚硫酸盐的化学式:。
②从元素价态看,中S元素为+4价,既具有氧化性,又具有还原性。用生物质热解气(主要成分为、、)可将在高温下还原成单质硫。写出还原反应的化学方程式:。
(3)、获取空气质量信息。某化学小组为了测定空气中的体积分数,做了如下实验:取标准状况下的空气20.00L(含、、、),缓慢通过足量氯水中,在所得溶液中加入稍过量的溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为2.33g。①将上述空气缓慢通过足量氯水,写出反应的离子方程式:。
②检验沉淀是否洗涤干净的方法是。
③求空气样品中的体积分数。(写出计算过程)