浙江省台州市2021-2022学年高二上学期期末质量评估化学试题
试卷更新日期:2022-03-04 类型:期末考试
一、单选题
-
1. 下列能级符号符合题意且可容纳电子数最多的是( )A、6s B、5p C、4d D、3f2. 下列反应的是( )A、石墨燃烧 B、分解 C、与水反应 D、盐酸与溶液反应3. 下列生产生活中的应用与盐类水解原理无关的是( )A、泡沫灭火器灭火 B、溶液去油污 C、明矾净水 D、油脂和反应制肥皂4. 已知(设、不随温度变化),当时反应能自发进行。反应的自发情况是( )A、高温下能自发进行 B、任意温度下都不能自发进行 C、低温下能自发进行 D、任意温度下都能自发进行5. 关于热化学方程式,下列说法正确的是( )A、和充分反应后放出热量196.6 , 则 B、的单位中“”是指“每摩尔反应” C、已知 , 则HNC(g)更稳定 D、甲烷的燃烧热为 , 则甲烷燃烧的热化学方程式表示为6. 从植物花汁中提取的一种有机物可简化表示为(HIn),在水溶液中存在下列平衡,故可用作酸碱指示剂, , 在该指示剂溶液中加入下列物质,最终能使指示剂显黄色的是( )A、盐酸 B、溶液 C、溶液 D、固体7. 已知: , , 下列关于合成氨工业的说法不正确的是( )A、温度选择400~500℃是为了提高氮气的转化率 B、将原料气净化处理是为了防止其中混有的杂质使催化剂“中毒” C、不选择过高压强的主要原因是压强越大,对材料的强度和设备的制造要求越高 D、迅速冷却、液化氨气是为了使化学平衡向生成氨气的方向移动8. 依据图示关系,等于( )
 A、+0.5 B、-0.5 C、+24.78 D、-24.789. 在两个密闭的锥形瓶中,0.05g形状相同的镁条(过量)分别与的盐酸和醋酸溶液反应,测得容器内压强随时间的变化曲线如图。下列说法正确的是( )
A、+0.5 B、-0.5 C、+24.78 D、-24.789. 在两个密闭的锥形瓶中,0.05g形状相同的镁条(过量)分别与的盐酸和醋酸溶液反应,测得容器内压强随时间的变化曲线如图。下列说法正确的是( ) A、①代表的是盐酸与镁条反应时容器内压强随时间的变化曲线 B、在100~150s时间段内,盐酸与反应的速率快于醋酸与反应的速率 C、反应中醋酸的电离被促进,两种溶液最终产生的氢气总量基本相等 D、用溶液完全中和上述两种酸溶液,盐酸消耗溶液的体积更多10. 用0.100的溶液滴定的溶液,测得滴定过程中溶液的变化如图所示。下列说法不正确的是( )
A、①代表的是盐酸与镁条反应时容器内压强随时间的变化曲线 B、在100~150s时间段内,盐酸与反应的速率快于醋酸与反应的速率 C、反应中醋酸的电离被促进,两种溶液最终产生的氢气总量基本相等 D、用溶液完全中和上述两种酸溶液,盐酸消耗溶液的体积更多10. 用0.100的溶液滴定的溶液,测得滴定过程中溶液的变化如图所示。下列说法不正确的是( ) A、①点溶液中: B、②点溶液中: C、③点溶液中: D、在相同温度下,①、②、③三点溶液中水电离的:③<②<①11. 碱性锌锰电池的总反应为: , 以溶液为电解质,下列关于该电池的说法正确的是( )A、为正极 B、为负极 C、工作时电子由经外电路流向 D、工作时没有发挥作用12. 氯碱工业中,离子交换膜法电解饱和食盐水的示意图如下。下列说法正确的是( )
A、①点溶液中: B、②点溶液中: C、③点溶液中: D、在相同温度下,①、②、③三点溶液中水电离的:③<②<①11. 碱性锌锰电池的总反应为: , 以溶液为电解质,下列关于该电池的说法正确的是( )A、为正极 B、为负极 C、工作时电子由经外电路流向 D、工作时没有发挥作用12. 氯碱工业中,离子交换膜法电解饱和食盐水的示意图如下。下列说法正确的是( ) A、电子从电极B经溶液流向电极A B、电极A发生还原反应 C、电极B为阴极 D、c处是稀氯化钠溶液13. 已知:、 , 将含有固体的水垢浸泡在适量的饱和溶液中,下列说法正确的是( )A、固体逐渐溶解,最后消失 B、浸泡后的固体加盐酸,有无色无味气体产生 C、浸泡后固体质量不变 D、浸泡后固体质量增加14. 下列有关化学反应速率,说法正确的是( )A、对于化学反应,增大压强一定可增大活化分子数百分数,从而加快化学反应速率 B、使用合适催化剂,能增大活化分子百分数,所以反应速率增大 C、对于可逆反应,升高反应体系温度,正反应速率增大,逆反应速率减小 D、增加反应物的量,能增大活化分子百分数,所以反应速率增大15. 已知部分弱酸的电离平衡常数如表所示:
A、电子从电极B经溶液流向电极A B、电极A发生还原反应 C、电极B为阴极 D、c处是稀氯化钠溶液13. 已知:、 , 将含有固体的水垢浸泡在适量的饱和溶液中,下列说法正确的是( )A、固体逐渐溶解,最后消失 B、浸泡后的固体加盐酸,有无色无味气体产生 C、浸泡后固体质量不变 D、浸泡后固体质量增加14. 下列有关化学反应速率,说法正确的是( )A、对于化学反应,增大压强一定可增大活化分子数百分数,从而加快化学反应速率 B、使用合适催化剂,能增大活化分子百分数,所以反应速率增大 C、对于可逆反应,升高反应体系温度,正反应速率增大,逆反应速率减小 D、增加反应物的量,能增大活化分子百分数,所以反应速率增大15. 已知部分弱酸的电离平衡常数如表所示:弱酸
电离平衡常数(25℃)
下列离子方程式不正确的是( )
A、少量通入溶液中: B、少量加入溶液中: C、过量加溶液中: D、相同浓度溶液与溶液等体积混合:16. 我国嫦娥五号探测器带回1.731的月球土壤,经分析发现其构成与地球土壤类似。土壤中含有的短周期元素W、X、Y、Z,原子序数依次增大,W元素基态原子2p能级仅有一对成对电子。基态X原子的价电子排布式为。基态Z元素原子最外电子层上s、p电子数相等,下列结论正确的是( )A、原子半径大小顺序为X B、
B、 C、
C、 D、
D、 19. 常温下的沉淀溶解平衡曲线如图所示,下列叙述中正确的是( )
19. 常温下的沉淀溶解平衡曲线如图所示,下列叙述中正确的是( ) A、常温下,a点对应的溶液能再溶解固体 B、c点对应的溶液中、不能形成沉淀 C、加入溶液可以使的减小 D、加入可以使溶液由a点变到b点20. 浓度是影响化学反应速率的因素之一。实验表明,反应的速率与浓度关系为 , 其中k为速率常数,恒温时k是定值。采取下列措施,对增大化学反应速率有明显效果的是( )A、增大 B、恒容体系充入稀有气体使压强增大 C、增大 D、将产物从体系中分离出去21. 1100℃,在恒容密闭容器中加入一定量FeO(s)与CO(g),发生反应 , 一段时间后达到平衡。下列说法不正确的是( )A、升高温度,若减小,则 B、加入一定量CO(g),平衡正向移动,的体积分数增大 C、改变浓度使 , 平衡将逆向移动 D、若减小容器体积,平衡不移动22. 在1L真空密闭容器中加入固体,t℃时发生如下反应:①②③ , 一段时间后达到平衡。下列说法不正确的是( )A、通入 , 增大 B、 C、增大容器体积,减小 D、反应①的平衡常数表达式为 , 且仅与温度有关23. 常温下,现有0.1 mol/L碳酸氢铵溶液pH=7.8,已知含氮(或含碳)各微粒的分布分数与pH的关系如下图所示,下列说法正确的是( )
A、常温下,a点对应的溶液能再溶解固体 B、c点对应的溶液中、不能形成沉淀 C、加入溶液可以使的减小 D、加入可以使溶液由a点变到b点20. 浓度是影响化学反应速率的因素之一。实验表明,反应的速率与浓度关系为 , 其中k为速率常数,恒温时k是定值。采取下列措施,对增大化学反应速率有明显效果的是( )A、增大 B、恒容体系充入稀有气体使压强增大 C、增大 D、将产物从体系中分离出去21. 1100℃,在恒容密闭容器中加入一定量FeO(s)与CO(g),发生反应 , 一段时间后达到平衡。下列说法不正确的是( )A、升高温度,若减小,则 B、加入一定量CO(g),平衡正向移动,的体积分数增大 C、改变浓度使 , 平衡将逆向移动 D、若减小容器体积,平衡不移动22. 在1L真空密闭容器中加入固体,t℃时发生如下反应:①②③ , 一段时间后达到平衡。下列说法不正确的是( )A、通入 , 增大 B、 C、增大容器体积,减小 D、反应①的平衡常数表达式为 , 且仅与温度有关23. 常温下,现有0.1 mol/L碳酸氢铵溶液pH=7.8,已知含氮(或含碳)各微粒的分布分数与pH的关系如下图所示,下列说法正确的是( ) A、NH4HCO3溶液中存在下列关系: B、当溶液的pH=9时,溶液中存在下列关系: C、通过分析可知常温下 D、分析可知,常温下水解平衡常数的数量级为10-1024. 一定压强下,向10L密闭容器中充入 和 , 发生反应: 。 的消耗速率(v)、 的消耗速率(v)、温度(T)三者的关系如图所示,以下说法中不正确的是( )
A、NH4HCO3溶液中存在下列关系: B、当溶液的pH=9时,溶液中存在下列关系: C、通过分析可知常温下 D、分析可知,常温下水解平衡常数的数量级为10-1024. 一定压强下,向10L密闭容器中充入 和 , 发生反应: 。 的消耗速率(v)、 的消耗速率(v)、温度(T)三者的关系如图所示,以下说法中不正确的是( )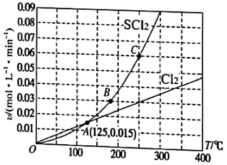 A、A,B,C三点对应状态下,达到平衡状态的是C B、温度升高,平衡常数K减小 C、若投料改为通入 和 , 的平衡转化率不变 D、125℃,平衡时 的消耗速率为0.01525. 溶液和溶液可发生反应: , 为探究反应速率与的关系,进行如下实验:常温常压下,向锥形瓶中加入一定体积(V)的溶液、溶液和水,充分搅拌。控制体系温度,再通过分液漏斗向锥形瓶中加入1.0醋酸。当导管口气泡均匀稳定冒出时,开始用排水法收集气体。用秒表测量收集所需要的时间(t)。实验数据如下表。下列说法正确的是( )
A、A,B,C三点对应状态下,达到平衡状态的是C B、温度升高,平衡常数K减小 C、若投料改为通入 和 , 的平衡转化率不变 D、125℃,平衡时 的消耗速率为0.01525. 溶液和溶液可发生反应: , 为探究反应速率与的关系,进行如下实验:常温常压下,向锥形瓶中加入一定体积(V)的溶液、溶液和水,充分搅拌。控制体系温度,再通过分液漏斗向锥形瓶中加入1.0醋酸。当导管口气泡均匀稳定冒出时,开始用排水法收集气体。用秒表测量收集所需要的时间(t)。实验数据如下表。下列说法正确的是( )溶液
溶液
醋酸
水
1
4.0
4.0
8.0
334
2
4.0
4.0
150
3
8.0
4.0
4.0
4.0
83
4
12.0
4.0
4.0
0.0
38
A、实验3用表示的反应平均速率 B、若实验4从反应开始到反应结束历时bs,则用表示的反应平均速率 C、;若 , 则 D、醋酸的作用是加快反应速率,改变其浓度对该反应速率无影响二、填空题
-
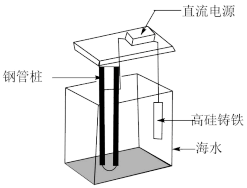
26. 回答下列问题(1)、一种锂离子电池,以LiPF6 (六氟磷酸锂)的碳酸酯溶液(无水)为电解质溶液,其中P元素在周期表中的位置是 , 写出其基态原子的价层电子的轨道表示式 , Li、P、F三种元素的基态原子的第一电离能由大到小顺序为(请填元素符号)。(2)、海港、码头的钢管桩会受到海水的长期侵蚀,常用外加电流法对其进行保护,工作原理如图所示。钢管桩上主要发生的电极反应式为:(假设海水为氯化钠溶液,下同)。也可以在钢管桩上焊接锌块进行保护,钢管桩中的铁上主要发生的电极反应式为:。
 27. 检测血液中钙离子的含量能够帮助判断多种疾病。某研究小组测定血液样品中的Ca2+(100 mL血液中含Ca2+的质量),实验步骤如下:
27. 检测血液中钙离子的含量能够帮助判断多种疾病。某研究小组测定血液样品中的Ca2+(100 mL血液中含Ca2+的质量),实验步骤如下:①准确量取5.00 mL血液样品,处理后配制成50.00 溶液;
②准确量取溶液20.00 mL,加入过量 溶液,使Ca2+完全转化成 沉淀;
③过滤并洗净所得 沉淀,用过量稀硫酸溶解,生成 和 稀溶液;
④加入 的酸性KMnO4溶液,使H2C2O4完全被氧化。
⑤用 (NH4)2Fe(SO4)2溶液滴定过量的酸性KMnO4溶液。
回答下列问题:
(1)、常温下 , 欲使步骤②中Ca2+完全沉淀( ),应保持溶液中 ≥mol/L。(2)、(NH4)2Fe(SO4)2中Fe元素基态原子的价层电子排布式为。(3)、(NH4)2Fe(SO4)2溶液应装在滴定管中(填写“酸式”或“碱式”),该溶液中所有离子浓度大小顺序为。(4)、步骤⑤,滴定的过程中有以下实验操作:a.向溶液中加入1~2滴指示剂
b.取待测的KMnO4溶液放入锥形瓶中
c.用蒸馏水洗净锥形瓶
d.用少量KMnO4溶液润洗锥形瓶
e.用(NH4)2Fe(SO4)2溶液滴定
f.重复以上操作
g.眼睛观察锥形瓶中溶液颜色的变化,至滴定终点
h.根据实验数据计算KMnO4溶液的物质的量
正确的操作顺序是(填序号)。
(5)、滴定过程中,滴定前后体积如图所示,则消耗(NH4)2Fe(SO4)2溶液的体积为mL。 28. 废水中的重金属离子通常用沉淀法除去。已知常温下各物质的溶度积或电离平衡常数如下表所示,请回答下列问题:(1)、溶液中加入一定量的反应后溶液呈中性,该溶液中(用 , 、等物质的浓度来表示)(2)、溶液中(填“>”、“<”、“=”),若向此溶液中加入溶液,恰好完全反应,所得溶液的7(填“>”、“<”、“=”)。(3)、向浓度均为0.1的和的混合溶液中加溶液,当加入溶液至出现两种沉淀时,则溶液中。(4)、向溶液中滴加溶液,滴加过程中与溶液体积(V)的关系如图所示。
28. 废水中的重金属离子通常用沉淀法除去。已知常温下各物质的溶度积或电离平衡常数如下表所示,请回答下列问题:(1)、溶液中加入一定量的反应后溶液呈中性,该溶液中(用 , 、等物质的浓度来表示)(2)、溶液中(填“>”、“<”、“=”),若向此溶液中加入溶液,恰好完全反应,所得溶液的7(填“>”、“<”、“=”)。(3)、向浓度均为0.1的和的混合溶液中加溶液,当加入溶液至出现两种沉淀时,则溶液中。(4)、向溶液中滴加溶液,滴加过程中与溶液体积(V)的关系如图所示。
A、B、C三点溶液中,水的电离程度最小的是点;溶液碱性最强的是点;和的乘积最小的是点。
29. 一定温度、压强下:反应的相关信息如下表:活化能Ea
H-H键能
I-I键能
-11
173.1
436
151
键能:气态分子中1化学键解离成气态原子所吸收的能量。
(1)、反应的焓变= , 活化能=。(2)、关于反应 , 下列描述正确的是____A.和的总能量为587A、和的总能量大于的能量 B、加入催化剂,若正反应活化能减小100 , 则逆反应活化能也减小100 C、恒温恒容,向已平衡体系中再加入 , 正反应活化能减小,逆反应活化能不变(3)、研究发现,大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。实际上是经过下列两步基元反应完成的:基元反应i:(快反应) 活化能:
基元反应ii:(慢反应) 活化能:
①决定反应速率的步骤是(填“i”或“ii”),0(填“>”、“<”、“=”)
②将和通入1L容器中,达到化学平衡后将温度升高10℃,达到新平衡后,较原平衡(填“增大”、“减小”或“不变”),请依据升高温度时基元反应i、ii的平衡移动情况,综合考虑浓度与温度对反应i平衡移动的影响,分析变化的原因:。
30. 丙烯是重要的有机化工原料,工业上丙烷脱氢可制丙烯:(1)、298K时,部分物质的相对能量见下表:物质
能量()
-103
21
0
-242
-286
可根据相关物质的相对能量计算反应的(忽略随温度的变化),例如: , 请写出丙烷脱氢制丙烯的热化学方程式:。
(2)、工业上丙烷脱氢制丙烯反应的相对压力平衡常数表达式。[用平衡相对分压代替平衡浓度,气体的平衡相对分压等于其平衡分压(单位为)除以p0。例如:的平衡分压用“”表示](3)、温度为T1 , 总压恒定为100 , 下列情况能说明上述反应达到平衡状态的是____A.该反应的焓变不变 B.体系温度不变A、体系压强不变 B、气体密度不变(4)、温度为T1时,总压恒定为100 , 在密闭容器中通入和稀有气体(稀有气体不参与反应)的混合气体,的平衡转化率与通入气体中的物质的量分数的关系如图虚线所示。
①请分析稀有气体的作用并解释图线变化的原因:。
②催化剂可提高生产效率,请在图中用实线绘制在相同温度和压强下,加入固体催化剂时,的平衡转化率与通入气体中的物质的量分数的关系曲线。
(5)、一种丙烷脱氢制丙烯工艺生产中将稀有气体改为气体。600℃,将一定浓度的与固定浓度的通过含催化剂的恒容反应器,经相同时间,流出的、和浓度随初始浓度的变化关系如图,改为气体的好处是。