浙江省绍兴柯桥区2021-2022学年高二上学期期末教学质量调测化学试题
试卷更新日期:2022-03-04 类型:期末考试
一、单选题
-
1. 下列物质属于强电解质的是( )A、KOH B、H3PO4 C、SO3 D、CH3CHO2. 下列物质溶于水时,能使水的电离平衡向左移动的是( )A、 B、 C、 D、3. 室温下,柠檬水溶液的pH=3,其中c(OH-)为多少( )A、0.1mol/L B、1×10-3mol/L C、1×10-7mol/L D、1×10-11mol/L4. 在下列变化中,体系的熵增大的是( )A、乙烯聚合为聚乙烯 B、硝酸铵溶于水 C、水结冰 D、5. 通常情况下,测量某溶液pH最精密的是( )A、广泛pH试纸 B、酚酞试液 C、pH计 D、精密pH试纸6. 下列不需要通电就能够实现的是( )A、电解饱和食盐水 B、电镀 C、电离 D、电冶金7. 以下能级符号不正确的是( )A、6s B、3d C、4f D、1p8. 对Na、Mg、Al的有关性质的叙述中,正确的是( )A、金属性:Na<Mg<Al
B、电负性:Na<Mg<Al C、第一电离能:Na<Mg<Al D、还原性:Mg<Al<Na 9. 下列说法正确的是( )A、p能级能量一定比s能级的能量高 B、2p、3p、4p能级的轨道数依次增多 C、、、轨道相互垂直,且能量各不相等 D、从空间角度看,2s轨道比1s轨道大,其空间包含了1s轨道10. 难溶电解质在水中达到沉淀溶解平衡时,下列说法中不正确的是( )A、沉淀的速率和溶解的速率相等 B、难溶电解质在水中形成饱和溶液 C、再加入难溶电解质,溶液中各离子的浓度不变 D、难溶电解质溶解形成的阴、阳离子的浓度相等11. 一定条件下的密闭容器中发生反应: 。当达到平衡时,下列各项措施中,能提高乙烷转化率的是( )A、缩小容器的容积 B、降低反应的温度 C、分离出部分氢气 D、等容下通入稀有气体12. 合成氨中的原料气进入合成塔前需经过铜氨液处理,目的是除去其中的CO,发生的反应为: , 。铜氨液吸收CO适宜的生产条件是( )A、低温和高压 B、高温和低压 C、加快原料气的通入速率 D、吸收效果与铜氨溶液的浓度无关13. 下列说法不正确的是( )A、化学反应速率是可以通过实验测定的 B、研究反应热时需要明确体系与环境 C、完全燃烧生成气态水时所放出的热量称为氢气的燃烧热 D、可以采用定性和定量的方法研究影响化学反应速率的因素14. 常温下1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于( )A、9.0 B、9.5 C、1 0.5 D、1 1.015. 某温度下在密闭容器中发生如下反应:2M(g)+N(g)⇌2E(g)若开始时只充入2molE(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2molM和1molN的混合气体,达平衡时M的转化率为( )A、20% B、40% C、60% D、80%16. 某反应过程的能量变化如图所示,下列说法不正确的是( )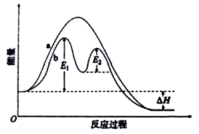 A、该反应为放热反应 B、曲线b为使用催化剂的反应历程,且包含多个基元反应 C、使用催化剂可以降低反应的活化能 D、活化分子间发生的碰撞一定是有效碰撞17. 一种用于心脏起搏器的微型电池,其电极材料是石墨和锂,电解质溶液为等物质的量的LiCl、溶解在中形成的溶液。这种电池的总的反应为: , 下列说法不正确的是( )A、该电池具有容量大、寿命长和电压稳定等特点 B、石墨是正极 C、可以用来代替 D、正极反应式为:18. 下列分子中的中心原子发生 sp2 杂化的是( )A、CH4 B、NH3 C、BF3 D、H2O19. 下列粒子的VSEPR模型为四面体且其空间结构为Ⅴ形的是。( )A、 B、 C、 D、20. 下列说法正确的是( )A、可燃冰中甲烷分子与水分子间形成了氢键 B、“”三原子不在一条直线上时,不可能形成氢键 C、非极性分子中可能含有极性键 D、卤素单质、卤素氢化物的熔沸点均随着相对分子质量的增大而升高21. 在气态和液态时,分子结构如图所示,下列关于分子的说法正确的是( )
A、该反应为放热反应 B、曲线b为使用催化剂的反应历程,且包含多个基元反应 C、使用催化剂可以降低反应的活化能 D、活化分子间发生的碰撞一定是有效碰撞17. 一种用于心脏起搏器的微型电池,其电极材料是石墨和锂,电解质溶液为等物质的量的LiCl、溶解在中形成的溶液。这种电池的总的反应为: , 下列说法不正确的是( )A、该电池具有容量大、寿命长和电压稳定等特点 B、石墨是正极 C、可以用来代替 D、正极反应式为:18. 下列分子中的中心原子发生 sp2 杂化的是( )A、CH4 B、NH3 C、BF3 D、H2O19. 下列粒子的VSEPR模型为四面体且其空间结构为Ⅴ形的是。( )A、 B、 C、 D、20. 下列说法正确的是( )A、可燃冰中甲烷分子与水分子间形成了氢键 B、“”三原子不在一条直线上时,不可能形成氢键 C、非极性分子中可能含有极性键 D、卤素单质、卤素氢化物的熔沸点均随着相对分子质量的增大而升高21. 在气态和液态时,分子结构如图所示,下列关于分子的说法正确的是( )
①每个原子都达到8电子稳定结构,且为非极性分子
②键角有180°、120°、90°三种
③受热后会分解生成 , 分子呈三角锥形
④分子中5个键完全相同
A、①④ B、②③ C、①③④ D、②③④22. 利用电解法可以将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述中不正确的是( )A、电解时以粗铜作阳极 B、电解时阳极上只发生的反应为 C、精铜连接电源的负极,其电极反应式为 D、电解后,电解槽底部会形成含有少量Ag、Pt等金属的阳极泥23. 支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助电极。下列有关表述不正确的是( ) A、被保护的钢管桩为阴极,高硅铸铁惰性辅助电极为阳极 B、高硅铸铁的作用是作为损耗阳极材料和传递电流 C、通入的保护电流应该根据环境条件变化进行调整 D、通入的保护电流应使钢管桩表面腐蚀电流接近于零24. 在25℃时,浓度均为的和混合溶液,。已知: , 为的水解常数。下列说法正确的是( )A、用pH广泛试纸和pH计均可测定该混合溶液的pH值 B、混合溶液中: C、25℃时, , 且混合溶液加水稀释时,增大 D、向100mL上述混合溶液中滴加1-2滴NaOH稀溶液,溶液pH发生突变25. 人体血液里最主要的缓冲体系是碳酸氢盐缓冲体系(H2CO3/HCO),该体系的主要作用是维持血液中pH保持稳定。在人体正常体温时,H2CO3HCO+H+的Ka=10−6.1 , 正常人的血液中c(HCO):c(H2CO3)≈20:1,则下列判断正确的是(已知lg2=0.3)( )A、正常人血液内Kw=10-14 B、当过量的碱进入血液中时,只发生反应HCO+OH-=CO+H2O C、正常人血液中存在:c(HCO)+c(OH-)+2c(CO)=c(H+)+c(H2CO3) D、由题给数据可算得正常人血液的pH约为7.4
A、被保护的钢管桩为阴极,高硅铸铁惰性辅助电极为阳极 B、高硅铸铁的作用是作为损耗阳极材料和传递电流 C、通入的保护电流应该根据环境条件变化进行调整 D、通入的保护电流应使钢管桩表面腐蚀电流接近于零24. 在25℃时,浓度均为的和混合溶液,。已知: , 为的水解常数。下列说法正确的是( )A、用pH广泛试纸和pH计均可测定该混合溶液的pH值 B、混合溶液中: C、25℃时, , 且混合溶液加水稀释时,增大 D、向100mL上述混合溶液中滴加1-2滴NaOH稀溶液,溶液pH发生突变25. 人体血液里最主要的缓冲体系是碳酸氢盐缓冲体系(H2CO3/HCO),该体系的主要作用是维持血液中pH保持稳定。在人体正常体温时,H2CO3HCO+H+的Ka=10−6.1 , 正常人的血液中c(HCO):c(H2CO3)≈20:1,则下列判断正确的是(已知lg2=0.3)( )A、正常人血液内Kw=10-14 B、当过量的碱进入血液中时,只发生反应HCO+OH-=CO+H2O C、正常人血液中存在:c(HCO)+c(OH-)+2c(CO)=c(H+)+c(H2CO3) D、由题给数据可算得正常人血液的pH约为7.4二、综合题
-
26. 请回答以下问题:(1)、在常温下,溶液的 , 则溶液中由水电离出来的。(2)、火箭发射可以用肼( , 液态)作燃料,作氧化剂,两者反应生成和水蒸气。
已知: ,
,
请写出与反应的热化学方程式。
(3)、常压下,物质的汽化热(液体在恒温下转化为气体时所吸收的热量)见下表:Ne
汽化热
548
1369
105
汽化热特别大的原因是。
(4)、下表列出了某短周期元素R的各级电离能数据(用、……表示)。元素
电离能
…
R
740
1500
7700
10500
13630
…
关于元素R的下列推断中,正确的是(用相应的编号填写)
①R元素基态原子的电子排布式为
②R元素位于元素周期表中第ⅡA族
③R元素的最高正化合价为价
④R元素的第一电离能高于同周期相邻元素的第一电离能
(5)、溶液与1.95g锌粉在量热计中充分反应。测得反应前温度为20.1℃,反应后最高温度为30.1℃。已知:反应前后,溶液的比热容均近似为、溶液的密度均近似为 , 忽略溶液体积、质量变化和金属吸收的热量。则反应放出的热量Q=J。
(6)、根据甲醇在酸性电解质溶液中与氧气反应生成二氧化碳和水,设计了一种原电池,则该电池工作时,负极上反应的电极反应式为。27. 合成气(CO+H2)在煤化工和天然气化工中有着十分重要的地位,由合成气可合成多种有机基础原料和产品。(1)、煤化工中生产合成气的反应为: ,①该反应的平衡常数表达式为
②判断该反应的自发性
③在恒温恒容下,同时放入、、、四种物质,下列事实能够说明反应已达到平衡的是。
A.反应体系中,混合气体的密度不再改变
B.反应体系中,各组分的物质的量相等
C.反应体系中,当有键断裂的同时有键断裂
D.混合气体的平均相对分子质量保持不变
(2)、天然气化工中生产合成气的主要反应为: , , 在恒容容器中按物质的量之比1∶2加入一定量的和 , 在压强为、不同温度下测得的平衡转化率如下图所示:
①请在图中画出压强为时的平衡转化率随温度的变化曲线。
②现有实验测得反应在750℃下,以不同碳氧比[]投料时反应达平衡后的转化率及、CO的选择性,所测数据如表所示。
已知:选择性=目标产物的产率/反应原料的转化率
碳氧比[]
1∶0.25
1∶0.5
1∶1
1∶1.25
转化率
0.40
0.88
0.98
0.99
选择性
0.98
0.93
0.67
0.40
CO选择性
0.99
0.94
0.65
0.32
最佳碳氧比[]为。
假设按碳氧比投料,反应容器的体积为VL,通入和各amol,请列式表示平衡时容器内CO的浓度(用a、V的代数式表示)
28. 室温下,用滴定溶液过程中,溶液的pH随NaOH溶液体积的变化如下图所示。 (1)、酸碱式滴定管在加溶液滴定前,需要的操作是和。(2)、配制上述NaOH标准溶液时,下列仪器中不必要用到的有。(用编号表示)
(1)、酸碱式滴定管在加溶液滴定前,需要的操作是和。(2)、配制上述NaOH标准溶液时,下列仪器中不必要用到的有。(用编号表示)①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
(3)、当时,溶液中所有离子的浓度存在的关系是。(4)、已知 , 当加入的时,溶液中pH=。(5)、下列说法不正确的是____。A、NaOH与盐酸恰好完全反应时, B、选择甲基红指示反应终点,误差比甲基橙的大 C、当接近滴定终点时,极少量的碱就会引起溶液的pH突变 D、选择变色范围在pH突变范围内的指示剂,可减小实验误差 E、当用滴定溶液时,其突变范围比滴定溶液的突变范围大(6)、在化学分析中,以标准溶液滴定溶液中的时,采用为指示剂,利用和反应生成砖红色沉淀表示滴定终点。当溶液中的恰好完全沉淀时,溶液中的;。已知:①25℃时, ,
②当溶液中某种离子的浓度等于或小于时,可认为已完全沉淀。
29. 氮元素可以形成多种化合物。回答以下问题:(1)、基态氮原子的核外电子排布式是。(2)、N原子的第一电离能比O原子的第一电离能要大,可能原因是。(3)、肼分子可视为分子中的一个氢原子被(氨基)所取代形成的另一种氮的氢化物。分子的VSEPR模型名称是;分子中氮原子轨道的杂化类型是。(4)、图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。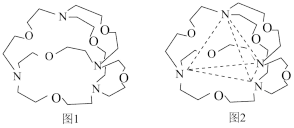
下列分子或离子中,能被该有机化合物识别的是____(填标号)。
A、 B、 C、 D、(5)、下列说法正确的是____。A、、、分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构 B、HCN的分子结构为直线形 C、离子的VSEPR模型与空间结构是一致的 D、分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强