浙江省宁波市慈溪市2021-2022学年高二上学期期末考试化学试题
试卷更新日期:2022-03-04 类型:期末考试
一、单选题
-
1. 下列属于弱电解质的是( )A、酒精 B、AlCl3 C、醋酸 D、BaSO42. 下列溶液一定呈酸性的是( )A、pH<7的电解质溶液 B、含有H+的溶液 C、NaHA溶液 D、c(H+)>c(OH-)的溶液3. 用一定浓度的盐酸滴定未知浓度的NaOH溶液中,不需要用到的仪器是( )A、
 B、
B、 C、
C、 D、
D、 4. 下列反应中生成物总能量高于反应物总能量的是( )A、氧化钙与水反应 B、Ba(OH)2·8H2O晶体与NH4Cl晶体反应 C、盐酸与氢氧化钠反应 D、氢气与氯气反应5. 下列原子轨道的表示不正确的是( )A、1s B、2p C、3px D、3f6. 下列说法不正确的是( )A、原子核外电子排布,先排满K层再排L层、先排满M层再排N层 B、同一原子中,1s、2s、3s电子的能量逐渐增大 C、2p、3p、4p的轨道形状均为哑铃形 D、各能层含有的原子轨道数为n2(n为能层序数)7. 下列属于基态排布的原子或离子核外电子排布式的是( )A、Br-:3d104s24p6 B、Cr:[Ar]3d54s1 C、Na:1s22s22p53s2 D、Fe2+:[Ar]3d64s28. 按照核外电子排布,可把元素周期表划分为5个区。下列元素中,与其他元素不处在同一个区的是( )A、Ne B、Al C、Pb D、Cu9. 下列说法正确的是( )A、测定中和反应反应热的实验中,可用铜丝代替玻璃搅拌器 B、需要加热才能发生的反应是吸热反应 C、升高温度,反应速率加快,主要原因是活化分子的百分数增加 D、甲烷的标准燃烧热为-890.3kJ·mol-1 , 则甲烷燃烧的热化学方程式表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-110. 下列关于如图所示转化关系(X代表Cl、Br、I),说法不正确的是( )
4. 下列反应中生成物总能量高于反应物总能量的是( )A、氧化钙与水反应 B、Ba(OH)2·8H2O晶体与NH4Cl晶体反应 C、盐酸与氢氧化钠反应 D、氢气与氯气反应5. 下列原子轨道的表示不正确的是( )A、1s B、2p C、3px D、3f6. 下列说法不正确的是( )A、原子核外电子排布,先排满K层再排L层、先排满M层再排N层 B、同一原子中,1s、2s、3s电子的能量逐渐增大 C、2p、3p、4p的轨道形状均为哑铃形 D、各能层含有的原子轨道数为n2(n为能层序数)7. 下列属于基态排布的原子或离子核外电子排布式的是( )A、Br-:3d104s24p6 B、Cr:[Ar]3d54s1 C、Na:1s22s22p53s2 D、Fe2+:[Ar]3d64s28. 按照核外电子排布,可把元素周期表划分为5个区。下列元素中,与其他元素不处在同一个区的是( )A、Ne B、Al C、Pb D、Cu9. 下列说法正确的是( )A、测定中和反应反应热的实验中,可用铜丝代替玻璃搅拌器 B、需要加热才能发生的反应是吸热反应 C、升高温度,反应速率加快,主要原因是活化分子的百分数增加 D、甲烷的标准燃烧热为-890.3kJ·mol-1 , 则甲烷燃烧的热化学方程式表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-110. 下列关于如图所示转化关系(X代表Cl、Br、I),说法不正确的是( ) A、△H2>0,△H3<0 B、△H1=△H2+△H3 C、△H1越小,HX越稳定 D、若X分别是Cl、Br、I,则过程III放出的热量依次增多11. 下列说法正确的是( )A、反应C(s)+H2O(g)⇌H2(g)+CO(g),碳的质量不再改变说明反应已达平衡 B、反应2A(?)+B(g)⇌2C(?),若压强不再随时间变化能说明已达平衡,则A、C同时是气体 C、反应H2(g)+I2(g)⇌2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变 D、1molN2和3molH2反应,达平衡时H2转化率为10%,放出热量Q1;在相同温度和压强下,当2molNH3分解为N2和H2的转化率为90%时,吸收热量Q2 , 则Q2等于Q112. 氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法不正确的是( )A、一定温度下,反应2H2(g)+O2(g)=2H2O(g)能自发进行,该反应的△H<0 B、氢能有可能成为人类未来的主要能源 C、氢氧燃料电池放电过程中消耗11.2LH2 , 则转移电子的数目为6.02×1023 D、反应2H2(g)+O2(g)=2H2O(g)的△H可通过下式估算:△H=反应中断裂旧共价键的键能之和-反应中形成新共价键的键能之和13. 在表面无锈的铁片上滴食盐水,一段时间后有铁锈出现。此过程反应为:2Fe+2H2O+O2=2Fe(OH)2 , Fe(OH)2进一步被氧气氧化为Fe(OH)3 , 再在一定条件下脱水生成铁锈,其原理如图。下列说法不正确的是( )
A、△H2>0,△H3<0 B、△H1=△H2+△H3 C、△H1越小,HX越稳定 D、若X分别是Cl、Br、I,则过程III放出的热量依次增多11. 下列说法正确的是( )A、反应C(s)+H2O(g)⇌H2(g)+CO(g),碳的质量不再改变说明反应已达平衡 B、反应2A(?)+B(g)⇌2C(?),若压强不再随时间变化能说明已达平衡,则A、C同时是气体 C、反应H2(g)+I2(g)⇌2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变 D、1molN2和3molH2反应,达平衡时H2转化率为10%,放出热量Q1;在相同温度和压强下,当2molNH3分解为N2和H2的转化率为90%时,吸收热量Q2 , 则Q2等于Q112. 氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法不正确的是( )A、一定温度下,反应2H2(g)+O2(g)=2H2O(g)能自发进行,该反应的△H<0 B、氢能有可能成为人类未来的主要能源 C、氢氧燃料电池放电过程中消耗11.2LH2 , 则转移电子的数目为6.02×1023 D、反应2H2(g)+O2(g)=2H2O(g)的△H可通过下式估算:△H=反应中断裂旧共价键的键能之和-反应中形成新共价键的键能之和13. 在表面无锈的铁片上滴食盐水,一段时间后有铁锈出现。此过程反应为:2Fe+2H2O+O2=2Fe(OH)2 , Fe(OH)2进一步被氧气氧化为Fe(OH)3 , 再在一定条件下脱水生成铁锈,其原理如图。下列说法不正确的是( ) A、铁片发生氧化反应而被腐蚀 B、铁片腐蚀最严重区域应该是生锈最多的区域 C、铁片腐蚀中正极发生的电极反应:2H2O+O2+4e-=4OH- D、铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀14. NO与CO是燃油汽车尾气中的两种有害气体,常温常压下它们之间的反应:CO(g)+NO(g)⇌CO2(g)+N2(g) △H=-874.3 kJ/mol K=2.5×1060。有关该反应的说法不正确的是( )A、因为K很大,所以反应速率很大,NO与CO排入大气之前就已经反应完全 B、升高温度,反应速率增大,K减小 C、增大压强,平衡向右移动,K不变 D、选用适宜催化剂可使其达到尾气排放标准15. 在一密闭容器中,反应aA(g)⇌bB(g)达平衡后,保持温度不变,把容器体积压缩到原来的一半且达到新平衡时,A的浓度是原来的2.5倍,则下列说法正确的是( )A、平衡向正反应方向移动 B、物质A的转化率变小 C、物质B的质量分数增加 D、a>b16. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、1L浓度为0.1mol/L的NaHCO3溶液中,的物质的量等于0.1mol B、标准状况下,将22.4LCl2通入水中,HClO、Cl-、ClO-的粒子数之和为2NA C、镀铜过程中,阳极(纯铜)质量减小32g,转移电子数为NA D、相等pH的NaOH溶液和Na2CO3溶液中,水电离出的c(H+)相等17. 室温下,对于0.1mol/L醋酸溶液。下列判断正确的是( )A、加入少量CH3COONa固体后,溶液的pH降低 B、该溶液中c(CH3COO-)+c(OH-)=c(H+) C、滴加NaOH溶液过程中,n(CH3COO-)与n(CH3COOH)之和始终为0.1mol D、与Na2CO3溶液反应的离子方程式为+2H+=H2O+CO2↑18. 下列化学语言表示正确的是( )A、醋酸的电离方程式:CH3COOH=CH3COO-+H+ B、碳酸钠溶液呈现碱性的原因:+H2O=H2CO3+2OH- C、用碳酸钠溶液处理水垢中的硫酸钙:CaSO4+=CaCO3+ D、稀硫酸与氢氧化钡溶液反应:Ba2++=BaSO4↓19. 如图所示的4个试管实验中均产生了白色沉淀,下列说法中正确的是( )
A、铁片发生氧化反应而被腐蚀 B、铁片腐蚀最严重区域应该是生锈最多的区域 C、铁片腐蚀中正极发生的电极反应:2H2O+O2+4e-=4OH- D、铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀14. NO与CO是燃油汽车尾气中的两种有害气体,常温常压下它们之间的反应:CO(g)+NO(g)⇌CO2(g)+N2(g) △H=-874.3 kJ/mol K=2.5×1060。有关该反应的说法不正确的是( )A、因为K很大,所以反应速率很大,NO与CO排入大气之前就已经反应完全 B、升高温度,反应速率增大,K减小 C、增大压强,平衡向右移动,K不变 D、选用适宜催化剂可使其达到尾气排放标准15. 在一密闭容器中,反应aA(g)⇌bB(g)达平衡后,保持温度不变,把容器体积压缩到原来的一半且达到新平衡时,A的浓度是原来的2.5倍,则下列说法正确的是( )A、平衡向正反应方向移动 B、物质A的转化率变小 C、物质B的质量分数增加 D、a>b16. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、1L浓度为0.1mol/L的NaHCO3溶液中,的物质的量等于0.1mol B、标准状况下,将22.4LCl2通入水中,HClO、Cl-、ClO-的粒子数之和为2NA C、镀铜过程中,阳极(纯铜)质量减小32g,转移电子数为NA D、相等pH的NaOH溶液和Na2CO3溶液中,水电离出的c(H+)相等17. 室温下,对于0.1mol/L醋酸溶液。下列判断正确的是( )A、加入少量CH3COONa固体后,溶液的pH降低 B、该溶液中c(CH3COO-)+c(OH-)=c(H+) C、滴加NaOH溶液过程中,n(CH3COO-)与n(CH3COOH)之和始终为0.1mol D、与Na2CO3溶液反应的离子方程式为+2H+=H2O+CO2↑18. 下列化学语言表示正确的是( )A、醋酸的电离方程式:CH3COOH=CH3COO-+H+ B、碳酸钠溶液呈现碱性的原因:+H2O=H2CO3+2OH- C、用碳酸钠溶液处理水垢中的硫酸钙:CaSO4+=CaCO3+ D、稀硫酸与氢氧化钡溶液反应:Ba2++=BaSO4↓19. 如图所示的4个试管实验中均产生了白色沉淀,下列说法中正确的是( ) A、Na2CO3溶液和NaHCO3溶液中含有的微粒种类不同 B、Na2CO3溶液比NaHCO3溶液的pH大 C、Ca2+、Al3+均促进了、的水解 D、滴加溶液后,4支试管内溶液的pH都变小20. 向20 mL0.5 mol/L的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法中正确的是( )
A、Na2CO3溶液和NaHCO3溶液中含有的微粒种类不同 B、Na2CO3溶液比NaHCO3溶液的pH大 C、Ca2+、Al3+均促进了、的水解 D、滴加溶液后,4支试管内溶液的pH都变小20. 向20 mL0.5 mol/L的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法中正确的是( )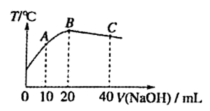 A、醋酸的电离平衡常数:B点<A点 B、由水电离出的c(OH-):B点>C点 C、从A点到B点,混合溶液中不可能存在:c(CH3COO-)=c(Na+) D、从B点到C点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)21. 25℃时,下列说法正确的是( )A、可溶性正盐BA溶液呈中性,则HA是强酸 B、若测得0.01mol/LHA溶液pH>2,则HA是弱酸 C、含 的溶液中,可能大量存在:Na+、 、Al3+ D、等pH等体积的HClO、HCl溶液分别与浓度相同的NaOH溶液反应呈中性,HClO消耗的NaOH溶液体积少22. 常温下,已知Ksp(ZnS)=1.6×10-24 , Ksp(CuS)=1.3×10-36。如图所示为CuS和ZnS饱和溶液中阳离子(R2+)浓度与阴离子(S2-)浓度的负对数关系,下列说法正确的是( )
A、醋酸的电离平衡常数:B点<A点 B、由水电离出的c(OH-):B点>C点 C、从A点到B点,混合溶液中不可能存在:c(CH3COO-)=c(Na+) D、从B点到C点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)21. 25℃时,下列说法正确的是( )A、可溶性正盐BA溶液呈中性,则HA是强酸 B、若测得0.01mol/LHA溶液pH>2,则HA是弱酸 C、含 的溶液中,可能大量存在:Na+、 、Al3+ D、等pH等体积的HClO、HCl溶液分别与浓度相同的NaOH溶液反应呈中性,HClO消耗的NaOH溶液体积少22. 常温下,已知Ksp(ZnS)=1.6×10-24 , Ksp(CuS)=1.3×10-36。如图所示为CuS和ZnS饱和溶液中阳离子(R2+)浓度与阴离子(S2-)浓度的负对数关系,下列说法正确的是( ) A、曲线A表示的是ZnS,曲线B表示的是CuS B、向曲线A表示的溶液中加入Na2S溶液,可实现n点到m点的转换 C、p点表示CuS或ZnS中无沉淀析出 D、向CuS饱和溶液中加入CuCl2固体,CuS的溶解平衡逆向移动,Ksp(CuS)减小23. 废水中通过加入适量乙酸钠,设计成微生物电池可以将废水中的氯苯转化为苯而除去,其原理如图所示。则下列叙述正确的是( )
A、曲线A表示的是ZnS,曲线B表示的是CuS B、向曲线A表示的溶液中加入Na2S溶液,可实现n点到m点的转换 C、p点表示CuS或ZnS中无沉淀析出 D、向CuS饱和溶液中加入CuCl2固体,CuS的溶解平衡逆向移动,Ksp(CuS)减小23. 废水中通过加入适量乙酸钠,设计成微生物电池可以将废水中的氯苯转化为苯而除去,其原理如图所示。则下列叙述正确的是( ) A、温度升高,该电池反应速率一定加快 B、H+由a极穿过质子交换膜到达b极 C、OH-迁移的数量等于导线上通过电子的数量 D、a极电极反应式为:
A、温度升高,该电池反应速率一定加快 B、H+由a极穿过质子交换膜到达b极 C、OH-迁移的数量等于导线上通过电子的数量 D、a极电极反应式为: +2e-+H+=
+2e-+H+= +Cl-
24. 一定条件下,向绝热恒容密闭容器中通入SO2和NO2 , 使反应SO2(g)+NO2(g)⇌SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图。下列说法正确的是( )
+Cl-
24. 一定条件下,向绝热恒容密闭容器中通入SO2和NO2 , 使反应SO2(g)+NO2(g)⇌SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图。下列说法正确的是( ) A、反应在c点达到平衡状态 B、△t1=△t2时,SO2的转化率:a~b段等于b~c段 C、反应物的总能量高于生成物的总能量 D、反应物浓度:a点小于b点25. 已知氧化性:Fe3+>I2.某溶液X可能含有K+、、Fe3+、Fe2+、、、、I-、Cl-中的一种或几种,现进行以下实验:
A、反应在c点达到平衡状态 B、△t1=△t2时,SO2的转化率:a~b段等于b~c段 C、反应物的总能量高于生成物的总能量 D、反应物浓度:a点小于b点25. 已知氧化性:Fe3+>I2.某溶液X可能含有K+、、Fe3+、Fe2+、、、、I-、Cl-中的一种或几种,现进行以下实验: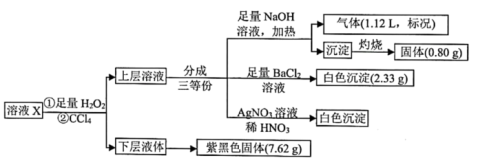
下列说法正确的是( )
A、无法判断K+是否存在, B、溶液X中一定存在、I-、Cl-、 C、取X溶液加入足量稀硫酸,加热,可能产生混合气体 D、溶液X中Cl-的物质的量为0.090mol二、综合题
-
26. A、B、C、D、E、F是元素周期表前四周期中的常见元素,其原子序数依次增大。A元素的一种核素的质量数是14,中子数是8;B元素基态原子的最外层有3个未成对电子,次外层有2个电子;C是地壳中含量最多的一种元素;D元素基态原子核外9个原子轨道上填充了电子且有1个未成对电子;E是一种常见的金属元素,可形成多种氧化物,其中一种氧化物是具有磁性的黑色物质;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。请完成以下空白:(1)、D元素的基态原子中,核外电子占据的最高能层的符号为 , 基态C离子占据的最高能级共有个原子轨道。(2)、B元素的基态原子价层电子的电子排布图为。(3)、请解释E3+离子比E2+离子稳定的原因:。(4)、基态F二价阳离子的核外电子排布式为。(5)、A,B,C三种元素的第一电离能从大到小为(用元素符号表示)。(6)、BD3与水反应产生有漂白性的物质,写出该反应的化学方程式。
三、填空题
-
27. 化学反应过程既是物质的转化过程,也是能量的转化过程。(1)、下列属于吸热过程的是(填序号)。
a.CO燃烧 b.铝和稀盐酸反应 c.碳酸氢钠溶于水 d.石灰石分解
(2)、t℃时,关于N2、NH3的两个反应的信息如下表所示:化学反应
正反应活化能
逆反应活化能
t℃时平衡常数
N2(g)+O2(g)=2NO(g) △H>0
akJ/mol
bkJ/mol
K1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H<0
ckJ/mol
dkJ/mol
K2
请写出t℃时,NH3被NO氧化生成无毒气体的热化学方程式(反应热用a、b、c、d代数式表示)。t℃时,该反应的平衡常数(用K1和K2表示)。
(3)、二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。目前已开发出如图所示用电解法制取ClO2的新工艺。用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。精制饱和食盐水入口是口(填“c”或“d”)产生ClO2的电极反应式为。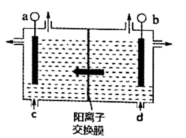 28. 二氧化碳的转化和利用成为实现“碳达峰”、“碳中和”的重要研究课题。回答下列问题:(1)、利用CO2和H2可生产乙烯。相关热化学方程式为:
28. 二氧化碳的转化和利用成为实现“碳达峰”、“碳中和”的重要研究课题。回答下列问题:(1)、利用CO2和H2可生产乙烯。相关热化学方程式为:反应I:2CO2(g)+6H2(g) CH2=CH2(g)+4H2O(g) △H1=−246.4 kJ∙mol−1
反应II:CO2(g)+4H2(g) CH4(g)+2H2O(g) △H2=−166.8 kJ∙mol−1
某催化剂作用下,在容积为2.0L的恒容密闭容器中充入1molCO2和3molH2 , 体系中主要发生上述反应I和反应II两个竞争反应。反应进行tmin时测得两种烃的物质的量随温度的变化如图所示,该催化剂在840℃时主要选择反应(填“I”或“II”);840℃之后,C2H4产量下降的原因是。

520℃时,0~tmin内用氢气表示反应II的平均反应速率:υ(H2)=mol/(L·min)(用含t的代数式表示)。
(2)、利用工业废气CO2制甲醇,发生反应III:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H3<0,可一定程度摆脱当下对化石燃料的依赖。①上述反应自发的条件是。
②在aL密闭容器中,充入不同氢碳比的原料气体,控制温度600K,发生反应III,请在图中画出CH3OH在混合气体中的平衡体积分数随氢碳比递增的变化趋势。
③一定条件下,将1molCO2和1molH2置于恒容密闭容器中,发生反应III。下列能说明反应达到平衡状态的是。
A.混合气体的密度保持不变
B.CO2的消耗速率与H2O的消耗速率相等
C.CO2的体积分数保持不变
D.混合气体的平均相对分子质量保持不变
29. 平衡思想是化学研究的一个重要观念,在水溶液中存在多种平衡体系。(1)、①室温下,0.1mol/L的醋酸在水中有1%发生电离,则该温度下CH3COOH的电离平衡常数Ka≈。②在25C时,将amol/L的氨水与0.01mol/L的盐酸等体积混合(忽略混合时的溶液体积变化),反应平衡时溶液中c( )=c(Cl-),则溶液显(填“酸“碱”或“中”)性。
(2)、已知,常温下几种物质的电离常数如下:化学式
H2CO3
HClO
H2SO3
电离平衡常数
Ka1=4.5×10-7
Ka2=1.4×10-11
Ka=3.0×10-8
Ka1=1.4×10-2
Ka2=6.0×10-8
①三种相同物质的量浓度的Na2CO3、NaClO、NaHSO3的pH从小到大的排序是。
②下列说法正确的是。
A.Ca(ClO)2溶液中通入少量SO2:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
B.常温下,将SO2通入氨水中,当c(OH-)降至1.0×10-7mol/L时,溶液中的 =0.6
C.等物质的量浓度的NaHSO3与Na2SO4混合液中,3c(Na+)=2c( )+2c( )+2c(H2SO3)
D.Na2CO3溶液中加入少量水,则溶液中 将减小
③根据表中数据,计算0.03mol/LNaClO溶液的pH≈。
四、综合题
-
30. 可利用滴定法来测定燃煤尾气中SO2的含量,实验室按以下步骤进行(假定无其它还原性物质):
①取标况下1000mL尾气样品,通入适量NaOH溶液中;
②配制成250mL溶液;
③准确量取25.00mL;
④将25.00mL溶液置于锥形瓶中;
⑤用0.0100mol/L的酸性KMnO4溶液进行滴定,消耗酸性KMnO4溶液VmL。
(1)、步骤⑤中,滴定达到终点的现象是。(2)、下列说法正确的是____。 A、滴定前,锥形瓶和滴定管均须用标准溶液润洗 B、图中应将凡士林涂在旋塞的a端和旋塞套内的c端 C、将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移 D、滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡,会造成测定结果偏低 E、达到滴定终点读取数据时,俯视滴定管液面,会造成测定结果偏低(3)、该尾气中SO2的含量为g/L(用含V的最简式表示)。
A、滴定前,锥形瓶和滴定管均须用标准溶液润洗 B、图中应将凡士林涂在旋塞的a端和旋塞套内的c端 C、将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移 D、滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡,会造成测定结果偏低 E、达到滴定终点读取数据时,俯视滴定管液面,会造成测定结果偏低(3)、该尾气中SO2的含量为g/L(用含V的最简式表示)。
-