浙江省金衢六校联盟2021-2022学年高二上学期期末联考化学试题
试卷更新日期:2022-03-04 类型:期末考试
一、单选题
-
1. 下列物质属于强电解质的是( )A、 B、溶液 C、KCl固体 D、(乙醇)2. 下列外界因素中不可能会引起化学平衡移动的是( )A、反应物浓度 B、催化剂 C、压强 D、温度3. 用Na2CO3固体配制1.00 mol/L碳酸钠溶液,必需用到的仪器是( )A、
 B、
B、 C、
C、 D、
D、 4. 下列化学用语的表述不正确的是( )A、35Cl和37Cl的原子结构示意图均可表示为:
4. 下列化学用语的表述不正确的是( )A、35Cl和37Cl的原子结构示意图均可表示为: B、HClO的结构式:H-O-Cl
C、基态碳原子的轨道表示式:
B、HClO的结构式:H-O-Cl
C、基态碳原子的轨道表示式: D、HF的电子式:
D、HF的电子式: 5. 下列装置中,都伴随有能量变化,其中是由化学能转变为电能的是( )
5. 下列装置中,都伴随有能量变化,其中是由化学能转变为电能的是( )A.
B.
C.
D.
电解水
水力发电
太阳能热水器
干电池工作



 A、A B、B C、C D、D6. 下列电离方程式不正确的是( )A、H2CO32H++CO B、2H2OH3O++OH- C、NaHCO3=Na++HCO D、CH3COOHCH3COO-+H+7. 利用如图所示装置进行中和热测定实验,下列说法不正确的是( )
A、A B、B C、C D、D6. 下列电离方程式不正确的是( )A、H2CO32H++CO B、2H2OH3O++OH- C、NaHCO3=Na++HCO D、CH3COOHCH3COO-+H+7. 利用如图所示装置进行中和热测定实验,下列说法不正确的是( ) A、向盛装酸溶液的烧杯中加碱溶液时要小心缓慢 B、烧杯间填满碎泡沫塑料是为了减少实验过程中的热量损失 C、使用玻璃搅拌器既可以搅拌又可以避免损坏温度计 D、测定酸溶液后的温度计要用蒸馏水清洗、擦干后再测碱溶液的温度8. 下列说法不正确的是( )A、同位素示踪法常用于研究化学反应历程 B、采用合适的催化剂可以使一些不自发的化学反应得以实现 C、可以利用物质的颜色变化和浓度变化间的比例关系来测量反应速率 D、勒夏特列原理无法解释将平衡体系加压后颜色变深9. 如图为氟利昂(如CFCl3)破坏臭氧层的反应过程示意图,下列不正确的是( )
A、向盛装酸溶液的烧杯中加碱溶液时要小心缓慢 B、烧杯间填满碎泡沫塑料是为了减少实验过程中的热量损失 C、使用玻璃搅拌器既可以搅拌又可以避免损坏温度计 D、测定酸溶液后的温度计要用蒸馏水清洗、擦干后再测碱溶液的温度8. 下列说法不正确的是( )A、同位素示踪法常用于研究化学反应历程 B、采用合适的催化剂可以使一些不自发的化学反应得以实现 C、可以利用物质的颜色变化和浓度变化间的比例关系来测量反应速率 D、勒夏特列原理无法解释将平衡体系加压后颜色变深9. 如图为氟利昂(如CFCl3)破坏臭氧层的反应过程示意图,下列不正确的是( ) A、过程Ⅰ中断裂极性键C-Cl键 B、过程Ⅱ可表示为O3 + Cl = ClO + O2 C、过程Ⅲ中O + O = O2是吸热过程 D、上述过程说明氟利昂中氯原子是破坏O3的催化剂10. 甲烷消除NO2的污染原理为:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)。在一定温度下,向恒容密闭容器中充入一定量的CH4和NO2进行上述反应。下列表述能用来判断该反应达到化学平衡状态的是( )A、v正(CH4)=2v逆(NO2) B、容器中混合气体的平均密度不再变化 C、容器中混合气体总压强不再发生变化 D、单位时间内,消耗1molCH4同时生成1molCO211. 如图是元素周期表前四周期的一部分,下列有关说法正确的是( )
A、过程Ⅰ中断裂极性键C-Cl键 B、过程Ⅱ可表示为O3 + Cl = ClO + O2 C、过程Ⅲ中O + O = O2是吸热过程 D、上述过程说明氟利昂中氯原子是破坏O3的催化剂10. 甲烷消除NO2的污染原理为:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)。在一定温度下,向恒容密闭容器中充入一定量的CH4和NO2进行上述反应。下列表述能用来判断该反应达到化学平衡状态的是( )A、v正(CH4)=2v逆(NO2) B、容器中混合气体的平均密度不再变化 C、容器中混合气体总压强不再发生变化 D、单位时间内,消耗1molCH4同时生成1molCO211. 如图是元素周期表前四周期的一部分,下列有关说法正确的是( )X
W
Y
R
Z
A、电负性:W>X B、第一电离能:W C、五种元素形成的单质中,Z形成的单质沸点最高 D、R元素形成的单质中没有化学键12. 相同温度和压强下,关于物质熵的大小比较,合理的是( )A、 B、 C、 D、1mol干冰13. 如图所示,ΔE1=393.5kJ,ΔE2=395.4kJ,下列说法正确的是 ( ) A、1mol石墨完全转化为金刚石需吸收1.9kJ热量 B、石墨和金刚石之间的转化是物理变化 C、金刚石的稳定性强于石墨 D、1mol金刚石具有的总能量高于1molCO2的总能量14. NA为阿伏加德罗常数的值。下列说法不正确的是( )A、标准状况下,2.24L氧气中含有原子的数目为0.2NA B、1L0.1mol/LNa2SO4溶液中,含有Na+的数目为0.2NA C、常温常压下,18g水中含有氢氧键的数目为NA D、0.1molCl2与足量的Fe反应,转移电子的数目为0.2NA15. 下列化学原理的应用,不能用沉淀溶解平衡原理来解释的是( )A、热纯碱溶液的洗涤油污能力强 B、误将当作食盐食用时,常用0.5%的溶液解毒 C、溶洞、珊瑚的形成 D、牙膏中添加氟化物能起到预防龋齿的作用16. 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,下列说法正确的是( )
A、1mol石墨完全转化为金刚石需吸收1.9kJ热量 B、石墨和金刚石之间的转化是物理变化 C、金刚石的稳定性强于石墨 D、1mol金刚石具有的总能量高于1molCO2的总能量14. NA为阿伏加德罗常数的值。下列说法不正确的是( )A、标准状况下,2.24L氧气中含有原子的数目为0.2NA B、1L0.1mol/LNa2SO4溶液中,含有Na+的数目为0.2NA C、常温常压下,18g水中含有氢氧键的数目为NA D、0.1molCl2与足量的Fe反应,转移电子的数目为0.2NA15. 下列化学原理的应用,不能用沉淀溶解平衡原理来解释的是( )A、热纯碱溶液的洗涤油污能力强 B、误将当作食盐食用时,常用0.5%的溶液解毒 C、溶洞、珊瑚的形成 D、牙膏中添加氟化物能起到预防龋齿的作用16. 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,下列说法正确的是( )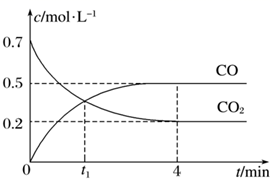 A、t1min时,正、逆反应速率的大小关系为v正=v逆 B、4min内,CO2的转化率为71.4% C、CO的反应速率v(CO)=0.125mol·L-1·s-1 D、保持容器压强不变,充入He,化学反应速率不变17. 下列说法不正确的是( )A、HBr分子中存在极性共价键 B、KOH晶体中既有离子键又有共价键 C、NaCl晶体溶于水时有离子键的断裂 D、NH3分子中每个原子最外电子层都具有8电子稳定结构18. 中科院大连化物所的材料化学研究团队在催化合成氨的研究过程中,开发了过渡金属-氢化锂复合催化剂,实现了氨的低温催化合成。下列说法正确的是( )A、优良的催化剂能使正、逆反应速率显著增大,能提高氨气的平衡产率 B、催化剂主要的功能是降低了反应所需的活化能,改变了反应的焓变 C、合成气中含有的杂质可能影响过渡金属-氢化锂复合催化剂的催化效果,引起催化剂中毒 D、合成氨时,使用过渡金属-氢化锂复合催化剂不能起到节能的效果19. 在氨水中,存在着电离平衡:NH3·H2O NH +OH−。下列说法正确的是( )A、温度不变时,加水稀释,电离平衡常数Kb增大 B、加入NaOH溶液,平衡一定向逆反应方向移动 C、加入NH4Cl固体,平衡向逆反应方向移动,c(NH )减小 D、加入冰醋酸,平衡向正反应方向移动20. 用如图实验装置进行相应实验,能达到实验目的的是( )
A、t1min时,正、逆反应速率的大小关系为v正=v逆 B、4min内,CO2的转化率为71.4% C、CO的反应速率v(CO)=0.125mol·L-1·s-1 D、保持容器压强不变,充入He,化学反应速率不变17. 下列说法不正确的是( )A、HBr分子中存在极性共价键 B、KOH晶体中既有离子键又有共价键 C、NaCl晶体溶于水时有离子键的断裂 D、NH3分子中每个原子最外电子层都具有8电子稳定结构18. 中科院大连化物所的材料化学研究团队在催化合成氨的研究过程中,开发了过渡金属-氢化锂复合催化剂,实现了氨的低温催化合成。下列说法正确的是( )A、优良的催化剂能使正、逆反应速率显著增大,能提高氨气的平衡产率 B、催化剂主要的功能是降低了反应所需的活化能,改变了反应的焓变 C、合成气中含有的杂质可能影响过渡金属-氢化锂复合催化剂的催化效果,引起催化剂中毒 D、合成氨时,使用过渡金属-氢化锂复合催化剂不能起到节能的效果19. 在氨水中,存在着电离平衡:NH3·H2O NH +OH−。下列说法正确的是( )A、温度不变时,加水稀释,电离平衡常数Kb增大 B、加入NaOH溶液,平衡一定向逆反应方向移动 C、加入NH4Cl固体,平衡向逆反应方向移动,c(NH )减小 D、加入冰醋酸,平衡向正反应方向移动20. 用如图实验装置进行相应实验,能达到实验目的的是( ) A、用图甲所示装置验证氨气溶于水呈碱性 B、用图乙所示装置制取CO2 C、用图丙所示装置验证镁片与稀盐酸反应放热 D、用图丁所示装置丁验证FeCl3对H2O2分解反应有催化作用21. 2024年的奥运会将在巴黎举行,沙滩排球比赛场地将设在埃菲尔铁塔前的战神广场,埃菲尔铁塔为钢铁结构,使用了250万个铆钉和近两万块铁片,以下说法不正确的是( )
A、用图甲所示装置验证氨气溶于水呈碱性 B、用图乙所示装置制取CO2 C、用图丙所示装置验证镁片与稀盐酸反应放热 D、用图丁所示装置丁验证FeCl3对H2O2分解反应有催化作用21. 2024年的奥运会将在巴黎举行,沙滩排球比赛场地将设在埃菲尔铁塔前的战神广场,埃菲尔铁塔为钢铁结构,使用了250万个铆钉和近两万块铁片,以下说法不正确的是( ) A、连接铁片的铆钉应该用铜质的 B、为了减缓钢铁生锈,工人们在铁塔表面涂上一层特制的油漆 C、巴黎的气候比较潮湿,比干燥的环境更易引起钢铁的生锈 D、可以在铁塔上镶嵌锌片,减慢钢铁的腐蚀速率22. 在饱和溶液中加入少量的溶液产生沉淀,若以Ksp表示的溶度积常数,则平衡后溶液中( )A、 B、 C、 D、23. 在一定体积的密闭容器中,进行反应:2X(g)+Y(s)Z(g)+W(g) H=akJ·mol-1 , 若其化学平衡常数K和温度t的关系如表。下列叙述正确的是( )
A、连接铁片的铆钉应该用铜质的 B、为了减缓钢铁生锈,工人们在铁塔表面涂上一层特制的油漆 C、巴黎的气候比较潮湿,比干燥的环境更易引起钢铁的生锈 D、可以在铁塔上镶嵌锌片,减慢钢铁的腐蚀速率22. 在饱和溶液中加入少量的溶液产生沉淀,若以Ksp表示的溶度积常数,则平衡后溶液中( )A、 B、 C、 D、23. 在一定体积的密闭容器中,进行反应:2X(g)+Y(s)Z(g)+W(g) H=akJ·mol-1 , 若其化学平衡常数K和温度t的关系如表。下列叙述正确的是( )t/℃
700
800
900
1000
1200
K
0.6
1.0
1.3
1.8
2.7
A、a<0 B、该反应的化学平衡常数表达式为:K= C、若在4L容器中通X和Y各1mol,在800℃下反应,某时刻测得X的物质的量为mol,说明该反应已达平衡 D、在1000℃时,反应Z(g)+W(g)2X(g)+Y(s)的平衡常数为1.824. 苹果酸(简写为)是二元弱酸,、。20℃时,向的溶液中缓慢通入气体(忽略溶液体积的变化)。下列指定溶液中微粒关系正确的是( )A、测得的溶液为8.6,此时溶液中存在: B、通入后的溶液中: C、在的溶液中: D、溶液从3.4变为2时,发生的主要反应为:25. 下列方案设计、现象和结论都正确的是( )目的
方案设计
现象和结论
A
检验淀粉是否已经发生水解
将淀粉和稀硫酸混合加热,再加入少量新制的Cu(OH)2 , 加热,没有砖红色沉淀产生
淀粉未发生水解
B
探究KI与FeCl3反应的限度
取5mL0.1mol·L-1KI溶液于试管中,加入1mL0.1mol·L-1FeCl3溶液,充分反应后滴入5滴15%KSCN溶液
若溶液变血红色,则KI与FeCl3的反应有一定限度
C
探究Na2SO3固体样品是否变质
取少量待测样品溶于蒸馏水,加入足量稀硫酸,再加入足量BaCl2溶液
若有白色沉淀产生,
则样品已经变质
D
检验气体Y
用湿润的淀粉碘化钾试纸检验气体Y,
试纸变蓝色,Y一定是Cl2
A、A B、B C、C D、D二、填空题
-
26. Mn与Fe两元素的部分电离能数据如下表所示:
元素
Mn
Fe
电离能/(kJ/mol)
I1
717
759
I2
1509
1561
I3
3248
2957
(1)、Mn与Fe两元素均位于元素周期表的区(2)、根据表中数据可知,气态再失去1个电子比气态再失去1个电子难,对此,你的解释是。27. 25℃时,三种酸的电离平衡常数如下:回答下列问题:化学式
CH3COOH
H2CO3
HClO
电离平衡常数
1.8×10-5
K1=4.3×10-7
K2=5.6×10-11
3.0×10-8
(1)、一般情况下,当温度升高时,电离平衡常数K(填“增大”、“减小”或“不变”)。(2)、下列四种离子结合质子能力最强的是(填字母)。a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)、下列反应不能发生的是(填字母)。a.CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+2HClO=CO2↑+H2O+2ClO-
d.2ClO-+CO2+H2O=CO32-+2HClO
三、综合题
-
28. 为了探究固体化合物X(仅含两种元素,)的组成和性质,设计并完成如下实验:

已知:气体A能使品红溶液褪色。请回答:
(1)、固体D的化学式是。(2)、固体X的化学式是。(3)、写出单质B中元素的基态原子价层电子排布式。(4)、氢气是一种理想的绿色能源,点燃前须进行的操作是。(5)、气体A→白色沉淀C的离子方程式是。29. 氯碱工业是高能耗产业,节能技术的研发是当前的重要课题。(1)、一种节能技术是将电解池与燃料电池相组合,相关物料传输与转化关系如下图所示,其中的电极未标出,所用的离子交换膜都只允许阳离子通过。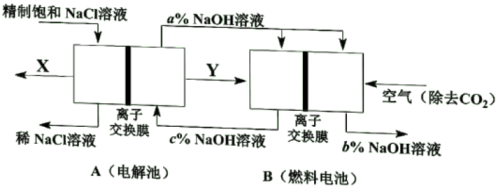
①当产生0.5molX时,A中通过离子交换膜的Na+有mol。
②写出燃料电池B中负极上的电极反应式。
③比较图中NaOH质量分数a%、b%、c%由大到小的顺序。
(2)、降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2 , 避免水电离的H+直接得电子生成H2 , 降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应式为。30. 钛在医疗领域的使用非常广泛,如制人造关节、头盖、主动心瓣等。是制备金属钛的重要中间体。某小组同学利用如下装置在实验室制备 (夹持装置略去)。
已知:HCl与不发生反应;装置C中除生成外,同时还生成一种有毒气态氧化物和少量。其它相关信息如下表所示:
熔点/℃
沸点/℃
密度/(g/cm3)
水溶性
-24
136.4
1.7
易水解生成白色沉淀,能溶于有机溶剂
-23
76.8
1.6
难溶于水
请回答下列问题:
(1)、装置A中导管a的作用为 , 装置B中所盛试剂为 , 装置A中发生反应的离子方程式为(反应后Mn元素以形式存在)。(2)、组装好仪器后,部分实验步骤如下:a.装入药品 b.打开分液漏斗活塞 c.检查装置气密性 d.关闭分液漏斗活塞 e.停止加热,充分冷却 f.加热装置C中陶瓷管
从上述选项选择合适操作(不重复使用)并排序:→→b→→→d。
(3)、下列说法不正确的是____。A、通入氯气之前,最好先从k处通入氮气,否则实验会失败 B、石棉绒载体是为了增大气体与、碳粉的接触面积,以加快反应速率 C、装置D中的烧杯中可加入冰水,便于收集到纯的液态 D、装置E可防止空气中的水蒸气进入装置D的圆底烧瓶中使变质 E、该装置有缺陷,通过装置E后的气体不可直接排放到空气中(4)、可制备纳米:以为载体,用和水蒸气反应生成。再控制温度生成纳米。测定产物组成的方法如下:步骤一:取样品2.100g用稀硫酸充分溶解得到 , 再用足量铝将还原为 , 过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,定容得到待测液。
步骤二:取待测液25.00mL于锥形瓶中,加几滴KSCN溶液作指示剂,用的标准溶液滴定,将氧化为 , 三次滴定消耗标准溶液的平均值为24.00mL。
①滴定终点的判断方法是。
②通过分析、计算,该样品的组成为。
31. 苯乙烯是一种重要的化工原料,可采用乙苯催化脱氢法制备,反应如下: (g)
(g)  (g)+H2(g) (1)、该反应在条件下能自发进行;既能提高该反应的速率又能提高乙苯的平衡转化率的单一措施是。(2)、当原料气中乙苯和水蒸气的物质的量之分别为1mol和4mol,反应在恒容容器中进行,测得容器总压P(总)和乙苯转化率α随时间变化结果如图所示。已知:A物质的分压为P(A)= 。则平衡时水的分压P(H2O)=kPa
(g)+H2(g) (1)、该反应在条件下能自发进行;既能提高该反应的速率又能提高乙苯的平衡转化率的单一措施是。(2)、当原料气中乙苯和水蒸气的物质的量之分别为1mol和4mol,反应在恒容容器中进行,测得容器总压P(总)和乙苯转化率α随时间变化结果如图所示。已知:A物质的分压为P(A)= 。则平衡时水的分压P(H2O)=kPa (3)、在相同的温度和催化剂的情况下,amol乙苯在VL的恒容容器中发生反应。苯乙烯的浓度随时间的变化示意图见下。若其它条件不变,amol乙苯在 L的容器中发生该反应,在图中重新画出苯乙烯的浓度随时间的变化示意图。
(3)、在相同的温度和催化剂的情况下,amol乙苯在VL的恒容容器中发生反应。苯乙烯的浓度随时间的变化示意图见下。若其它条件不变,amol乙苯在 L的容器中发生该反应,在图中重新画出苯乙烯的浓度随时间的变化示意图。