山东省济宁市2021-2022学年高二上学期期末考试化学试题
试卷更新日期:2022-03-04 类型:期末考试
一、单选题
-
1. 下列诗句中主要涉及吸热反应的是( )A、白居易:“野火烧不尽,春风吹又生” B、于谦:“爝火燃回春浩浩,烘炉照破夜沉沉” C、苏轼:“投泥泼水愈光明,烁玉流金见精悍” D、李商隐:“春蚕到死丝方尽,蜡炬成灰泪始干”2. 科学家结合实验与计算机模拟结果,研究出了均相催化的思维模型。
总反应:A +B→AB (K为催化剂)
反应①:A + K → AK Ea1
反应②:AK + B → AB + K Ea2

下列说法正确的是( )
A、第①步为快反应,第②步为慢反应 B、升高温度使反应①的速率加快反应②速率减慢 C、该反应的ΔH=-Ea kJ·mol-1 D、催化剂增大了活化分子百分数,加快了反应速率3. 下列关于核外电子排布及运动状态说法不正确的是( )A、基态的电子排布式 , 违反了洪特规则 B、电子云图中的小点越密表示该核外空间的电子越多 C、基态的最外层电子排布式: D、电子层数为n的能层具有的原子轨道数为4. 是一种重要的染料及合成农药中间体。下列说法不正确的是( )A、元素位于周期表d区 B、基态O原子核外电子占据的最高能级的电子云轮廓图为哑铃形 C、分子中的键角小于离子中的键角 D、基态S原子的未成对电子数为25. 由下列实验现象得出的结论正确的是( )操作及现象
结论
A
向盛有溶液的试管中加入溶液产生白色沉淀,再加入几滴溶液,有黄色沉淀生成
B
通过电解发生反应
金属性:
C
溶液中滴加溶液,产生白色沉淀
白色沉淀成分是
D
测定等物质的量浓度的和溶液的值,前者大
非金属性:
A、A B、B C、C D、D6. 短周期元素X、Y、Z、W、E原子核外电子数依次增多。X的原子半径是短周期元素中最小的;Y、Z、W位于同一周期,Z元素基态原子中p轨道所含电子数与s轨道相等;E与W同主族。它们组成的某种分子的结构式如图所示,下列说法正确的是( ) A、简单阴离子半径: B、同主族元素中E的最高价氧化物对应水化物的酸性最强 C、电负性: D、离子的中心原子的杂化方式是杂化7. 下列叙述正确的是( )A、滴定未知浓度的醋酸溶液时,用甲基橙作指示剂,会导致测定结果偏低 B、用湿润的试纸测氯水的值,测定值偏大 C、测定中和热时,将碱缓慢倒入酸中混合,所测温度值偏高 D、盐酸滴定未知浓度的溶液时,滴定前滴定管尖嘴处有气泡,终点读数时无气泡,结果偏低8. 下列说法中正确的是( )A、在时,约为6的纯水呈酸性 B、已知反应:;;则知 C、若 , 化学反应在低温下可自发进行 D、常温下,由水电离出的为 , 溶液的可能为19. 已知反应 , 在一定温度和压强下的密闭容器中,反应达到平衡。下列叙述正确的是( )A、CO和H2O分子的每一次碰撞都能发生化学反应 B、更换高效催化剂,可增大CO的平衡转化率 C、降低温度,K增大 D、若该反应为非基元反应,其总反应速率由反应快的一步基元反应决定10. 下表列出了某短周期元素R的各级电离能数据(用 、 ……表示,单位为 )。下列关于元素R的判断中一定正确的个数是( )
A、简单阴离子半径: B、同主族元素中E的最高价氧化物对应水化物的酸性最强 C、电负性: D、离子的中心原子的杂化方式是杂化7. 下列叙述正确的是( )A、滴定未知浓度的醋酸溶液时,用甲基橙作指示剂,会导致测定结果偏低 B、用湿润的试纸测氯水的值,测定值偏大 C、测定中和热时,将碱缓慢倒入酸中混合,所测温度值偏高 D、盐酸滴定未知浓度的溶液时,滴定前滴定管尖嘴处有气泡,终点读数时无气泡,结果偏低8. 下列说法中正确的是( )A、在时,约为6的纯水呈酸性 B、已知反应:;;则知 C、若 , 化学反应在低温下可自发进行 D、常温下,由水电离出的为 , 溶液的可能为19. 已知反应 , 在一定温度和压强下的密闭容器中,反应达到平衡。下列叙述正确的是( )A、CO和H2O分子的每一次碰撞都能发生化学反应 B、更换高效催化剂,可增大CO的平衡转化率 C、降低温度,K增大 D、若该反应为非基元反应,其总反应速率由反应快的一步基元反应决定10. 下表列出了某短周期元素R的各级电离能数据(用 、 ……表示,单位为 )。下列关于元素R的判断中一定正确的个数是( )……
R
740
1500
7700
10500
……
①R的最高正化合价为 价
②R元素基态原子的电子排布式为
③同周期元素中第一电离能小于R的元素有一种
④R元素位于元素周期表中第ⅡA族
A、1 B、2 C、3 D、411. 在一定温度下的密闭容器中加入一定量的A、B发生反应: , 平衡时测得A的浓度为。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为。下列有关判断正确的是( )A、平衡向逆反应方向移动 B、B的转化率增大 C、 D、C的体积分数增大12. 在常温下,有关下列4种溶液的叙述中不正确的是( )编号
①
②
③
④
溶液
氨水
氢氧化钠溶液
醋酸
盐酸
11
11
3
3
A、在溶液①、②中分别加入适量的氯化铵晶体后,两种溶液的均减小 B、将溶液①、④等体积混合,所得溶液中离子浓度的大小关系: C、分别加水稀释10倍,四种溶液的:①>②>④>③ D、将溶液④与溶液②混合后,若所得溶液的 , 则二、多选题
-
13. 常温下,用溶液分别滴定浓度均为的、溶液,所得的沉淀溶解平衡图像如图所示(不考虑的水解)。下列叙述正确的是( )
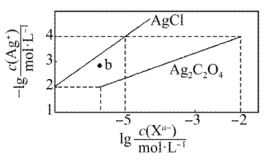 A、b点表示的饱和溶液 B、数量级为 C、的平衡常数为 D、向的混合液中滴入溶液时,先生成沉淀14. 有毒,工业吸收后的溶液的再生过程可降解酸性污水中的硝酸盐,其工作原理如图所示。下列说法不正确的是( )
A、b点表示的饱和溶液 B、数量级为 C、的平衡常数为 D、向的混合液中滴入溶液时,先生成沉淀14. 有毒,工业吸收后的溶液的再生过程可降解酸性污水中的硝酸盐,其工作原理如图所示。下列说法不正确的是( ) A、电极a为阳极 B、由反应池中的反应可知氧化性: C、电极b上的反应为 D、随着电解的进行,阴极区溶液减小15. 时,用溶液滴定溶液的滴定曲线如图所示(曲线上的数字为)。已知:二元弱酸;时, , 的 , 。下列说法正确的是( )
A、电极a为阳极 B、由反应池中的反应可知氧化性: C、电极b上的反应为 D、随着电解的进行,阴极区溶液减小15. 时,用溶液滴定溶液的滴定曲线如图所示(曲线上的数字为)。已知:二元弱酸;时, , 的 , 。下列说法正确的是( ) A、a点消耗溶液体积为 B、b点: C、时,溶液显酸性 D、d点溶液中离子浓度大小关系为
A、a点消耗溶液体积为 B、b点: C、时,溶液显酸性 D、d点溶液中离子浓度大小关系为三、综合题
-
16. 回答下列问题:(1)、与同族且相邻,写出基态原子的价层电子排布式:。(2)、O和S处于同一主族,第一电离能较大的是。和分子中的键角较大的是 , 键长较短的是。单质硫与热的浓溶液反应的产物之一为 , 的空间构型为。(3)、能与吡咯(
 )的阴离子(
)的阴离子( )形成双吡咯铜。已知吡咯分子中的大π键可用符号表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为),则吡咯分子中的大π键应表示为。吡咯分子中N原子的杂化类型为 , 吡咯分子中含有键,
)形成双吡咯铜。已知吡咯分子中的大π键可用符号表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为),则吡咯分子中的大π键应表示为。吡咯分子中N原子的杂化类型为 , 吡咯分子中含有键, 噻吩的沸点为 , 吡咯(
噻吩的沸点为 , 吡咯( H)的沸点在之间,吡咯沸点较高,其原因是。 (4)、键的极性对物质的化学性质有重要影响。已知一些常见电子基团的吸电子效应的强度: , 则下列物质酸性由强到弱的顺序是____。A、 B、 C、 D、17. 合理利用工厂烟灰,变废为宝,对保护环境具有重要意义。以某钢铁厂烟灰(主要成分为 , 并含少量的 、 、 )为原料制备氧化锌的工艺流程如下:
H)的沸点在之间,吡咯沸点较高,其原因是。 (4)、键的极性对物质的化学性质有重要影响。已知一些常见电子基团的吸电子效应的强度: , 则下列物质酸性由强到弱的顺序是____。A、 B、 C、 D、17. 合理利用工厂烟灰,变废为宝,对保护环境具有重要意义。以某钢铁厂烟灰(主要成分为 , 并含少量的 、 、 )为原料制备氧化锌的工艺流程如下:
已知:①“浸取”时, 转化为可溶性 离子, 转化为可溶性 离子;②常温下, , , 。
回答下列问题:
(1)、在周期表中的位置为 , 其基态原子价层电子轨道表示式为。(2)、所含元素的电负性由大到小的顺序为 , “浸取”时加入的 溶液显(填“酸性”、“碱性”或“中性”)。(3)、“除杂”加入过量锌粉发生的离子方程式为;“冷凝吸收”过程中通入过量 , 发生反应的离子方程式为:。(4)、常温下二价锌在水溶液中的存在形式与 的关系如图,横坐标为溶液的 , 纵坐标为 或 物质的量浓度的对数(假设 离子浓度 时, 离子已沉淀完全)。从图中数据计算可得 的溶度积 , 某废液中含 离子,为沉淀 离子可以控制溶液中 值的范围是。 18. 某电镀废水中的铬元素以和的形式存在,其总铬含量的测定方法如下。
18. 某电镀废水中的铬元素以和的形式存在,其总铬含量的测定方法如下。步骤一:取废水,加热浓缩成溶液,然后加入溶液将转化为;
步骤二:加入稍过量的 , 使在碱性条件下转化成;
步骤三:加入硫酸酸化并煮沸后,加入足量的碘化钾将六价铬还原为 , 同时生成单质;
步骤四:加入指示剂用溶液滴定,滴定过程中消耗溶液。
已知: , 请回答下列问题:
(1)、“步骤三”中加硫酸酸化时存在反应 , 则该反应平衡常数的表达式为。升高溶液的温度会导致溶液黄色加深,则该反应的0(填“>”或“<”)。(2)、若“步骤三”省略加热煮沸操作会导致废水中铬元素含量的测量结果(填“偏高”、“偏低”或“无影响”)。(3)、“步骤四”中加入的指示剂为 , 盛装溶液的滴定管,滴定前排气泡时,应选择如图中的(填选项字母);滴定终点时的现象为。a.
 b.
b. c.
c. d.
d. (4)、硫代硫酸钠晶体()不溶于乙醇,可用作纸浆漂白时的脱氯剂等。用工业硫化钠(主要成分 , 含少量)及纯碱等为原料制备的流程如下:
(4)、硫代硫酸钠晶体()不溶于乙醇,可用作纸浆漂白时的脱氯剂等。用工业硫化钠(主要成分 , 含少量)及纯碱等为原料制备的流程如下:
溶液中(填“>”、“<”或“=”),“反应”过程中体系过小产品产率降低的原因是(用离子方程式表示),提纯时,应用洗涤。
19. 羰基硫(),用于合成除草剂、杀虫剂等,还能作为粮食熏蒸剂。、分别与反应均能制得 , 反应如下:反应Ⅰ:
反应Ⅱ:
已知:在相同条件下,向两个容积相同且不变的密闭容器中按下表投料(不参与反应),分别发生上述反应。温度相同时,反应Ⅰ的平衡常数大于反应Ⅱ的平衡常数。实线a、b表示在相同的时间内两反应中随温度的变化关系如下图所示;虚线c、d表示两反应的平衡曲线。
反应Ⅰ
反应Ⅱ
起始投料
起始物质的量()
1
1
3
1
1
3

完成下列填空:
(1)、的结构与二氧化碳类似,的结构式为:;是分子(填“极性”或“非极性”)。(2)、下列可判断反应Ⅱ达到平衡的是____。A、 B、容器内压强不再变化 C、不再变化 D、 E、键断裂的同时键断裂(3)、实验测得反应Ⅱ的速率方程为: , , k为速率常数,则达到平衡后,仅升高温度增大的倍数(填“>”、“<”或“=”)增大的倍数。(4)、上图中能表示反应Ⅰ的曲线是;相同条件下,延长足够的反应时间,反应体系中Y点的物质的量达到点(填“X”或“W”),该温度下该反应I的平衡常数为。20. 回答下列问题:(1)、实现“碳达峰”“碳中和”目标要坚定不移,要坚持稳中求进,逐步实现。在稀硫酸中利用电催化可将同时转化为多种燃料,其原理如图甲所示。
①装置甲中离子交换膜为(“阳离子”或“阴离子”)交换膜。
②铜电极上产生的电极反应式为 , 若铜电极上只生成 , 则铜极区溶液质量变化了g。
(2)、我国科学家报道了机理如图乙所示的电化学过程。
①电极为 , 电极反应式为。
②理论上,每有与结合,电路中转移电子数为。
(3)、双极膜由阳离子交换膜、催化剂层和阴离子交换膜组合而成,在直流电场作用下可将水解离,在双极膜的两侧分别得到和 , 将其与阳离子交换膜(阳膜)、阴离子交换膜(阴膜)组合,可有多种应用。模拟海水淡化,并获得浓盐酸和浓氢氧化钠溶液。双极膜组合电解装置示意图如图。
图中双极膜的右侧得到的是(填“”或“”),电解后在出口可获得较浓的盐酸(填“a”“b”或“c”)。