湖南省益阳市2021-2022学年高二上学期期末考试化学试题
试卷更新日期:2022-03-04 类型:期末考试
一、单选题
-
1. 下列措施与化学反应速率无关的是( )A、炉膛内用煤粉代替煤块 B、食物冷藏在冰箱 C、工业合成氨时,及时将氨气液化分离 D、在铁制品表面喷涂油漆2. 下列有关原子结构的认识不正确的是( )A、同一原子的能层越高,s电子云半径越大 B、s区全部是金属元素 C、氮原子的最外层电子的轨道表示式:
 D、多电子原子中同一能层不同能级的电子能量不同
3. 下列叙述正确的是( )A、石墨可以导电,所以石墨是电解质 B、能够自发进行的反应一定是放热反应 C、硫化钠溶液呈碱性的原因: D、0.1 mol/L的甲酸溶液中含有 , 所以甲酸是弱电解质4. 下列实验装置或操作能达到实验目的的是( )
D、多电子原子中同一能层不同能级的电子能量不同
3. 下列叙述正确的是( )A、石墨可以导电,所以石墨是电解质 B、能够自发进行的反应一定是放热反应 C、硫化钠溶液呈碱性的原因: D、0.1 mol/L的甲酸溶液中含有 , 所以甲酸是弱电解质4. 下列实验装置或操作能达到实验目的的是( )选项
A
B
C
D
目的
准确量取25.00mLNaOH溶液
测定中和热
粗铜精炼
比较的Ka和的Ka1大小
装置或操作



 A、A B、B C、C D、D5. 2021年10月16日0时23分,我国长征二号F火箭将神舟十三号载人飞船送入太空。火箭发射时用肼(N2H4 , 液态)作燃料,NO2作氧化剂,二者反应生成N2和水蒸气。已知在此条件下1 mol液态肼完全反应放出567.2 kJ的热量,下列关于该反应的热化学方程式书写正确的是( )A、 B、 C、 D、6. 合成氨反应为 , 在合成氨工业中常采取的下列措施不能用勒夏特列原理来解释的是( )A、及时补充氮气和氢气 B、使用铁触媒做催化剂 C、将氨液化及时分离出反应器 D、压强增至7. 现将某浓度的溶液与的溶液等体积混合,若要产生沉淀,则所用溶液的浓度至少为(已知该温度下的)( )A、 B、 C、 D、8. 研究青铜器在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义。查文献得知铜锈的主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl,其结构特征如下图所示。下列说法不正确的是( )
A、A B、B C、C D、D5. 2021年10月16日0时23分,我国长征二号F火箭将神舟十三号载人飞船送入太空。火箭发射时用肼(N2H4 , 液态)作燃料,NO2作氧化剂,二者反应生成N2和水蒸气。已知在此条件下1 mol液态肼完全反应放出567.2 kJ的热量,下列关于该反应的热化学方程式书写正确的是( )A、 B、 C、 D、6. 合成氨反应为 , 在合成氨工业中常采取的下列措施不能用勒夏特列原理来解释的是( )A、及时补充氮气和氢气 B、使用铁触媒做催化剂 C、将氨液化及时分离出反应器 D、压强增至7. 现将某浓度的溶液与的溶液等体积混合,若要产生沉淀,则所用溶液的浓度至少为(已知该温度下的)( )A、 B、 C、 D、8. 研究青铜器在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义。查文献得知铜锈的主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl,其结构特征如下图所示。下列说法不正确的是( ) A、考古学家将铜锈分为无害锈和有害锈,则Cu2(OH)2CO3属于无害锈 B、青铜器发生电化学腐蚀时,铜作负极 C、若生成0.2 mol Cu2(OH)3Cl,则理论上消耗O2的体积为4.48 L D、潮湿环境中Cl-浓度大不利于青铜器的保护9. 一定条件下,乙烯(CH2=CH2)可与HCl反应生成氯乙烷(CH3CH2Cl)。下列说法不正确的是( )A、HCl分子中的σ键为s-sσ键 B、乙烯分子中总共有5个σ键和1个π键 C、氯乙烷中碳原子均采用sp3杂化 D、碳碳双键中的π键键能比σ键的小,易断裂,因此乙烯易发生加成反应10. 在相同温度时,浓度均为0.1mol/L的HCl和两种溶液相比较,下列叙述中正确的是(Ka为的电离平衡常数)( )A、两溶液的 B、两溶液的导电能力: C、取1mL上述溶液加水稀释后,Ka增大 D、分别完全中和等物质的量的NaOH时,消耗二者的体积:11. 常温下,某研究小组用数字传感器探究AgCl的沉淀溶解平衡。一段时间内,实验测得AgCl悬浊液中溶解的AgCl浓度变化如图所示,其中a点表示AgCl固体溶于水形成的悬浊液。下列说法不正确的是( )
A、考古学家将铜锈分为无害锈和有害锈,则Cu2(OH)2CO3属于无害锈 B、青铜器发生电化学腐蚀时,铜作负极 C、若生成0.2 mol Cu2(OH)3Cl,则理论上消耗O2的体积为4.48 L D、潮湿环境中Cl-浓度大不利于青铜器的保护9. 一定条件下,乙烯(CH2=CH2)可与HCl反应生成氯乙烷(CH3CH2Cl)。下列说法不正确的是( )A、HCl分子中的σ键为s-sσ键 B、乙烯分子中总共有5个σ键和1个π键 C、氯乙烷中碳原子均采用sp3杂化 D、碳碳双键中的π键键能比σ键的小,易断裂,因此乙烯易发生加成反应10. 在相同温度时,浓度均为0.1mol/L的HCl和两种溶液相比较,下列叙述中正确的是(Ka为的电离平衡常数)( )A、两溶液的 B、两溶液的导电能力: C、取1mL上述溶液加水稀释后,Ka增大 D、分别完全中和等物质的量的NaOH时,消耗二者的体积:11. 常温下,某研究小组用数字传感器探究AgCl的沉淀溶解平衡。一段时间内,实验测得AgCl悬浊液中溶解的AgCl浓度变化如图所示,其中a点表示AgCl固体溶于水形成的悬浊液。下列说法不正确的是( ) A、a点悬浊液中存在沉淀溶解平衡 B、图中b点可能滴加了溶液 C、图中c点后有黄色沉淀生成 D、由图可知:
A、a点悬浊液中存在沉淀溶解平衡 B、图中b点可能滴加了溶液 C、图中c点后有黄色沉淀生成 D、由图可知:二、多选题
-
12. 25℃时,向的两种酸HX、HY中分别滴加溶液,测得两溶液pH随NaOH溶液体积变化的曲线如图所示。下列说法不正确的是( )
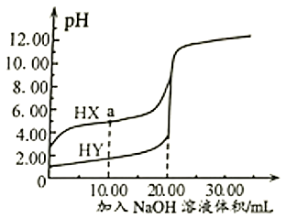 A、酸性: B、a点溶液中微粒浓度: C、滴加NaOH溶液至时,两溶液中 D、从开始滴加至溶液时,两溶液中的电离程度均逐渐增大13. M、X、Y、Z、W为原子序数依次增大的短周期主族元素。M、X是形成有机物的主要元素,Y的基态原子的2p能级中含有3个未成对电子,Z的s能级和p能级上的电子总数相等,W是短周期元素中电负性最小的元素。下列说法正确的是( )A、YM3是由极性键构成的极性分子 B、的空间构型为平面三角形 C、M、Y、Z三种元素形成的化合物溶于水均会抑制水的电离 D、工业上采用电解W的氯化物水溶液的方法制取W的单质14. 已知25℃时, 的 , ; 的 。则25℃时,下列指定溶液中微粒物质的量浓度关系正确的是(忽略溶液混合引起的体积变化)( )A、溶液中: B、溶液中: C、等浓度、等体积的氨水和 溶液混合: D、0.6mol/L氨水和 溶液等体积混合:
A、酸性: B、a点溶液中微粒浓度: C、滴加NaOH溶液至时,两溶液中 D、从开始滴加至溶液时,两溶液中的电离程度均逐渐增大13. M、X、Y、Z、W为原子序数依次增大的短周期主族元素。M、X是形成有机物的主要元素,Y的基态原子的2p能级中含有3个未成对电子,Z的s能级和p能级上的电子总数相等,W是短周期元素中电负性最小的元素。下列说法正确的是( )A、YM3是由极性键构成的极性分子 B、的空间构型为平面三角形 C、M、Y、Z三种元素形成的化合物溶于水均会抑制水的电离 D、工业上采用电解W的氯化物水溶液的方法制取W的单质14. 已知25℃时, 的 , ; 的 。则25℃时,下列指定溶液中微粒物质的量浓度关系正确的是(忽略溶液混合引起的体积变化)( )A、溶液中: B、溶液中: C、等浓度、等体积的氨水和 溶液混合: D、0.6mol/L氨水和 溶液等体积混合:三、综合题
-
15. 为实现我国承诺的“碳达峰、碳中和”目标,中国科学院提出了“液态阳光”方案,即将工业生产过程中排放的二氧化碳转化为甲醇。回答下列问题:(1)、二氧化碳加氢制甲醇的反应为:。该反应一般认为通过如下步骤来实现:
①
②
则a=。
(2)、T℃时,在一容积为2L的恒容密闭容器中充入和发生反应 , 测得不同时刻容器中的压强与起始压强的比值如下表所示:时间/min
5
10
15
20
25
30
压强比
0.80
0.72
0.66
0.62
0.60
0.60
①用表示该反应内的平均反应速率为。
②的平衡转化率为;T℃时,该反应的平衡常数为(保留到小数点后1位)。
③其它条件不变,下列措施能同时增大反应速率和平衡转化率的是。
a.升高温度 b.按原比例再充入一定量和
c.将和液化移出 d.加入高效催化剂
④在30min时,再向体系里充入和0.2mol水蒸气,则反应(填“向正反应方向进行”、“向逆反应方向进行”或“保持平衡”)。
16. 研究发现很熟悉的反应 , 反应机理如下:反应i
反应ii
其能量与反应过程的关系如图所示:

已知:对于基元反应 , 其速率方程为 , 结合上图回答下列问题:
(1)、0(填“>”或“<”)。(2)、决定总反应速率快慢的是(填“反应i”或“反应ⅱ”)。(3)、反应ⅱ逆反应的活化能为。(4)、各步反应速率方程如下表,其中分别为的速率常数,且仅与温度有关。反应i
反应ii
①上表中=;
②的平衡常数K与上述反应速率常数的关系式为;
(5)、将等物质的量的和置于预先抽真空的特制1L密闭容器中,加热到1500K,起始总压强为400kPa;平衡后,总压强为450kPa。体系中存在如下反应关系:1500K平衡体系中I(g)的分压为(保留到小数点后2位)。(已知:表示平衡分压常数,即用平衡分压代替平衡浓度计算,某气体的分压气体总压强该气体的物质的量分数)。
17. 电化学在能源、环境治理等方面具有重要的作用。回答下列问题: (1)、绿色电源“直接二甲醚(CH3OCH3)燃料电池”的工作原理示意图如下所示:
(1)、绿色电源“直接二甲醚(CH3OCH3)燃料电池”的工作原理示意图如下所示:①A电极为电池的极,写出A电极的电极反应式:。
②电池中 向移动(填“A电极”或“B电极”)。
(2)、和 是主要大气污染物,利用下图装置可同时吸收 和NO。
①图中c为(填“阳”或“阴”)离子交换膜。
②已知电解池阴极室中溶液的pH在4~7之间,则阴极的电极反应为。
③用离子方程式表示吸收NO的原理。
④含稀 的废水中 的物质的量浓度为0.05mol/L,若电路中有10mol电子发生转移,则理论上最多可处理这样的废水L。
18. 第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。回答下列问题:(1)、钒(V)及其化合物广泛应用于工业催化、新材料等领域。①基态钒原子的价电子排布式为。
②是一种常见的催化剂,在合成硫酸中起到重要作用,其结构式如图所示:
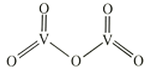
则分子中σ键和π键数目之比为。溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。与的空间构型相同,其中V原子的杂化方式为。
(2)、①科学研究表明用作光催化剂可处理废水中的 , 则的电子式为。②是一种储氢材料。基态B原子核外电子的运动状态有种。
(3)、甘氨酸亚铁络合物[]广泛用于缺铁性贫血的预防和治疗。①中含有的第二周期元素的第一电离能由大到小的顺序为(用元素符号表示)。
②甘氨酸 ()的沸点比相对分子质量相近的烷烃大很多,原因是。