广东省揭阳市揭西县2021-2022学年高二上学期期末考试化学试题
试卷更新日期:2022-03-04 类型:期末考试
一、单选题
-
1. “自热”火锅的发热包主要成分有:生石灰、铁粉、焦炭粉、氯化钙……等。下列说法不正确的是( )
 A、生石灰与水反应放热 B、使用时须向发热包中加入沸水 C、铁粉发生缓慢氧化,辅助放热 D、氯化钙可以吸收微量的水,减缓发热包失效2. 化学反应速率在工农业生产和日常生活中都有重要作用,下列说法正确的是( )A、在化学工业中,使用催化剂一定能提高经济效益 B、将肉类等食品进行低温冷藏,能使其永远不会腐败变质 C、茶叶等包装中加入的还原性铁粉,能显著延长茶叶储存时间 D、夏天面粉发酵速度与冬天面粉发酵速度相差不大3. NA表示阿伏加德罗常数的值,下列叙述正确的是( )A、17gNH3中含有的电子数为8NA B、1L1mol·L-1的NaClO溶液中含有ClO-的数目为NA C、电解精炼铜时,若阳极质量减少64g,阴极上铜离子不一定得到2NA个电子 D、1L0.1mol·L-1乙酸溶液中含H+的数目为0.1NA4. 下列实验装置图符合题意且能达到相应实验目的的是( )
A、生石灰与水反应放热 B、使用时须向发热包中加入沸水 C、铁粉发生缓慢氧化,辅助放热 D、氯化钙可以吸收微量的水,减缓发热包失效2. 化学反应速率在工农业生产和日常生活中都有重要作用,下列说法正确的是( )A、在化学工业中,使用催化剂一定能提高经济效益 B、将肉类等食品进行低温冷藏,能使其永远不会腐败变质 C、茶叶等包装中加入的还原性铁粉,能显著延长茶叶储存时间 D、夏天面粉发酵速度与冬天面粉发酵速度相差不大3. NA表示阿伏加德罗常数的值,下列叙述正确的是( )A、17gNH3中含有的电子数为8NA B、1L1mol·L-1的NaClO溶液中含有ClO-的数目为NA C、电解精炼铜时,若阳极质量减少64g,阴极上铜离子不一定得到2NA个电子 D、1L0.1mol·L-1乙酸溶液中含H+的数目为0.1NA4. 下列实验装置图符合题意且能达到相应实验目的的是( )A
B
C
D




中和热的测定
钢闸门(被保护)与外接电源的正极相连以实现外加电流法
铁钥匙上镀铜
验证不同催化剂对化学反应速率的影响
A、A B、B C、C D、D5. 氯气是一种重要的工业原料。工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法不正确的是( )A、该反应属于氧化还原反应 B、该反应利用了Cl2的氧化性 C、该反应属于复分解反应 D、生成1mol N2有6mol电子转移6. 在0.1mol•L-1的醋酸溶液中,存在电离平衡CH3COOHCH3COO-+H+ , 如果要使平衡向逆反应方向移动,同时增大c(H+),应采用的方法是( )A、加入浓盐酸 B、加入CH3COONa固体 C、稀释 D、加入0.01mol•L-1的CH3COOH溶液7. 水的电离过程为 , 在时,水的离子积: , 在时,水的离子积: , 则下列叙述正确的是A、随着温度的升高而降低 B、时, C、时的水比时的水电离程度小 D、水的电离是吸热的8. 下列说法中,与盐类的水解有关的是( )①明矾、氯化铁晶体常用于净水
②比较NH4Cl和Na2S等某些盐溶液的酸碱性
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂
④实验室通常使用热的纯碱溶液去除油污
A、①②③ B、②③④ C、①③④ D、全有关9. 在pH=1的无色透明溶液中,能大量共存的离子组是( )A、Al3+、Na+、Cl-、SO B、Cu2+、NO、Na+、OH- C、Ba2+、NH、NO、SO D、K+、MnO、Ag+、Cl-10. 目前人们正研究开发一种高能电池——钠硫电池,它以熔融的钠、硫为两极,以Na+导电的β″Al2O3陶瓷作固体电解质,反应为2Na+xS Na2Sx。以下说法正确的是( )A、放电时,钠作正极,硫作负极 B、放电时,Na+向负极移动 C、充电时,钠极与外电源正极相连,硫极与外电源的负极相连 D、放电时,负极发生的反应是:2Na-2e-=2Na+11. 如图是元素周期表短周期的一部分,下列说法中正确的是( )……
①
②
③
……
④
⑤
A、元素①位于第二周期IVA族 B、气态氢化物的稳定性:④>② C、最高价氧化物对应水化物的酸性:⑤>④ D、①、②、③、⑤的原子半径依次减小12. CO2和H2在催化剂作用下制CH3OH,主要涉及的反应有:①CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1=-49.0 kJ/mol
②CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41.2 kJ/mol
下列说法正确的是( )
A、①为吸热反应 B、若①中水为液态,则 △H1′>-49.0 kJ/mol C、②中反应物的总能量比生成物的总能量高 D、CO(g)+2H2(g)=CH3OH(g) △H=-90.2 kJ/mol13. 下列实验不能达到预期目的的是( )序号
实验操作
实验目的
A
向含有AgCl和AgNO3的浊液中滴加Na2S溶液,有黑色沉淀生成
证明Ksp(Ag2S)sp(AgCl)
B
将饱和FeCl3溶液滴入沸水中,溶液变红褐色
制备Fe(OH)3胶体
C
配制FeCl2溶液时,向溶液中加入少量Fe和稀盐酸
抑制Fe2+水解和防止Fe2+被氧化
D
将充满NO2的密闭玻璃球浸泡在热水中
研究温度对化学平衡移动的影响
A、A B、B C、C D、D14. 某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示。下列说法不正确的是( ) A、2min时该反应达到化学平衡状态 B、该反应的化学方程式为3X+Y2Z C、Y在2min内的平均反应速率为0.05mol/(L·min) D、达到平衡时X的转化率为30%15. 在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10 , 下列说法不正确的是( )
A、2min时该反应达到化学平衡状态 B、该反应的化学方程式为3X+Y2Z C、Y在2min内的平均反应速率为0.05mol/(L·min) D、达到平衡时X的转化率为30%15. 在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10 , 下列说法不正确的是( ) A、在t℃时,AgBr的Ksp为4.9×10-13 B、在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 C、图中a点对应的是AgBr的不饱和溶液 D、在t℃时,反应AgCl(s)+Br-(aq)⇌AgBr(s)+Cl-(aq)平衡常数K≈81616. 下列各溶液中,微粒的物质的量浓度关系正确的是( )A、0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) B、0.1 mol/L NH4Cl溶液:c(NH4+)=c(Cl-) C、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) D、向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-)
A、在t℃时,AgBr的Ksp为4.9×10-13 B、在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 C、图中a点对应的是AgBr的不饱和溶液 D、在t℃时,反应AgCl(s)+Br-(aq)⇌AgBr(s)+Cl-(aq)平衡常数K≈81616. 下列各溶液中,微粒的物质的量浓度关系正确的是( )A、0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) B、0.1 mol/L NH4Cl溶液:c(NH4+)=c(Cl-) C、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) D、向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-)二、实验题
-
17. 滴定法是定量测定实验中的重要组成部分。(1)、K2Cr2O7是常用的氧化还原滴定试剂。滴定时应将K2Cr2O7溶液加入(填“酸式”或“碱式”)滴定管中;在规格为25mL的滴定管中,若K2Cr2O7溶液起始读数是5.00mL,此时滴定管中K2Cr2O7的实际体积为(填序号)。
A.1.5mL B.20mL C.大于20mL D.小于20mL
(2)、实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验。请完成下列填空:①由NaOH固体配制0.10mol/LNaOH标准溶液,需要的仪器有药匙、玻璃棒、(从图中选择,写出名称)。

②取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如表:
实验编号
NaOH溶液的浓度(mol/L)
滴定完成时,NaOH溶液滴入的体积(mL)
待测盐酸溶液的体积
(mL)
1
0.10
22.62
20.00
2
0.10
22.72
20.00
3
0.10
22.80
20.00
滴定达到终点的标志是。根据上述数据,可计算出该盐酸的浓度约为(保留两位有效数字)。
③用NaOH标准溶液滴定未知浓度的盐酸时,下列各操作中无误差的是(填序号)。
A.用蒸馏水洗净碱式滴定管后,注入NaOH标准溶液进行滴定
B.用蒸馏水洗涤锥形瓶后,再用待测盐酸润洗,而后装入一定体积的盐酸溶液进行滴定
C.用酸式滴定管量取10.00mL稀盐酸放入用蒸馏水洗涤后的锥形瓶中,再加入适量蒸馏水和几滴酚酞后进行滴定
D.滴定完毕读数后发现滴定管尖嘴还残余1滴液体
三、综合题
-
18. 完成下列各小题。(1)、在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256kJ的热量。写出该反应的热化学方程式。(2)、金属腐蚀一般可分为化学腐蚀和电化学腐蚀,炒过菜的铁锅未及时清洗容易发生腐蚀而生锈。请写出铁锅生锈过程的负极反应式:。(3)、图中甲池的总反应式为N2H4+O2=N2+2H2O。
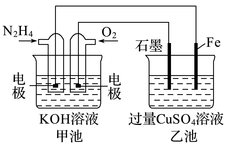
①甲池中N2H4发生的是(填“氧化反应”或“还原反应”),乙池中SO向移动(填“左”或“右”)。
②乙池中总反应的离子方程式为。
③要使乙池恢复到反应前的状态,应向溶液中加入(填化学式)。
19. 以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。(1)、已知:2C(s)+O2(g)=2CO(g) ∆H=-akJ/molN2(g)+O2(g)=2NO(g) ∆H=-bkJ/mol
2NO(g)+2CO(g)=2CO2(g)+N2(g) ∆H=-ckJ/mol
则2NO(g)+C(s)=CO2(g)+N2(g) ∆H=kJ/mol。
(2)、NO和CO均为汽车尾气的成分,在催化转换器中二者可发生反应减少尾气污染。已知2NO(g)+2CO(g)N2(g)+2CO2(g) ∆H<0。
①该反应能自发进行的条件是。
②在500℃时,向恒容密闭体系中通入1mol的NO和1mol的CO进行反应时,下列描述能说明反应达到平衡状态的是。
A.v(CO)正=2v(N2)逆
B.体系中混合气体密度不变
C.混合气体的平均相对分子质量不变
D.体系中NO、CO的浓度相等
E.单位时间内消耗nmol的NO同时消耗nmol的N2
③向1L密闭容器中通入1mol的NO和1mol的CO气体,在不同温度下反应达到平衡时,NO的平衡转化率随压强变化曲线如图所示:

T1T2(填“>”、“<”),反应经过5min达到平衡M,该反应的化学平衡常数表达式为K= , 平衡时混合气体中CO的体积分数为。
20. 水是生命的源泉、工业的血液、城市的命脉。请回答下列问题:(1)、纯水在25 ℃时,pH=7,该温度下1 mol·L-1的NaOH溶液中,由水电离出的c(OH-)=mol·L-1。(2)、25 ℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解方程式为 , 由水电离出的c(OH-)=mol·L-1。(3)、体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离常数(填“大于”“小于”或“等于”)CH3COOH的电离常数。理由是。
 (4)、电离常数是衡量弱电解质电离程度强弱的物理量。已知:
(4)、电离常数是衡量弱电解质电离程度强弱的物理量。已知:化学式
电离常数(25 ℃)
HCN
K=4.9×10-10
CH3COOH
K=1.8×10-5
H2CO3
K1=4.3×10-7、K2=5.6×10-11
25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三溶液的pH由大到小的顺序为。
21. 榴石矿石可以看作由CaO、FeO、Fe2O3、Al2O3、SiO2组成。工业上对其进行综合利用的流程如图: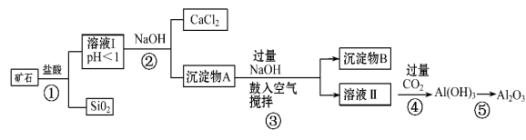 (1)、步骤①中加快反应速率的措施有(填一种)。(2)、溶液Ⅰ中除了Ca2+外,还含有的金属阳离子有。(3)、鼓入空气并充分搅拌的目的是。(4)、工业上制取Al的反应方程式为。(5)、试设计实验证明榴石矿中含有FeO(试剂任选,说明实验操作与现象)。
(1)、步骤①中加快反应速率的措施有(填一种)。(2)、溶液Ⅰ中除了Ca2+外,还含有的金属阳离子有。(3)、鼓入空气并充分搅拌的目的是。(4)、工业上制取Al的反应方程式为。(5)、试设计实验证明榴石矿中含有FeO(试剂任选,说明实验操作与现象)。
-