2021年贵州省黔东南州麻江县中考二模化学试题
试卷更新日期:2022-03-03 类型:中考模拟
一、单选题
-
1. 诗词是中华民族文化的瑰宝,下列诗句描述中涉及化学变化的是( )A、千里冰封,万里雪飘 B、春蚕到死丝方尽,蜡炬成灰泪始干 C、只要功夫深,铁杵磨成针 D、忽如一夜春风来,千树万树梨花开2. 规范的实验操作是完成实验的基本保障。下列操作正确的是( )
A
B
C
D
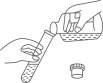

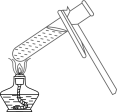
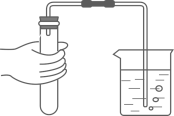
液体的倾倒
取用固体
加热液体
检查装置的气密性
A、A B、B C、C D、D3. “分类”可以使人们有序地研究物质.以下分类正确的是( )A、碱:苛性钠、纯碱、熟石灰 B、合金:硬铝、青铜、18K金 C、酸:硝酸、硫酸、碳酸氢钠 D、糖类:蔗糖、纤维素、蛋白质4. 下列实验现象描述正确的是( )A、镁在空气中燃烧:发出耀眼白光,放出热量,生成黑色固体 B、向已经变蓝的石蕊试液中加入一定量的氢氧化钠溶液:溶液变为紫色 C、一氧化碳还原氧化铜:黑色固体逐渐变为紫红色 D、铁丝与稀硫酸反应:银白色固体逐渐减少,有气泡产生,溶液由无色变成黄色5. 质量守恒定律是化学反应中的重要规律。在催化剂并加热的条件下,A与B反应生成C和D.反应前后分子变化的微观示意图如图所示,下列说法正确的是( ) A、该化学反应属于复分解反应 B、4种物质中,C,D都属于氧化物 C、反应前后,氮元素化合价保持不变 D、该反应中反应物A与B分子个数比是1:16. 逻辑推理是学习化学的一种重要方法,以下推理合理的是( )A、合金是金属材料,所以合金中一定含金属元素,一定不含非金属元素 B、单质只含一种元素,所以含一种元素的纯净物一定是单质 C、碱溶液呈碱性,所以呈碱性的溶液一定是碱溶液 D、中和反应生成盐和水,所以有盐和水生成的反应一定是中和反应7. 下列图像能正确反映其对应变化关系的是( )
A、该化学反应属于复分解反应 B、4种物质中,C,D都属于氧化物 C、反应前后,氮元素化合价保持不变 D、该反应中反应物A与B分子个数比是1:16. 逻辑推理是学习化学的一种重要方法,以下推理合理的是( )A、合金是金属材料,所以合金中一定含金属元素,一定不含非金属元素 B、单质只含一种元素,所以含一种元素的纯净物一定是单质 C、碱溶液呈碱性,所以呈碱性的溶液一定是碱溶液 D、中和反应生成盐和水,所以有盐和水生成的反应一定是中和反应7. 下列图像能正确反映其对应变化关系的是( ) A、加热一定质量的高锰酸钾固体 B、向盛有少量硫酸溶液的烧杯中滴加一定质量的水 C、向盛有一定质量二氧化锰的烧杯中加入过氧化氢溶液 D、向盛有一定质量NaOH和Na2CO3混合溶液的烧杯中滴加稀盐酸8. 除去下列物质中混有的少量杂质,所选用的试剂及操作方法正确的是()
A、加热一定质量的高锰酸钾固体 B、向盛有少量硫酸溶液的烧杯中滴加一定质量的水 C、向盛有一定质量二氧化锰的烧杯中加入过氧化氢溶液 D、向盛有一定质量NaOH和Na2CO3混合溶液的烧杯中滴加稀盐酸8. 除去下列物质中混有的少量杂质,所选用的试剂及操作方法正确的是()选项
物质(括号内为杂质)
试剂及操作方法
A
CO2 (H2O)
通过装有生石灰的干燥管,干燥
B
KCl固体(MnO2)
加水溶解、过滤、蒸发滤液
C
Fe粉(Cu粉)
加入过量稀硫酸,过滤
D
NaCl溶液(MgCl2)
加入过量NaOH溶液,过滤
A、A B、B C、C D、D二、填空题
-
9. 额温枪在疫情防控中发挥着无可替代的重要作用,如图是额温枪及所用电池示意图,回答下列问题:
 (1)、所标物质中,含有的有机合成材料是。(2)、电池内部有一根碳棒,主要利用其性。(3)、写出锌和硫酸铜反应的化学方程式:。(4)、疫情期间要佩戴口罩预防病毒的原理相当于化学实验中的操作。(5)、疫情期间要用消毒液对环境进行消毒,“84”消毒液的消毒原理是 , 生成的HClO具有杀菌作用。化学方程式中X的化学式为 , HClO中氯元素的化合价为。10. 溶液在生产生活中有重要的用途。(1)、甲、乙两种不含结晶水的固体的溶解度曲线如图所示。
(1)、所标物质中,含有的有机合成材料是。(2)、电池内部有一根碳棒,主要利用其性。(3)、写出锌和硫酸铜反应的化学方程式:。(4)、疫情期间要佩戴口罩预防病毒的原理相当于化学实验中的操作。(5)、疫情期间要用消毒液对环境进行消毒,“84”消毒液的消毒原理是 , 生成的HClO具有杀菌作用。化学方程式中X的化学式为 , HClO中氯元素的化合价为。10. 溶液在生产生活中有重要的用途。(1)、甲、乙两种不含结晶水的固体的溶解度曲线如图所示。
②图中M点的含义是。
②N点对应的甲溶液中溶质与溶液的质量比为;当温度升高后,该溶液中溶质的质量分数将(填“增大”、“减小”或“不变”)。
(2)、实验室现有质量分数为98%的浓硫酸,用该浓硫酸50g配制质量分数为20%的稀硫酸,需要水的质量是。11. 水是宝贵的自然资源,日常生活、工农业生产和科学实验都离不开水。
 (1)、生活中常用区分应硬水和软水。(2)、电解水的化学反应方程式为。(3)、某同学配制50g质量分数为10%的Na2CO3溶液,操作过程如图所示:配制溶液的正确操作顺序为(填序号)。步骤④中玻璃棒的作用。
(1)、生活中常用区分应硬水和软水。(2)、电解水的化学反应方程式为。(3)、某同学配制50g质量分数为10%的Na2CO3溶液,操作过程如图所示:配制溶液的正确操作顺序为(填序号)。步骤④中玻璃棒的作用。三、综合题
-
12. A~G是初中化学常见的物质,已知A、D、F均为单质,其中D是日常生产生活中使用最多的金属,B是一种黑色固体,C是一种常见的酸,E(相对分子质量为160)的水溶液呈蓝色,它们相互转化关系如图所示(部分生成物和反应条件已略去)。试回答下列问题:
 (1)、B的化学式:。(2)、F在生产生活中的一种用途。(3)、反应②的化学方程式。(4)、反应③的化学方程式。13. 某化学兴趣小组欲利用下列装置(图1)进行相关气体制取的研究,请填空。
(1)、B的化学式:。(2)、F在生产生活中的一种用途。(3)、反应②的化学方程式。(4)、反应③的化学方程式。13. 某化学兴趣小组欲利用下列装置(图1)进行相关气体制取的研究,请填空。
 (1)、请写出图中指定仪器的名称:①。(2)、小明在制取二氧化碳气体时,不选A装置,而选了B装置的原因;发生反应的方程式是。(3)、若将装置C,D相连接,可用于实验室制取(写化学式),反应方程式为。(4)、实验室用加热氯化铵固体和氢氧化钙固体混合物的方法制取氨气,氨气是一种密度比空气小,极易溶于水的气体,制取氨气应选择的发生装置是(填装置序号),若用如图2所示装置收集氨气,氨气应从导管(选填“a”或“b”)通入。14. 某些铜制品在空气中久置,表面生成绿色的铜锈(又称铜绿)。某化学实验小组设计并进行实验,探究铜锈的组成和铜生锈的条件。(1)、Ⅰ、探究铜锈的组成
(1)、请写出图中指定仪器的名称:①。(2)、小明在制取二氧化碳气体时,不选A装置,而选了B装置的原因;发生反应的方程式是。(3)、若将装置C,D相连接,可用于实验室制取(写化学式),反应方程式为。(4)、实验室用加热氯化铵固体和氢氧化钙固体混合物的方法制取氨气,氨气是一种密度比空气小,极易溶于水的气体,制取氨气应选择的发生装置是(填装置序号),若用如图2所示装置收集氨气,氨气应从导管(选填“a”或“b”)通入。14. 某些铜制品在空气中久置,表面生成绿色的铜锈(又称铜绿)。某化学实验小组设计并进行实验,探究铜锈的组成和铜生锈的条件。(1)、Ⅰ、探究铜锈的组成【查阅资料】①铜锈受热易分解 ②硫酸铜粉末遇水由白色变为蓝色
【进行实验】小组同学从铜器上取下适量的干燥铜锈,按如图所示装置实验〔部分夹持装置已略去)。观察到B中白色粉末变为蓝色,C中澄清石灰水变浑浊。

【解释与结论】C中反应的化学方程式是。
(2)、依据以上现象分析,铜锈中一定含有的元素:Cu和。(3)、Ⅱ、探究铜生锈的条件【提出猜想】根据铜锈的组成推测,铜生锈可能与CO2、H2O和O2有关。
【进行实验】实验小组同学取直径、长度均相同的铜丝,并打磨光亮。设计了如下图所示的5个实验并持续观察。
编号
①
②
③
④
⑤
实验





现象
无明显现象
无明显现象
铜丝表面有绿色物质
无明显现象
无明显现象
【解释与结论】
实验中使用“经煮沸迅速冷却的蒸馏水”,其目的是。
(4)、得出“铜生锈一定与CO2有关”的结论,依据的两个实验是(填编号)。(5)、对比实验②和③,得出的结论是。(6)、为验证猜想,请在图中将实验⑤补充完整。(7)、由上述实验可推知,铜生锈的条件是。四、计算题
-
15. 向10g大理石样品(杂质不溶于水,也不与盐酸反应)分两次加入一定溶质质量分数的稀盐酸,充分反应后烧杯内物质总质量变化如图所示。
 (1)、充分反应后共产生气体的总质量是g。(2)、该大理石样品中碳酸钙的质量分数是。(3)、计算所用稀盐酸的溶质质量分数(写出计算步骤)
(1)、充分反应后共产生气体的总质量是g。(2)、该大理石样品中碳酸钙的质量分数是。(3)、计算所用稀盐酸的溶质质量分数(写出计算步骤)