2022年浙教版初中科学八下第二单元微粒和模型与符号精选培优提高训练
试卷更新日期:2022-03-01 类型:单元试卷
一、单选题
-
1. 下列图片中,属于模型的是( )A、冬奥会会徽
 B、冬奥会场馆沙盘
B、冬奥会场馆沙盘  C、冬奥会冰球项目标志
C、冬奥会冰球项目标志  D、场馆内禁止吸烟标识。
D、场馆内禁止吸烟标识。  2. 已知FeSO4、Fe2(SO4)3混合物中铁元素的质量分数为a%,则硫元素的质量分数为( )A、1-a% B、 C、 D、无法计算3. R2-的离子核外共有n个电子,则R的原子核内质子数为( )A、n+2 B、n-2 C、n D、2n4. 生物体死亡后,体内含有的碳-14会逐渐减少(称为衰变)。科学家可通过测量生物体遗骸中碳-14的含量,来计算它存活的年代,这种方法称为放射性碳测年法。碳-14原子核中含6个质子和8个中子,在衰变时,一个中子变成质子,形成新的原子核。下列关于新原子核的说法正确的是( )A、碳原子核,含7个质子,8个中子 B、氮原子核,含7个质子,7个中子 C、碳原子核,含6个质子,7个中子 D、氧原子核,含7个质子,8个中子5. 由 NaHS、MgSO4、NaHSO3 组成的混合物中,已知 S 元素的质量分数W(S)=a%,则 O元素的质量分数W(O)为( )A、1-1.75a% B、1.75a% C、1.25a% D、无法计算6. 萨罗(Salon)是一种重要的消毒剂。其分子微观结构模型如图:下列关于萨罗的说法错误的是( )
2. 已知FeSO4、Fe2(SO4)3混合物中铁元素的质量分数为a%,则硫元素的质量分数为( )A、1-a% B、 C、 D、无法计算3. R2-的离子核外共有n个电子,则R的原子核内质子数为( )A、n+2 B、n-2 C、n D、2n4. 生物体死亡后,体内含有的碳-14会逐渐减少(称为衰变)。科学家可通过测量生物体遗骸中碳-14的含量,来计算它存活的年代,这种方法称为放射性碳测年法。碳-14原子核中含6个质子和8个中子,在衰变时,一个中子变成质子,形成新的原子核。下列关于新原子核的说法正确的是( )A、碳原子核,含7个质子,8个中子 B、氮原子核,含7个质子,7个中子 C、碳原子核,含6个质子,7个中子 D、氧原子核,含7个质子,8个中子5. 由 NaHS、MgSO4、NaHSO3 组成的混合物中,已知 S 元素的质量分数W(S)=a%,则 O元素的质量分数W(O)为( )A、1-1.75a% B、1.75a% C、1.25a% D、无法计算6. 萨罗(Salon)是一种重要的消毒剂。其分子微观结构模型如图:下列关于萨罗的说法错误的是( )
①该物质的一个分子由二十六个原子构成;②该物质是氧化物;③该物质中碳、氧元素的质量比是156:48;④该物质的相对分子质量是214g;⑤该物质是有机高分子化合物;⑥该物质由碳、氢、氧三个元素组成;⑦该物质的化学式为C13H10O3
A、①③ B、⑦ C、①③⑦ D、②④⑤⑥7. 科学家获得了极具理论研究意义的N4分子,N2、N4分子结构如图所示。下列有关N4的说法正确的是( ) A、N4由2个N2分子构成 B、N4中N的化合价为+4价 C、N4是一种单质 D、N4与N2的组成元素相同,因此化学性质相同8. 我们考试填涂答题卡专用的2B铅笔如图甲,其笔芯主要成分是石墨和黏合剂,石墨由碳原子直接构成,碳原子结构模型如图乙所示,下列有关说法正确的是( )
A、N4由2个N2分子构成 B、N4中N的化合价为+4价 C、N4是一种单质 D、N4与N2的组成元素相同,因此化学性质相同8. 我们考试填涂答题卡专用的2B铅笔如图甲,其笔芯主要成分是石墨和黏合剂,石墨由碳原子直接构成,碳原子结构模型如图乙所示,下列有关说法正确的是( )
 A、电子在离核远近不同的区域中运动 B、所有原子中,质子数=中子数=核外电子数 C、质子和中子由更小的、不能再分的夸克构成 D、中子的质量相对于带电的质子和电子,可以忽略9. 元素周期表将已知元素科学有序地排列起来,便于我们研究它们的性质和用途。下表是元素周期表的一部分,以下说法正确的是( )
A、电子在离核远近不同的区域中运动 B、所有原子中,质子数=中子数=核外电子数 C、质子和中子由更小的、不能再分的夸克构成 D、中子的质量相对于带电的质子和电子,可以忽略9. 元素周期表将已知元素科学有序地排列起来,便于我们研究它们的性质和用途。下表是元素周期表的一部分,以下说法正确的是( )H
He
①
N
②
Ne
③
Ar
A、①和②处于同一族 B、表中不同种元素最本质的区别是中子数不同 C、表中②所代表元素是金属元素 D、元素符号是N的原子核外电子数是7个10. 逻辑推理是一种重要的科学思维方法,下列推理合理的是( )A、化学变化伴随着能量的变化,则有能量变化的一定是化学变化 B、光合作用的同时进行着呼吸作用,则呼吸作用的同时也一定进行着光合作用 C、同种元素的原子质子数相同,则质子数相同的微粒一定属于同种元素的原子 D、化合物是由不同种元素组成的纯净物,则由不同种元素组成的纯净物一定是化合物11. 目前农村正在推广“测土配方施肥”技术,农技员对某土地检测后给出了施肥配方,该土壤施加NH4NO3 , K2CO3;若测定该混合化肥中氮元素的质量分数为28%,则固体混合物中K2CO3的质量分数为( )A、85% B、20% C、25% D、80%12. 某同学学了元素和物质的知识后,进行梳理,其中不正确的是( )A、铁元素的质量分数由高到低:Fe3O4>Fe2O3>FeS B、钙的化合物相对分子质量由大到小:CaCO3>CaCl2>Ca(OH)2 C、地壳中元素的含量由高到低:O> Si> Al D、锰元素的化合价由高到低:KMnO4>K2MnO4 >MnO213. 针对下列常见的科学用语:①2Cl ②2NH4+ ③CO2 ④ ⑤Fe2+ ⑥2OH-⑦H2O中数字“2”的说法正确的是( )A、表示离子个数的是②⑤⑥ B、表示离子所带电荷数的是④⑤ C、表示微粒中原子个数的是③⑦ D、表示分子个数的是①③14. 下列符号中,既表示一个原子、又表示一种元素,还表示一种物质的是( )A、C60 B、Au C、O2 D、H15. 1911年,卢瑟福等人进行了a粒子(a粒子是带两个单位正电荷的氦原子核)散射实验,用一些高速运动的a粒子轰击金箔,发现多数a粒子穿过金箔后仍保持原来的运动方向,但有少数a粒子发生了较大角度的偏转,而极少数a粒子发生反弹。下列说法正确的有( )
A、多数a粒子保持原来的运动方向,说明原子核的体积很小 B、少数a粒子发生较大角度偏转,说明原子核带负电 C、极少数a粒子发生反弹,说明原子核的质量很小. D、多数a粒子保持原来的运动方向,说明原子核外没有电子二、填空题
-
16. 有6种物质能按下列顺序排列:①CO②H2O③NH3④X⑤C2H4⑥P2O5根据它们的组成和排列的规律,X可能是(填选项字母) ,解释你选择的理由:。
A.CH3OH B.CH4 C.Fe2O3 D.SO3
17. A是地壳中含量最高的金属元素,B元素的一种气体单质支持人类呼吸,C元素的原子核外只有两个电子。请写出相应的化学式:A和B组成的化合物 , C元素组成的气体单质 , 相对分子质量最小的氧化物是。18. 近期,小明在网络上看到一则新闻:《某品牌 指甲油被检出三氯甲烷含量严重超标》。为此,他查阅了相关资料:.材料1:三氯甲烷(CHCl3)是一种无色透明液体,有特殊性气味,易挥发,超剂量使用有致癌可能性。在医学上,常用作麻醉剂;工业上,可用作抗生素、香料等的溶剂。
材料2:低浓度的三氯甲烷可被制成消毒剂,而过量的三氯甲烷对人体危害较大。相关标准规定,封闭空间内三氯甲烷的最大接触浓度为20毫克/立方米,超过该浓度有可能引起中毒。
材料3:指甲油能在指甲表面形成一层耐摩擦的薄膜,具有保护作用。其成分一般由两类成分组成,一类是色素等固态物质;另一类是丙酮、乙酸乙酯等溶剂,这两种物质易燃易爆,长期吸入对神经系统可能产生危害。
(1)、三氯甲烷中碳和氢元素的质量比为。(2)、美甲店里通常有刺鼻的气味,这是溶剂挥发后气体产生的现象。该现象称为 。(3)、结合材料信息,小明认为可以不定期使用符合国家标准的指甲油,理由是 。(可多选)A、指甲油可以在指甲表面形成薄膜,保护指甲 B、指甲油中的溶剂皆易燃易爆,具有安全隐患 C、观察发现有大量成年女性在使用指甲油 D、三氯甲烷的浓度只要不超过规定值,对人体没有危害 E、丙酮是指甲油的主要溶剂之一,会刺激人体神经系统19. 下列分别盛有不同物质的容器中,所盛物质属于单质的是 , 属于混合物的是 , 属于化合物的是(均填容器下的字母)。若C瓶中CO2和CO所含的氧元素的质量相等,则CO2和CO中碳元素的质量比为 , CO2和CO的质量比为。D瓶中保持冰化学性质的最小粒子是(填化学式)。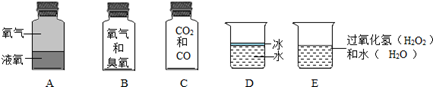 20. 回答下列问题。(1)、下表是元素周期表的一部分,请回答有关问题:
20. 回答下列问题。(1)、下表是元素周期表的一部分,请回答有关问题: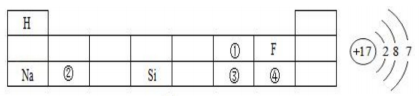
右图表示左表中(填表中序号)的原子结构示意图;得电子后形成的离子符号为;①处元素和②处元素形成常见化合物的化学式为;
(2)、X、Y两种元素的相对原子质量之比为7∶2,X与Y形成的化合物中,X、Y两种元素的质量之比为21∶8,则该化合物的化学式可表示为。若X、Y两种元素的相对原子质量之比为2∶1,由这两种元素形成的化合物中,X、Y的质量之比为2∶3,其中X的化合价为+a。则在该化合物中Y的化合价为。21. 嫦娥四号月球探测器登上月球背面,成为世界首个着落在月球背面的探测器。此后,嫦娥四号通过“鹊桥”中继星向世界展现了首张月背的完整风貌。其实看似荒凉的月球矿产资源极为丰富。以铁为例,仅月面表层5厘米厚的沙土就含有上亿吨铁。(1)、科学研究发现,月球上富含铁的同位素:Fe﹣57(一个原子内质子数与中子数之和为57)和Fe﹣54,已知铁元素为26号元素,则下列相关说法错误的是_________。A、Fe﹣57和Fe﹣54原子核外电子数相同,中子数不同 B、Fe﹣57和Fe﹣54在元素周期表中占同一个位置 C、Fe﹣57和Fe﹣54均属于铁元素,所以相对原子质量相同(2)、地球上的铁主要以氧化物形式存在,在Fe2O3、Fe3O4两种化合物中,与等质量铁元素相结合的氧元素的质量比为;某赤铁矿(主要成分为Fe2O3 , 且其它成分不含铁)探明含铁量为10.5%,则Fe2O3含量为(以百分数的形式表示)。22.如图所示是从空气中分离氧气的示意图:请你写出从图中所获得的有关物质组成、结构、性质、变化等信息各一条:

组成:;结构:;
性质:;变化:。
23. 建立适当的模型来反映和代替客观对象,可以帮助人们认识和理解一些不能直接观察到的事物。(1)、图甲是水分子电解模型图,根据质量守恒定律可判断该模型图中缺少了 。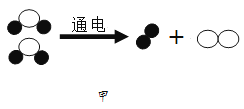



A B C D
(2)、图乙是水中各元素质量分数模型,请在图丙中建立甲烷(CH4)的各元素质量分数模型。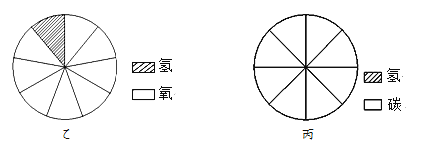
三、实验探究题
-
24. 探究原子结构的奥秘,1911年英国科学家卢瑟福进行了著名的a粒子轰击金箔实验。
【实验装置】如图甲所示:
①a粒子发生器——放射性物质放出a粒子(带正电荷)质量是电子质量的7000多倍;
②金箔——作为靶子,厚度1μm,重叠了3000层左右的原子;
③探测屏——a粒子打在上面发出闪光。

[实验现象]如图乙所示:绝大多数a粒子穿过金箔后仍沿原来的方向前进,但是有少数a粒子却发生了的偏转,甚至有极少数a粒子几乎达到180°的偏转,像是被金箔弹了回来。
[分析解释]
(1)、卢瑟福推测“除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的”,其中的“很小的结构”指的是原子结构中的。支持卢瑟福推测的实验现象是。(2)、卢瑟福在分析实验结果的基础上,他提出了图丙所示的原子核式结构,卢瑟福的这一研究过程是个__________。A、建立模型的过程 B、得出结论的过程 C、提出问的过程 D、验证证据的过程25. 在宏观、微观和符号之间建立联系是化学学科的特点.甲、乙、丙、丁表示四种物质,它们的部分化学式和微观示意图分别列于下表:物质
甲
乙
丙
丁
图例:
 ﹣﹣氢原子
﹣﹣氢原子 ﹣﹣碳原子
﹣﹣碳原子 ﹣﹣氧原子
﹣﹣氧原子化学式
?
C
H2O
H2
微观
示意图



?
(1)、请写出甲物质的化学式 , 画出丁物质的微观示意图 .(2)、能保持丙物质化学性质的微粒是(填“分子”或“原子”),四种物质中属于氧化物的有(填“甲、乙、丙、丁”).26.(1)、“用微粒的眼光看世界”,是我们学习科学的重要思想方法。试根据以下材料,结合你所学知识,简要回答问题:材料一:微波炉的工作原理是利用微波穿透食物达5cm深,使食物中的水分子产生高频率震动,并摩擦,产生大量的热量,达到运动式加热或烹饪食物的目的。
材料二:一滴水里大约有15万亿亿个水分子,如果10亿人来数一滴水里的水分子,每人每分钟数100个,日夜不停,需要数3万多年才能数完。
材料三:某同学在课后做如图所示的实验:在一个玻璃容器中加入100mL水,向水中放入一块糖,立即在容器外壁沿液面画一水平线,过一会儿发现糖块溶解,液面比原来水平线降低了。

①材料一说明:;
②材料二说明:;
③材料三说明:;
④分子是由原子构成的。
请谈谈你对“原子是化学变化的最小粒子”这句话的认识:。
(2)、在科学学习过程中,常常要用到分类的方法,利用分类的方法学习科学,可以起到事半功倍的效果。现有①人体呼出的气体;②五氧化二磷;③酒精;④液态氮;⑤四氧化二氮;⑥固体二氧化碳;⑦氩气;⑧澄清石灰水。用序号填空:含有氮分子的是;由原子直接构成的物质是。27. 碘是一种由碘分子构成的物质。小明同学利用碘进行如下实验:①把少量的固体碘放在湿润的馒头上,发现馒头会变成蓝色;②再取少量的碘溶解在酒精中,取少量碘酒滴在馒头上,发现馒头也会变蓝色。请回答以下问题。
(1)、如果取少量的碘放入烧杯中,用酒精灯加热,碘升华成碘蒸气,把湿润的馒头放在碘蒸气中,馒头会有什么变化,请预测实验现象为 , 并阐述理由。(2)、现在市场上买来的食盐大多是加碘盐,将少量食盐水滴在馒头上,馒头不变蓝。那么加碘盐中的“碘”是指 。A、碘单质 B、碘元素 C、碘原子 D、碘分子28. 阅读下列材料,并回答问题:美国科学家鲁宾和卡门利用同位素标记法对光合作用进行了探究。他们用氧18同位素分别标记水和二氧化碳中的氧元素,使它们分别成为含氧18的水(氧的相对原子量为18)和含氧18的二氧化碳。未标记的为原子量是16的氧原子,然后他们分两组进行实验,两组实验所用的植物、光照及其他条件都相同,实验结果如下表所示:
水
二氧化碳
生成的氧气
第一组
H2O
C18O2
O2
第二组
H218O
CO2
18O2
注:H218O---氧18水,C18O2---氧18二氧化碳,18O2---氧18氧气
(1)、该实验所探究的问题是:光合作用释放的中的元素究竟是来自水还是二氧化碳?(2)、该实验得出的结论是:。(3)、H218O这种水它的相对分子量是。29. 光合作用产生的氧来自二氧化碳还是水?鲁宾和卡门在实验中利用了同位素对这个问题进行了研究。他们首先选择一种碳酸氢盐,制备出含有不同比例18O的该种物质,即18O在该物质氧元素中所占比例不同。同样方法,制备出含有不同比例18O的水,然后配成三种质量分数相同的碳酸氢盐溶液。碳酸氢盐溶解在水中能生成二氧化碳并保持水中的二氧化碳浓度不变,同时不会产生水。将小球藻放入这三种溶液并用阳光进行照射。分析产生氧气中18O的比例,得出结论:光合作用产生的氧来自水。(1)、18O和16O属于同位素原子,它们的原子结构中 相同。A、质子数 B、中子数 C、电子数 D、核电荷数(2)、根据实验结论,在虚线框内补充第三次实验碳酸氢盐和氧气中18O百分比的条形图。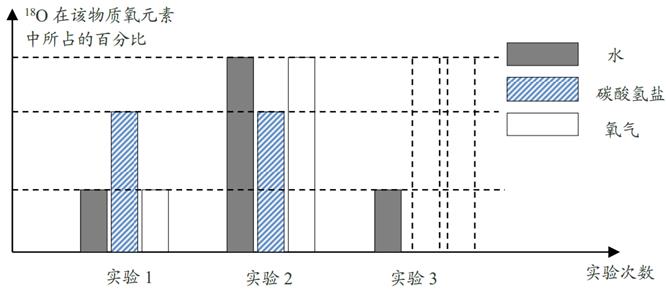 (3)、鲁宾和卡门是通过测量生成氧气的密度确定氧气中18O的含量。如果有一种氧气,18O占50%,即18O和16O的个数比为1:1。根据以下资料计算,在标准状况下该种氧气的密度为kg/m3。(保留两位小数)
(3)、鲁宾和卡门是通过测量生成氧气的密度确定氧气中18O的含量。如果有一种氧气,18O占50%,即18O和16O的个数比为1:1。根据以下资料计算,在标准状况下该种氧气的密度为kg/m3。(保留两位小数)资料:I.在相同的温度和压强下,相同体积的气体具有相同的分子数。
II.18O的相对原子量为 18,16O的相对原子量为 16。
III.自然界的氧气在标准状况下的密度为1.43 kg/m3 , 16O 占所有氧原子的比例可近似看作 100%。
四、解答题
-
30. 由于受新冠疫情影响,学校每天都会对教室和公共区域进行消毒,使用的是84消毒液,下面是84消毒液的产品说明书。
产品品名
84消毒液
主要原料
次氯酸钠(NaClO),有效含氯量大于等于5%
主要作用
瓜、餐具、厨房用品;
白色衣物及物体表面;
肝炎、病毒性感冒及肺炎患者的污染物。
产品规格
500g
(1)、NaClO分子中钠、氧元素的原子质量比是。(2)、计算NaClO中氯元素质量分数?(计算结果保留到0.1%)(3)、该消毒液中至少含有次氯酸钠的质量?(计算结果保留到0.1)31. 表中是四种常见的食品添加剂:名称
亚硝酸钠
阿斯巴甜
β一胡萝卜素
环七糊精
化学式
NaNO2
C14H18O5N2
C40H56
(C6H10O5)7
类别
防腐剂护色剂
甜味剂
着色剂营养强化剂
增稠剂
最大使用量
(每1kg食物中)
腊肉中
0.15g
膨化食品中0.5g
淡奶油中
0.02g
胶基糖果中20.0g
根据信息,请回答下列问题:
(1)、NaNO2中氮元素的化合价为 。(2)、测得1kg某胶基糖果中含环七糊精11.0g,(填“符合”或“不符合”)其使用标准。(3)、“我国应该禁止使用所有的食品添加剂”,这种说法是否正确并说明理由:。(写出一条即可)32. 氕、氘、氚是氢的三种同位素原子,它们的原子结构模型如图所示,相关信息如下表。试回答: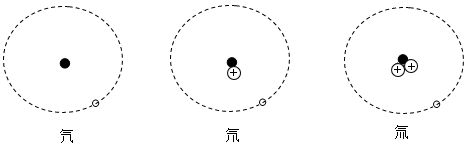
名称
符号
相对原子质量
氕 H
1
氘 D
2
氚 T
3
(1)、超重水有一定的放射性。一个超重水分子由两个氚原子和一个氧原子构成,其化学式可表示为T2O。T2O中T的化合价为。(2)、重水是由氘和氧组成的化合物,化学式可表示为D2O,重水和普通水化学性质相似。在海水中重水的质量约占0.02%,则100吨海水中所含氘的质量是多少?(3)、原子结构模型中的“ ”表示的粒子是。 33. 方便面方便、可口,很受人们青睐,但其中油脂含量若超标,就会影响人的健康。据了解,健康饮食标准下每人每天摄入的油脂应以 25-30g 为上限。回答下列问题
”表示的粒子是。 33. 方便面方便、可口,很受人们青睐,但其中油脂含量若超标,就会影响人的健康。据了解,健康饮食标准下每人每天摄入的油脂应以 25-30g 为上限。回答下列问题 (1)、油脂在室温下呈液态的称为油,呈固态的称为脂肪。油脂经消化消化后的产物为:。(2)、油脂可以由亚麻酸和其它物质经过化学变化获得,已知亚麻酸的化学式为 C18H32O2 , 通过计算得出亚麻酸中碳氢氧三种元素的质量比。(3)、如图为某品牌方便面的包装信息,经检验其方便面中的油脂含量约为 20%,方便面的油脂摄入占一天中总油脂的一半,试判断一天食用一包这种方便面是否符合健康标准?
(1)、油脂在室温下呈液态的称为油,呈固态的称为脂肪。油脂经消化消化后的产物为:。(2)、油脂可以由亚麻酸和其它物质经过化学变化获得,已知亚麻酸的化学式为 C18H32O2 , 通过计算得出亚麻酸中碳氢氧三种元素的质量比。(3)、如图为某品牌方便面的包装信息,经检验其方便面中的油脂含量约为 20%,方便面的油脂摄入占一天中总油脂的一半,试判断一天食用一包这种方便面是否符合健康标准?