山东省淄博市高青县(五四制)2021-2022学年九年级上学期期末化学试题
试卷更新日期:2022-02-28 类型:期末考试
一、单选题
-
1. 下列变化中,变化的本质与其他几项不同的是( )A、湿法冶铜 B、侯氏制碱 C、海水晒盐 D、黏土烧瓷2. 下列说法正确的是( )A、均一、稳定的液体都是溶液 B、溶质均以离子形式分散到溶剂中 C、饱和溶液析出晶体后溶质质量分数一定变小 D、同一温度下,硝酸钾的饱和溶液比不饱和溶液质量分数大3. 如图是甲和乙两种物质(不含结晶水)的溶解度曲线。下列说法正确的是( )
 A、图中阴影部分表示的甲和乙两溶液都是饱和溶液 B、t1℃时,等质量甲和乙的饱和溶液中溶质质量相等 C、t2℃时,甲饱和溶液的溶质质量分数为60% D、将t2℃时乙的饱和溶液降温至t1℃,变为不饱和溶液4. 下列各组物质按单质、有机物、盐、混合物顺序排列的是( )A、氢气 乙醇 纯碱 石油 B、生铁 碳酸钙 食盐 矿泉水 C、红磷 一氧化碳 氯化铵 空气 D、氦气 葡萄糖 干冰 冰水共存物5. 下列对实验现象和结论描述都正确的是( )A、打开浓盐酸瓶口产生白烟,说明盐酸具有挥发性 B、二氧化碳通入紫色石蕊试液中,溶液变红,说明二氧化碳具有酸性 C、向某无色溶液中滴入酚酞试液,呈红色,证明该溶液是碱性溶液 D、浓硫酸放入水中稀释放热,说明浓硫酸与水发生化学反应是放热反应6. 要除去氯化钙溶液中的少量盐酸,使溶液变为中性,在没有指示剂的情况下,应选的试剂是( )A、氢氧化钙 B、氢氧化钠 C、碳酸钙 D、硝酸银溶液7. 下列离子在溶液中能大量共存的是( )A、K+、Na+、、Cl- B、Na+、H+、、 C、、K+、OH-、 D、Ag+ , Mg2+、、Cl-8. 下列有关合金的叙述,正确的有( )
A、图中阴影部分表示的甲和乙两溶液都是饱和溶液 B、t1℃时,等质量甲和乙的饱和溶液中溶质质量相等 C、t2℃时,甲饱和溶液的溶质质量分数为60% D、将t2℃时乙的饱和溶液降温至t1℃,变为不饱和溶液4. 下列各组物质按单质、有机物、盐、混合物顺序排列的是( )A、氢气 乙醇 纯碱 石油 B、生铁 碳酸钙 食盐 矿泉水 C、红磷 一氧化碳 氯化铵 空气 D、氦气 葡萄糖 干冰 冰水共存物5. 下列对实验现象和结论描述都正确的是( )A、打开浓盐酸瓶口产生白烟,说明盐酸具有挥发性 B、二氧化碳通入紫色石蕊试液中,溶液变红,说明二氧化碳具有酸性 C、向某无色溶液中滴入酚酞试液,呈红色,证明该溶液是碱性溶液 D、浓硫酸放入水中稀释放热,说明浓硫酸与水发生化学反应是放热反应6. 要除去氯化钙溶液中的少量盐酸,使溶液变为中性,在没有指示剂的情况下,应选的试剂是( )A、氢氧化钙 B、氢氧化钠 C、碳酸钙 D、硝酸银溶液7. 下列离子在溶液中能大量共存的是( )A、K+、Na+、、Cl- B、Na+、H+、、 C、、K+、OH-、 D、Ag+ , Mg2+、、Cl-8. 下列有关合金的叙述,正确的有( )①合金中至少含有两种金属
②合金一定是混合物
③合金中的元素以化合物的形式存在
④合金一般比组成它们的纯金属硬度更高,熔点更低
⑤合金中各成分保持自己原有的化学性质
A、①②④ B、②④⑤ C、②③⑤ D、①③④9. 可持续发展战略的重要内容之一是保护资源。下列关于金属资源的锈蚀与保护的说法中不正确的是( )A、金属易被腐蚀,从结构看是因为金属原子的最外层电子数一般少于4个,易失电子 B、铁制品表面涂油漆能防锈蚀的原因是隔绝了氧气和水 C、铜锈的主要成分是Cu2(OH)2CO3 , 铜制品的锈蚀是铜与氧气、水蒸气共同作用的结果 D、回收废旧金属也是保护金属资源的一项重要措施10. 有甲、乙、丙、丁四种金属,只有丙在自然界能以单质形态存在。含甲化合物的水溶液不能用乙制的容器盛放。将甲和丁分别放入硝酸铜溶液中,在甲表面有铜析出,而丁没有变化。这四种金属活动性顺序由弱到强的是( )A、丙<丁><甲> B、乙<甲><丁> C、丁<甲><乙> D、丙< 乙<甲>11. 粗盐含有少量的MgCl2 , CaCl2 , Na2SO4等杂质,为了将杂质除干净,先向粗盐溶液中分别加入过量的①NaOH②Na2CO3③BaCl2溶液,过滤,再加入④稀盐酸使溶液的pH=7将最后所得溶液进行蒸发可得到精盐,加入溶液的先后顺序不正确的是( )A、②③①④ B、③②①④ C、①③②④ D、③①②④12. 能一次将稀盐酸、稀硫酸、氯化铜溶液鉴别开的试剂是( )A、Na2CO3 B、Ba(OH)2 C、Na2SO4 D、KOH13. 化学与人体健康密切相关,下列说法中不正确的是( )A、儿童体内缺少钙元素易患佝偻病 B、淀粉是有机高分子化合物,是人体能量的重要来源 C、钙、铁、锌是人体必需的微量元素 D、蛋白质遇到可溶性重金属盐会失去生理活性14. 下列说法不正确的是( )A、铵态氮肥不能与碱性物质混合使用 B、化学电池是将化学能转化为电能的装置 C、可用灼烧闻气味的方法鉴别羊毛纤维和合成纤维 D、玻璃钢属于金属材料15. 为除去物质中的杂质(括号内为杂质),所选试剂及操作方法均正确的是( )物质
选用试剂
操作方法
A
Cu(CuO)
氧气
通入氧气并加热
B
CO2(HCl)
氢氧化钠溶液
通过盛有氢氧化钠溶液的洗气瓶
C
Cu(Fe)
稀硫酸
加足量稀硫酸,充分反应后过滤
D
KCl溶液(K2CO3)
氯化钙溶液
加入过量氯化钙溶液充分反应后过滤
A、A B、B C、C D、D二、填空题
-
16. 化学源于生活,生活中蕴含着许多化学知识。(1)、生活中常用洗涤剂除油污,是因为洗涤剂具有作用。(2)、用含氢氧化铝的药物治疗胃酸过多,原因是(用化学方程式表示),该反应的基本反应类型是。(3)、喝了汽水以后,常常会打嗝,是因为。(4)、生石灰常用作食品干燥剂,其原因是。(用化学方程式表示)17. 请根据如图甲、乙、丙三种固体物质的溶解度曲线,回答下列问题。
 (1)、在℃时,甲、丙两种物质的溶解度相等;(2)、在t2℃时向盛有25g甲物质的烧杯中加入50g水;充分溶解后,所得溶液中溶质、溶剂、溶液质量之比为。(3)、t2℃时,甲、乙、丙三种物质的饱和溶液各100g,所含溶剂的质量由大到小的顺序是。(4)、t2℃时,将甲、乙、丙三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数由大到小的顺序是。
(1)、在℃时,甲、丙两种物质的溶解度相等;(2)、在t2℃时向盛有25g甲物质的烧杯中加入50g水;充分溶解后,所得溶液中溶质、溶剂、溶液质量之比为。(3)、t2℃时,甲、乙、丙三种物质的饱和溶液各100g,所含溶剂的质量由大到小的顺序是。(4)、t2℃时,将甲、乙、丙三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数由大到小的顺序是。三、综合题
-
18. 海洋化学资源的利用体现了人类利用和改造物质的智慧。(1)、下列方法中能淡化海水的是____(填字母)。A、过滤法 B、分解法 C、多级闪急蒸馏法 D、膜法(2)、从海水中制备纯碱和金属镁的流程如图所示:

①流程I海水晒盐得到粗盐,是物质结晶的途径之一。
②流程Ⅱ先吸氨的目的是;写出流程Ⅲ反应的化学方程式。
③提取氯化镁历经Ⅳ、V两步转换,流程Ⅳ反应的化学方程式;流程Ⅵ实现了电能转化成能。
19. 青少年看书、写字一定要爱护眼晴,台灯是在光线不足时常用的照明用具。 (1)、图中序号标示的材料一共分为类。(2)、灯管后面的反光片为铝箱,铝块能制成铝箔是利用了铝具有良好的性。(3)、铝比铁活泼,铝制品更耐腐蚀的原因是 , 用稀盐酸除铁锈的化学方程式为。(4)、为验证铁、铜、铝的活动性顺序,甲乙两位同学设计了不同方案,都达到了实验目的。所用试剂有铝片、铁片、铜片、硫酸铝溶液、硫酸亚铁溶液、硫酸铜溶液。实验方案如下:
(1)、图中序号标示的材料一共分为类。(2)、灯管后面的反光片为铝箱,铝块能制成铝箔是利用了铝具有良好的性。(3)、铝比铁活泼,铝制品更耐腐蚀的原因是 , 用稀盐酸除铁锈的化学方程式为。(4)、为验证铁、铜、铝的活动性顺序,甲乙两位同学设计了不同方案,都达到了实验目的。所用试剂有铝片、铁片、铜片、硫酸铝溶液、硫酸亚铁溶液、硫酸铜溶液。实验方案如下:实验方案
方案一
方案二
实验操作


①方案一中有关反应的化学方程式是;该反应可观察到的现象是。
②方案二中选择的是溶液(写化学式)。
③军军同学将三种金属分别放入一种溶液中,该溶液中的溶质在物质分类上和前两位同学所用的试剂不同,也达到了实验目的,请写出该方案中能发生的任一化学方程式 , 而判断铝、铁活动性强弱依据的现象是。
20. 实验室对含有CaCl2的粗盐进行提纯,步骤如图: (1)、A的仪器名称 , 步骤①中,称量5.0g粗盐需补充的主要仪器是。(2)、步骤②中,玻璃棒的作用是。(3)、步骤③中,滴加过量Na2CO3溶液除去CaCl2 , 反应的化学方程式是。(4)、步骤⑤中,为除去过量的Na2CO3 , 滴加试剂a后发生的化学反应方程式为。(5)、步骤⑥的操作名称是。当时,停止加热。21. 某兴趣小组的同学们利用如图所示的装置对CO还原Fe2O3粉末的实验进行探究(固定装置略)。
(1)、A的仪器名称 , 步骤①中,称量5.0g粗盐需补充的主要仪器是。(2)、步骤②中,玻璃棒的作用是。(3)、步骤③中,滴加过量Na2CO3溶液除去CaCl2 , 反应的化学方程式是。(4)、步骤⑤中,为除去过量的Na2CO3 , 滴加试剂a后发生的化学反应方程式为。(5)、步骤⑥的操作名称是。当时,停止加热。21. 某兴趣小组的同学们利用如图所示的装置对CO还原Fe2O3粉末的实验进行探究(固定装置略)。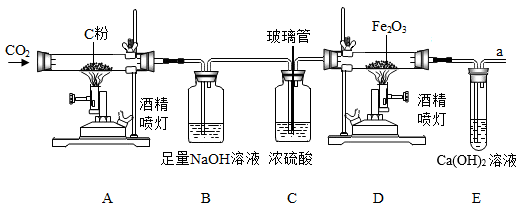 (1)、按如图连接装置,在装入试剂前,先检查。(2)、依次写出装置A、B中反应的化学方程式、 , 其中装置B的作用是。装置C的作用是。(3)、反应一段时间后,装置D中观察到的现象是 , 发生反应的化学方程式为。(4)、实验后,大家一致认为该装置有缺陷,改进方法是。
(1)、按如图连接装置,在装入试剂前,先检查。(2)、依次写出装置A、B中反应的化学方程式、 , 其中装置B的作用是。装置C的作用是。(3)、反应一段时间后,装置D中观察到的现象是 , 发生反应的化学方程式为。(4)、实验后,大家一致认为该装置有缺陷,改进方法是。四、计算题
-
22. 黄铜(铜锌合金)外观酷似黄金,极易以假乱真。化学兴趣小组测定某黄铜样品中锌的质量分数。取20g黄铜样品放入盛有足量稀硫酸的烧杯中,放在电子秤上称量,示数为290.2g。待充分反应后,电子秤示数为290.0g。回答下列问题:(1)、生成氢气的质量是g。(2)、计算黄铜样品中锌的质量分数。(结果精确至0.1%)。