辽宁省锦州市2021-2022学年九年级上学期期末化学试题
试卷更新日期:2022-02-23 类型:期末考试
一、单选题
-
1. 中华民族有着悠久的历史。下列相关制作过程中一定涉及化学变化的是( )A、骨笛打孔 B、雕刻玉器 C、手工织布 D、彩陶烧制2. 下列实验操作正确的是( )A、塞紧胶塞
 B、加入块状固体
B、加入块状固体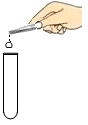 C、加热液体
C、加热液体 D、点燃酒精灯
D、点燃酒精灯 3. 为改善城市环境和空气质量,锦州市政府规定2021年11月2日至2022年4月30日,禁止燃放烟花爆竹。下列为“禁止燃放鞭炮”标志的是( )A、
3. 为改善城市环境和空气质量,锦州市政府规定2021年11月2日至2022年4月30日,禁止燃放烟花爆竹。下列为“禁止燃放鞭炮”标志的是( )A、 B、
B、 C、
C、 D、
D、 4. “化学”一词最早出于清朝的《化学鉴原》一书,该书把地壳中含量第二的元素翻译成“矽(xi)”,如今把这种“矽”元素命名为 ( )A、硒 B、硅 C、铝 D、锡5. 下列物质由离子构成的是( )A、氢气 B、氯化钠 C、铜 D、过氧化氢6. 下列关于空气及其成分的说法正确的是( )A、空气中氮气的质量分数为78% B、鱼能在水中生存,是因为氧气易溶于水 C、氧气具有助燃性,可以作燃料 D、稀有气体可用作霓虹灯的填充气体7. 下列实验现象描述正确的是( )A、木炭在空气中燃烧,发出白光 B、红磷燃烧产生大量的白雾 C、铁丝在氧气中剧烈燃烧,火星四射 D、蜡烛在氧气中燃烧生成二氧化碳8. 下列有关燃烧和灭火说法不正确的是( )A、图书、档案着火,用二氧化碳灭火器扑灭 B、水可以灭火是因为水可以降低可燃物的着火点 C、燃气灶的火焰呈现黄色或橙色,应调大灶具的进风口 D、扑灭森林火灾开辟隔离带,其灭火原理是清除可燃物9. 下列有关微粒的说法正确的是( )A、原子得到电子变成阴离子 B、原子核都是由质子和中子构成的 C、保持水化学性质的微粒是氢原子和氧原子 D、原子不显电性的原因是因为原子中没有带电的微粒10. 用托盘天平称量12.5g(1g以下用游码)药品,向左盘中加入药品后,发现指针向左偏移,这时应进行的操作是( )A、增加砝码 B、添加药品 C、减少药品 D、调节游码11. 下列分类正确的是( )A、纯净物:氖气、石灰石 B、氧化物:冰、五氧化二磷 C、金属单质:金刚石、水银 D、缓慢氧化:钢铁生锈、白磷自燃12. 某密闭容器内有甲、乙、丙、丁四种物质,一定条件下发生某化学反应。反应过程中测得各物质的质量如下表。下列说法不正确的是( )
4. “化学”一词最早出于清朝的《化学鉴原》一书,该书把地壳中含量第二的元素翻译成“矽(xi)”,如今把这种“矽”元素命名为 ( )A、硒 B、硅 C、铝 D、锡5. 下列物质由离子构成的是( )A、氢气 B、氯化钠 C、铜 D、过氧化氢6. 下列关于空气及其成分的说法正确的是( )A、空气中氮气的质量分数为78% B、鱼能在水中生存,是因为氧气易溶于水 C、氧气具有助燃性,可以作燃料 D、稀有气体可用作霓虹灯的填充气体7. 下列实验现象描述正确的是( )A、木炭在空气中燃烧,发出白光 B、红磷燃烧产生大量的白雾 C、铁丝在氧气中剧烈燃烧,火星四射 D、蜡烛在氧气中燃烧生成二氧化碳8. 下列有关燃烧和灭火说法不正确的是( )A、图书、档案着火,用二氧化碳灭火器扑灭 B、水可以灭火是因为水可以降低可燃物的着火点 C、燃气灶的火焰呈现黄色或橙色,应调大灶具的进风口 D、扑灭森林火灾开辟隔离带,其灭火原理是清除可燃物9. 下列有关微粒的说法正确的是( )A、原子得到电子变成阴离子 B、原子核都是由质子和中子构成的 C、保持水化学性质的微粒是氢原子和氧原子 D、原子不显电性的原因是因为原子中没有带电的微粒10. 用托盘天平称量12.5g(1g以下用游码)药品,向左盘中加入药品后,发现指针向左偏移,这时应进行的操作是( )A、增加砝码 B、添加药品 C、减少药品 D、调节游码11. 下列分类正确的是( )A、纯净物:氖气、石灰石 B、氧化物:冰、五氧化二磷 C、金属单质:金刚石、水银 D、缓慢氧化:钢铁生锈、白磷自燃12. 某密闭容器内有甲、乙、丙、丁四种物质,一定条件下发生某化学反应。反应过程中测得各物质的质量如下表。下列说法不正确的是( )物质
甲
乙
丙
丁
反应前质量/g
6
4
x
24
反应后质量/g
10
20
5
4
A、丁可能是单质 B、该反应属于分解反应 C、反应中物质乙和丁的质量变化之比为4:5 D、若甲、乙的相对分子质量之比为1:2,则该反应方程式中甲、乙化学计量数之比一定为13. 下列实验设计不能达到相应实验目的的是( )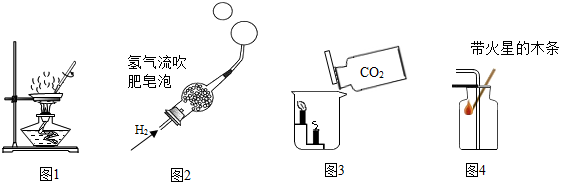 A、图1验证自来水是混合物 B、图2验证氢气密度小于空气 C、图3验证二氧化碳不能燃烧也不能支持燃烧,且密度比空气大 D、图4验证集气瓶中收集满氧气14. 推理是学习化学的重要方法。以下类推正确的是( )
A、图1验证自来水是混合物 B、图2验证氢气密度小于空气 C、图3验证二氧化碳不能燃烧也不能支持燃烧,且密度比空气大 D、图4验证集气瓶中收集满氧气14. 推理是学习化学的重要方法。以下类推正确的是( )①燃烧过程中伴随着发光放热,所以有发光放热现象的变化一定是燃烧
②在有限的空间里可燃性气体遇到明火可能引起爆炸,所以爆炸都是化学变化
③单质只含一种元素,所以含一种元素的纯净物一定是单质;
④催化剂在化学反应前后质量不变,所以反应前后质量不变的物质一定是催化剂
⑤缓慢氧化可能会引起自燃,所以自燃都是由缓慢氧化引起的
A、③⑤ B、②⑤ C、①③④ D、②④15. 下列实验方案不能达到目的的是( )选项
实验目的
实验方案
A
除去铜粉中的铁粉
用磁铁吸引
B
除去CO2气体中混有的少量CO
将气体点燃
C
区分CO和H2
点燃气体,在火焰上方分别罩上干冷烧杯,观察现象
D
区分水和过氧化氢溶液
取样,分别加入少量MnO2 , 观察现象
A、A B、B C、C D、D二、填空题
-
16. 化学用语是学习化学的重要工具。(1)、请用化学用语填空:
①氦气。
②3个铝离子。
③标出氯酸钾中氯元素的化合价。
(2)、写出符号中数字的含义:①。
②2CO。
17. 图1是镁和溴元素在元素周期表中的信息,图2是五种微粒的结构示意图。请回答: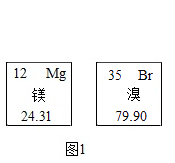
 (1)、溴的相对原子质量是 , 溴属于(填“金属”或“非金属”)元素。(2)、图2中共表示种元素,D和E的化学性质相似的原因是 , B和E形成化合物的化学式是。(3)、若图所示的微粒表示带3个单位正电荷的离子,则X=。
(1)、溴的相对原子质量是 , 溴属于(填“金属”或“非金属”)元素。(2)、图2中共表示种元素,D和E的化学性质相似的原因是 , B和E形成化合物的化学式是。(3)、若图所示的微粒表示带3个单位正电荷的离子,则X=。 18. 日常生活和工农业生产中都离不开水。请回答下列问题:
18. 日常生活和工农业生产中都离不开水。请回答下列问题: (1)、某兴趣小组从小凌河中取水样,观察水样呈淡黄色、浑浊、有固体小颗粒。现对水样进行如下处理:
(1)、某兴趣小组从小凌河中取水样,观察水样呈淡黄色、浑浊、有固体小颗粒。现对水样进行如下处理:a、向水样中加入明矾、搅拌、静置。
b、一段时间后,进行(填操作名称)。
c、再向滤液中加入活性炭,其作用是。
d、杀菌消毒。
(2)、用检验处理后的水是硬水,生活中可用的方法降低水的硬度。(3)、爱护水资源是每个公民的责任和义务,请举出一种生活中节约用水的方法。(4)、同学们按如图所示装置进行电解水实验。通电一段时间后,AB试管中产生气体的体积比约为 , 由该实验得出水是由组成。19. 航天事业的发展与化学知识密不可分。(1)、资料一:发射嫦娥四号运载火箭的燃料有偏二甲耕),发射时与助燃剂四氧化二氮)剧烈反应,反应的化学方程式为 , 其中X化学式为;偏二甲肘和四氧化二氮两种物质中都含有(填字母序号)。A.氮原子 B.2个氮原子 C.氮分子 D.氮气 E.氮元素
(2)、资料二:从嫦娥五号带回的月壤中,发现月球表面富合钛铁矿,其主要成分是钛酸亚铁)其中钛元素的化合价为。(3)、资料三:据报道,载人宇宙飞船中一般要安装盛放过氧化钠)颗粒的装置,其中过氧化钠可作供氧剂,常温下就能消耗二氧化碳并产生氧气,同时生成另一种含有碳酸根离子的化合物。请写出该反应的化学方程式。20. 为实现二氧化碳减排,我国的目标是争取2030年前达到碳达峰,2060年前实现碳中和。我国对全世界宣布碳中和目标,彰显了大国的责任和担当。(1)、实现碳中和的路径之一为降低化石燃料在能源中的比例,化石燃料是指、石油和天然气。路径之二为捕集、利用和封存二氧化碳,如增加二氧化碳的消耗,请写出自然界中消耗二氧化碳的途径(写出一种即可)。(2)、捕集、利用与封存二氧化碳技术有利于缓解的环境问题是。(3)、下列说法正确的是____(填字母序号)。A、碳达峰与碳中和中的“碳”指碳单质 B、控制化石燃料使用有利于实现碳中和 C、为节约化石燃料可以焚烧秸秆 D、为践行低碳生活,提倡绿色出行(4)、多彩的“碳”,多姿的生活。请根据下表提供信息,填写有关含碳物质的对应性质。金刚石切割玻璃
石墨作电极
书写档案时使用碳素墨水
对应性质
21. 掌握科学的研究方法,探索化学世界的奥秘。(1)、实验是学习化学重要途径,对比法是一种常用实验方法。请回答:用如图所示装置验证可燃物燃烧的条件。已知:白磷和红磷的着火点分别是40℃、240℃.实验步骤如下:
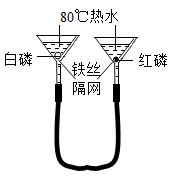
步骤I:将一定量的白磷、红磷分浸入80℃热水中;
步骤II:升高右侧漏斗至红磷露出水面;
步骤III:升高左侧漏斗至白磷露出水面。
①步骤II中红磷不燃烧的原因是。
②对比步骤II和步骤III中现象的不同,可验证可燃物燃烧的条件是。
③防火、灭火、防爆和自救等安全知识是中学生应该了解的生活常识。下列做法正确的是(填字母序号)。
A.点燃氢气前,要检验其纯度 B.发现厨房内煤气泄漏,立即开灯检查
C.如遇火灾,迅速乘电梯撤离 D.面粉加工厂、纺织厂要严禁烟火
(2)、在“宏观一微观一符号”之间建立联系,是学习化学特有的思维方式。乙烯()燃烧的微观模拟示意图如下所示。依据图中所给信息,回答问题: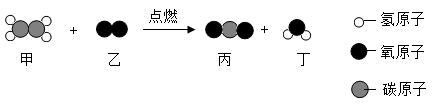
①出该反应的化学方程式。
②请从微观角度解释,该反应属于化学变化的原因是。
(3)、比较与归纳是学习化学的重要方法。由碳、氢元素组成的物质种类繁多,烷烃就是其中一类重要的物质。下表列出了烷烃的一些信息,请回答下列问题:名称
乙烷
丙烷
丁烷
戊烷
己烷
………。
化学式
C2H6
C3H8
C4H10
C5H12
C6H14
………。
碳元素的质量分数
80.0%
81.8%
82.8%
83.3%
83.7%
………。
1g物质完全燃烧消耗氧气的质量/g
3.73
3.64
3.59
3.56
3.53
………。
分析表中数据,可以总结出一些与烷烃相关的变化规律,写出其中的两条:
①随着烷烃分子中碳原子数的增加,。②。
三、综合题
-
22. 请用所学的化学知识解释现象或回答问题:(1)、自行车胎在阳光下暴晒而爆裂。(2)、一氧化碳和二氧化碳化学性质不同的原因是。(3)、金刚石、石墨物理性质差异较大的原因是。23. A~G是初中化学常见的物质,其中A是天然气的主要成分。它们之间存在如下转化关系,图中“—”表示两端的物质能发生化学反应,“→”表示物质间存在相应的转化关系(部分反应物、生成物和反应条件已略去),请回答下列问题:
 (1)、写出下列物质的化学式:A. , E.。(2)、C的一种用途是。(3)、写出F→G反应的化学方程式。(4)、写出B→C反应的化学方程式。24. 请根据下图所示实验回答问题:
(1)、写出下列物质的化学式:A. , E.。(2)、C的一种用途是。(3)、写出F→G反应的化学方程式。(4)、写出B→C反应的化学方程式。24. 请根据下图所示实验回答问题: (1)、图1实验的目的是。用该图所示装置进行实验,所得结果比理论值偏大,可能的原因是。(2)、图2所示实验是探究分子的性质。同时挤压胶头,滴入相同滴数的浓氨水,A试管中观察到的现象是 , 根据A、B试管中现象的不同,能得出的结论是。(3)、图3所示实验可观察到的现象是 , 产生这种现象的原因是(用化学方程式表示)。25. 下图是实验室常见装置。据图回答相关问题:
(1)、图1实验的目的是。用该图所示装置进行实验,所得结果比理论值偏大,可能的原因是。(2)、图2所示实验是探究分子的性质。同时挤压胶头,滴入相同滴数的浓氨水,A试管中观察到的现象是 , 根据A、B试管中现象的不同,能得出的结论是。(3)、图3所示实验可观察到的现象是 , 产生这种现象的原因是(用化学方程式表示)。25. 下图是实验室常见装置。据图回答相关问题: (1)、仪器X的名称是。(2)、用高锰酸钾制取氧气的化学方程式是 , 为防止高锰酸钾粉末进入导管,常在试管口处放。用D装置收集氧气,实验时发现收集的氧气不纯,可能的原因是(答出一点即可)。某同学选择B装置制取氧气,则其反应的化学方程式是 , 用该方法制取氧气与高锰酸钾制取氧气相比较,其优点是(答出一点即可)。(3)、实验室要组装一套“随开随用,随关随停”制取二氧化碳的实验装置,应选用的发生装置是(填字母序号)。(4)、实验室选择A装置作为制取氨气的发生装置,则所用的药品可能是(填序号)。
(1)、仪器X的名称是。(2)、用高锰酸钾制取氧气的化学方程式是 , 为防止高锰酸钾粉末进入导管,常在试管口处放。用D装置收集氧气,实验时发现收集的氧气不纯,可能的原因是(答出一点即可)。某同学选择B装置制取氧气,则其反应的化学方程式是 , 用该方法制取氧气与高锰酸钾制取氧气相比较,其优点是(答出一点即可)。(3)、实验室要组装一套“随开随用,随关随停”制取二氧化碳的实验装置,应选用的发生装置是(填字母序号)。(4)、实验室选择A装置作为制取氨气的发生装置,则所用的药品可能是(填序号)。①浓氨水中加入氧化钙固体
②氢氧化钠溶液和氯化铵固体混合
③熟石灰固体和氯化铵固体混合加热
(5)、若用如图所示装置收集二氧化碳,则验证二氧化碳收集满的方法是。 26. 熔喷布是生产一次性口罩的主要原材料。为探究熔喷布的组成元素,某兴趣小组设计了如下实验,请回答相关问题:
26. 熔喷布是生产一次性口罩的主要原材料。为探究熔喷布的组成元素,某兴趣小组设计了如下实验,请回答相关问题:【查阅资料】①白色无水硫酸铜固体遇水会变为蓝色;②熔喷布易燃,经初步判断只可能由碳、氢、氧元素中的一种或多种组成;③浓硫酸具有吸水性,可用于干燥气体。
【实验探究】连接如下图所示的装置,检查装置气密性,将熔喷布样品碎屑装入玻璃管中,先通入一段时间的氧气,再点燃酒精灯。样品燃烧后,无灰分残留。熄灭酒精灯,再持续通一会儿氧气(假设B、C、D装置内参加反应的气体都完全反应或吸收)。
 (1)、实验前将熔喷布样品剪成碎屑的目的是。(2)、装置B中观察到 , 证明生成了水。(3)、装置D中澄清的石灰水变浑浊,则发生反应的化学方程式为。(4)、在尾气中检测不到CO,说明样品(填“完全”或“不完全”)燃烧。(5)、【实验结论】由上述实验现象不能确定熔喷布的组成元素。于是,另取8.4g熔喷布样品重复上述实验,使其完全燃烧,B、C装置共增重10.8g,D装置增重26.4g,则参加反应氧气质量为g,该熔喷布所含元素为(填元素符号)。(6)、【讨论交流】确定熔喷布的组成元素的理论依据是质量守恒定律。于是大家设计甲、乙、丙三组实验继续验证质量守恒定律。
(1)、实验前将熔喷布样品剪成碎屑的目的是。(2)、装置B中观察到 , 证明生成了水。(3)、装置D中澄清的石灰水变浑浊,则发生反应的化学方程式为。(4)、在尾气中检测不到CO,说明样品(填“完全”或“不完全”)燃烧。(5)、【实验结论】由上述实验现象不能确定熔喷布的组成元素。于是,另取8.4g熔喷布样品重复上述实验,使其完全燃烧,B、C装置共增重10.8g,D装置增重26.4g,则参加反应氧气质量为g,该熔喷布所含元素为(填元素符号)。(6)、【讨论交流】确定熔喷布的组成元素的理论依据是质量守恒定律。于是大家设计甲、乙、丙三组实验继续验证质量守恒定律。
【继续探究】
甲、丙两组天平的指针在实验前后没有发生改变,于是大家认为验证了质量守恒定律,但小明认为:丙实验不能验证质量守恒定律,原因是。
(7)、乙组实验药品混合前、后称量的质量关系为m前>m后 , 原因是;若该实验试剂不变,要验证质量守恒定律,对该装置的改进措施是。(8)、【结论与解释】化学反应遵守质量守恒定律,从微观角度解释其原因是。(9)、【发现问题】实验结束后,甲组同学整理仪器时发现,装置中的气球比实验前缩小了很多,请解释其中的原因。四、计算题
