2021-2022学年度九年级化学 第十单元 课题1 常见的酸和碱 课时提高训练
试卷更新日期:2022-02-22 类型:同步测试
一、单选题
-
1. 酒石酸(C4H6O6)是葡萄酒中主要的有机酸之一,在水溶液中可以电离出H+ , 从而呈现酸性,主要用于饮料添加剂或药物工业原料,下列物质不能与酒石酸反应的是( )A、CO2 B、CuO C、NaOH D、Mg2. 下列关于氢氧化钠的说法正确的是( )A、实验室里称量氢氧化钠时一般将氢氧化钠放在纸上称量 B、溶于水放出大量热的白色固体一定是氢氧化钠 C、不小心将浓硫酸沾到皮肤上应立即用氢氧化钠进行中和,然后用大量的水冲洗 D、氢氧化钠易潮解,要密封保存3. 将浓盐酸和浓硫酸敞口放置在空气中一段时间后,关于两者的变化,描述正确的是( )A、两者质量都变大 B、两者溶质质量分数都变小 C、两者质量都变小 D、浓盐酸溶质质量分数变小,浓硫酸溶质质量分数变大4. 如图所示装置,将X滴加到Y中,U形管中的液面变得左高低右,则X、Y对应的试剂组可行的是( )
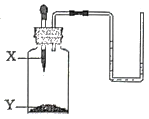
选项试剂
A
B
C
D
X
H2O
H2O
H2O
盐酸
Y
NaOH
NH4NO3
生石灰
Na2CO3
A、A B、B C、C D、D5. 以下化学观念正确的是( )A、微粒观:氮气和氯化钠都是由分子构成 B、转化观:石墨在一定条件下转化成金刚石属于物理变化 C、能量观:氧化钙和水反应放出热量 D、守恒观:蜡烛燃烧后质量减少,说明质量守恒定律不是普遍规律6. 用下列对比实验探究碱的性质,下列说法错误的是( )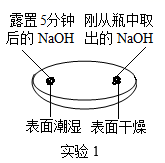
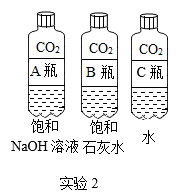 A、实验1的现象说明氢氧化钠需密封保存 B、实验2中软塑料瓶变瘪的程度为A>B>C C、通过对比A,C瓶的现象证明CO2与水发生了反应 D、饱和氢氧化钠溶液比饱和石灰水吸收二氧化碳的效果好7. 生活中常见的柠檬汁、番茄汁等物质中都含有酸类物质,它们具有相似的化学性质,这是由于( )A、溶于水时都能电离出氢离子 B、溶液中都含有酸分子 C、组成中都含有氢元素 D、溶于水时都生成了盐酸8. 我国研制的航天员舱外服为航天员成功进行太空行走提供了可靠的保证。航天员舱外服内含有与氢氧化钠性质相似的氢氧化锂(LiOH),它不可能具有的化学性质是( )A、与二氧化碳反应 B、与盐酸反应 C、与氧化铁反应 D、与硫酸铜溶液反应9. 如图所示,U型管内a、b液面相平,当挤压滴管的胶头,试剂X进入锥形瓶内,一段时间后会观察到a液面高于b液面。则试剂X、Y的组合可能是( )
A、实验1的现象说明氢氧化钠需密封保存 B、实验2中软塑料瓶变瘪的程度为A>B>C C、通过对比A,C瓶的现象证明CO2与水发生了反应 D、饱和氢氧化钠溶液比饱和石灰水吸收二氧化碳的效果好7. 生活中常见的柠檬汁、番茄汁等物质中都含有酸类物质,它们具有相似的化学性质,这是由于( )A、溶于水时都能电离出氢离子 B、溶液中都含有酸分子 C、组成中都含有氢元素 D、溶于水时都生成了盐酸8. 我国研制的航天员舱外服为航天员成功进行太空行走提供了可靠的保证。航天员舱外服内含有与氢氧化钠性质相似的氢氧化锂(LiOH),它不可能具有的化学性质是( )A、与二氧化碳反应 B、与盐酸反应 C、与氧化铁反应 D、与硫酸铜溶液反应9. 如图所示,U型管内a、b液面相平,当挤压滴管的胶头,试剂X进入锥形瓶内,一段时间后会观察到a液面高于b液面。则试剂X、Y的组合可能是( ) A、稀盐酸、石灰石 B、水、烧碱 C、稀硫酸、铁粉 D、水、硝酸铵10. 下列说法正确的是( )A、CO2能灭火,所以能使燃着的木条熄灭的无色气体一定是CO2 B、置换反应生成单质和化合物,所以生成单质和化合物的反应一定是置换反应 C、分子是构成物质的微粒,所以物质都是由分子构成的 D、金属和酸反应能生成气体,所以和酸反应生成气体的物质不一定是金属11. 紫甘蓝是大众爱吃的蔬菜,含有丰富的花青素,花青素遇酸性溶液变红色,遇碱性溶液变蓝色。在凉拌紫甘蓝丝时,观察到菜丝变成红色,可能是加入了下列哪种调味品( )A、食醋 B、食盐 C、味精 D、香油12. 物质的性质决定其用途。稀盐酸常用于除铁锈,是利用了酸的一种化学通性,下列酸的用途中也利用了该通性的是( )A、用锌粒和稀硫酸制取氢气 B、用氧化铜和稀硫酸制备硫酸铜 C、用稀盐酸除去氯化钠中的碳酸钠 D、用硼酸处理皮肤上沾有的碱13. 如图中A、B、C、D是两圆相交的部分,表示指示剂与酸、碱溶液作用时所显示的颜色,则其中表示错误的是( )
A、稀盐酸、石灰石 B、水、烧碱 C、稀硫酸、铁粉 D、水、硝酸铵10. 下列说法正确的是( )A、CO2能灭火,所以能使燃着的木条熄灭的无色气体一定是CO2 B、置换反应生成单质和化合物,所以生成单质和化合物的反应一定是置换反应 C、分子是构成物质的微粒,所以物质都是由分子构成的 D、金属和酸反应能生成气体,所以和酸反应生成气体的物质不一定是金属11. 紫甘蓝是大众爱吃的蔬菜,含有丰富的花青素,花青素遇酸性溶液变红色,遇碱性溶液变蓝色。在凉拌紫甘蓝丝时,观察到菜丝变成红色,可能是加入了下列哪种调味品( )A、食醋 B、食盐 C、味精 D、香油12. 物质的性质决定其用途。稀盐酸常用于除铁锈,是利用了酸的一种化学通性,下列酸的用途中也利用了该通性的是( )A、用锌粒和稀硫酸制取氢气 B、用氧化铜和稀硫酸制备硫酸铜 C、用稀盐酸除去氯化钠中的碳酸钠 D、用硼酸处理皮肤上沾有的碱13. 如图中A、B、C、D是两圆相交的部分,表示指示剂与酸、碱溶液作用时所显示的颜色,则其中表示错误的是( )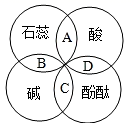 A、紫色 B、蓝色 C、红色 D、无色14. 比较推理是化学学习中常用的思维方法,下列有关物质的比较推理中正确的是( )A、有单质和化合物生成的反应一定是置换反应 B、与酸反应放出气体的物质一定是活泼金属 C、金属元素的原子最外层电子数小于4,所以由金属元素组成的物质中金属元素一定显正价 D、单质中只含有一种元素,所以只含一种元素的纯净物一定是单质15. 滴有酚酞的氢氧化钙溶液分别与下列物质恰好完全反应后,溶液仍呈红色的是( )A、二氧化碳 B、稀盐酸 C、纯碱溶液 D、氯化铜溶液
A、紫色 B、蓝色 C、红色 D、无色14. 比较推理是化学学习中常用的思维方法,下列有关物质的比较推理中正确的是( )A、有单质和化合物生成的反应一定是置换反应 B、与酸反应放出气体的物质一定是活泼金属 C、金属元素的原子最外层电子数小于4,所以由金属元素组成的物质中金属元素一定显正价 D、单质中只含有一种元素,所以只含一种元素的纯净物一定是单质15. 滴有酚酞的氢氧化钙溶液分别与下列物质恰好完全反应后,溶液仍呈红色的是( )A、二氧化碳 B、稀盐酸 C、纯碱溶液 D、氯化铜溶液二、填空题
-
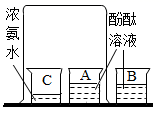
16. 如图所示的实验中,A杯溶液逐渐变色;墙角数枝梅,凌寒独自开,遥知不是雪,为有暗香来。”人在远处就能闻到淡淡的梅花香味的原因是冬天暴露在空气中的水管冻裂了,这是因为
 17. 把生锈的铁钉放入过量的稀盐酸中,首先看到铁锈溶解溶液变成色,反应的化学方程式 , 过一会又会看到有气泡生成,反应的化学方程式。18. 氢氧化钠固体吸收而潮解,氢氧化钠暴露在空气中易变质,用化学方程式表示 。在生活中氧化钙常用做食品干燥剂,其原理用化学方程式表示。
17. 把生锈的铁钉放入过量的稀盐酸中,首先看到铁锈溶解溶液变成色,反应的化学方程式 , 过一会又会看到有气泡生成,反应的化学方程式。18. 氢氧化钠固体吸收而潮解,氢氧化钠暴露在空气中易变质,用化学方程式表示 。在生活中氧化钙常用做食品干燥剂,其原理用化学方程式表示。三、实验探究题
-
19. 两位同学帮助老师整理实验室时,在标有“单质”的药柜中发现一瓶失去标签的黑色粉末A,在标有“氧化物”的药柜中发现另一瓶失去标签的黑色粉末B.
(提出问题)这两瓶黑色粉末A和B分别是什么物质?
(猜想1)甲同学:A是铁粉,B是二氧化锰.
乙同学:A是炭粉,B是氧化铜.
(1)、(实验探究)实验步骤
实验现象
实验结论
①取少量A粉末于试管中,加入适量稀硫酸.
黑色粉末不溶解,没有气体产生.
A粉末一定不是 .
②取少量B粉末于试管中,加入适量稀硫酸.
.
B粉末是氧化铜.
(2)、(反思与拓展)将这两种黑色粉末混合加热(如图),观察到黑色粉末逐渐变为红色,澄清石灰水变浑浊.黑色粉末A和B发生反应的化学方程式为 . 实验结束时,先将导管移出,再熄灭酒精灯的原因是 .
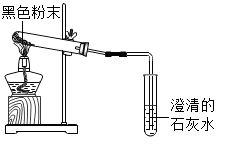
乙同学的猜想正确.
四、计算题
-
20. 黄铜(铜锌合金)因性能优良,被广泛用于制作钱币、饰品和生产中,铜的质量分数在59%~ 65%之间的黄铜性能优良。兴趣小组为了解某黄铜螺母的材料性能进行如下实验:取多个黄铜螺母放入烧杯中,另取80g稀硫酸,分四次等质量加入,每次均充分反应,得到实验数据如下表所示:
实验次数
1
2
3
4
稀硫酸的用量/g
20
20
20
20
剩余固体的质量/g
20.0
17.4
m
13.5
(1)、m=。所取黄铜螺母中铜的质量为g。(2)、通过计算说明该黄铜螺母的材料性能 (填“优良”或“不优良”)。(3)、计算稀硫酸中溶质的质量分数(写出计算过程)。(4)、分析实验数据,在如图坐标中画出加入80g稀硫酸过程中相应的曲线图(纵坐标为自行设定物质的质量;并标出曲线中必要的数据)
-