辽宁省名校联盟2021-2022学年高三12月联合考试化学试题
试卷更新日期:2022-02-21 类型:月考试卷
一、单选题
-
1. 化学与生产、生活和社会发展密切相关,下列叙述正确的是( )A、北斗三号全球卫星导航系统正式开通,其导航型芯片的主要成分是二氧化硅 B、嫦娥5号卫星带回的月壤中富含“完美能源”,与互为同素异形体 C、现代科技已经能够拍到氢键的“照片”,从而可直观地证实乙醇分子间存在氢键 D、二氧化氯泡腾片和酒精均可杀灭新型冠状病毒,二者消毒时均表现为强氧化性2. 下列化学用语表达正确的是( )A、的离子结构示意图:
 B、基态碳原子的轨道表示式:
B、基态碳原子的轨道表示式: C、葡萄糖的分子式:
D、的电子式:
C、葡萄糖的分子式:
D、的电子式: 3. 中华文化源远流长、博大精深。下列有关蕴含化学知识的说法中,不正确的是( )A、“取朴硝(含有)以温汤溶解,次早结块”,该过程为重结晶 B、《墨子·天志》中记载:“书于竹帛,镂于金石”,其中的“金”指的是金属 C、“司南之杓(勺),投之于地,其杓指南”,司南中“杓”的主要成分为 D、黑火药爆炸过程中发生氧化还原反应,其中氧化剂仅有4. 下列说法正确的是( )A、已知与足量NaOH反应生成 , 则为三元酸 B、工业上利用反应检查氯气管道是否漏气,生成有6mol电子转移 C、侯氏制碱法实现了对氨气的循环利用 D、向溶液中通入少量:5. 有机物①、②、③结构如图。下列说法正确的是( )
3. 中华文化源远流长、博大精深。下列有关蕴含化学知识的说法中,不正确的是( )A、“取朴硝(含有)以温汤溶解,次早结块”,该过程为重结晶 B、《墨子·天志》中记载:“书于竹帛,镂于金石”,其中的“金”指的是金属 C、“司南之杓(勺),投之于地,其杓指南”,司南中“杓”的主要成分为 D、黑火药爆炸过程中发生氧化还原反应,其中氧化剂仅有4. 下列说法正确的是( )A、已知与足量NaOH反应生成 , 则为三元酸 B、工业上利用反应检查氯气管道是否漏气,生成有6mol电子转移 C、侯氏制碱法实现了对氨气的循环利用 D、向溶液中通入少量:5. 有机物①、②、③结构如图。下列说法正确的是( ) A、①的一氯代物有6种 B、②分子中所有碳原子可能处于同一平面 C、③中碳原子的杂化方式有2种 D、①、②、③都能使溴水因化学反应而褪色,且互为同分异构体6. “连翘酯苷A”是“连花清瘟胶囊”的有效成分。如图有机物是“连翘酯苷A”的水解产物。下列有关该有机物的说法不正确的是( )
A、①的一氯代物有6种 B、②分子中所有碳原子可能处于同一平面 C、③中碳原子的杂化方式有2种 D、①、②、③都能使溴水因化学反应而褪色,且互为同分异构体6. “连翘酯苷A”是“连花清瘟胶囊”的有效成分。如图有机物是“连翘酯苷A”的水解产物。下列有关该有机物的说法不正确的是( ) A、该物质中碳原子的杂化方式均为 B、1mol该分子最多可与发生加成反应 C、分子中所有原子可能处于同一平面 D、1mol该物质最多能与溶液反应7. 锌与硫所形成化合物晶体的晶胞如图所示。下列判断不正确的是( )
A、该物质中碳原子的杂化方式均为 B、1mol该分子最多可与发生加成反应 C、分子中所有原子可能处于同一平面 D、1mol该物质最多能与溶液反应7. 锌与硫所形成化合物晶体的晶胞如图所示。下列判断不正确的是( ) A、Zn位于元素周期表的d区 B、该晶胞中和数目相等 C、位于构成的四面体空隙中 D、氧化锌的熔点高于硫化锌8. 如图是某元素M的价类二维图,其中X是一种强碱,A为正盐,通常条件下Z是无色液体,D的相对分子质量比E小16,图中呈现了各物质的转化关系。下列说法正确的是( )
A、Zn位于元素周期表的d区 B、该晶胞中和数目相等 C、位于构成的四面体空隙中 D、氧化锌的熔点高于硫化锌8. 如图是某元素M的价类二维图,其中X是一种强碱,A为正盐,通常条件下Z是无色液体,D的相对分子质量比E小16,图中呈现了各物质的转化关系。下列说法正确的是( ) A、B为含极性键的非极性分子 B、B物质可以和Y反应直接转化为E C、D,E两种大气污染物,均可以用排水法收集 D、D到E的反应可用于检验D9. 依据下列实验现象,得出的结论正确的是( )
A、B为含极性键的非极性分子 B、B物质可以和Y反应直接转化为E C、D,E两种大气污染物,均可以用排水法收集 D、D到E的反应可用于检验D9. 依据下列实验现象,得出的结论正确的是( )选项
操作
实验现象
结论
A
向两支盛有少量溴水溶液的试管中分别加入适量苯和通入足量乙烯
溶液均褪色
溴与苯和乙烯都能发生反应
B
测定等浓度的溶液和溶液的pH
前者的pH比后者的大
元素的非金属性:S>C
C
向溶液中加入5滴同浓度的KI溶液,再加入几滴KSCN溶液
溶液显血红色
与KI的反应是可逆反应
D
向的溶液中滴加几滴同浓度的NaCl溶液后,滴加KI溶液
先产生白色沉淀,后出现黄色沉淀
证明
A、A B、B C、C D、D10. 我国某科研团队设计了一种新型能量存储/转化装置(如图所示)。闭合K2、断开K1时,制氢并储能;断开K2、闭合K1时,供电。下列说法正确的是( ) A、制氢时,溶液中向X电极移动 B、供电时,Zn电极反应式为 C、供电时,X电极发生氧化反应 D、制氢时,X电极反应式为11. 对可逆反应 , 在一定条件下达到平衡,下列有关叙述正确的是( )
A、制氢时,溶液中向X电极移动 B、供电时,Zn电极反应式为 C、供电时,X电极发生氧化反应 D、制氢时,X电极反应式为11. 对可逆反应 , 在一定条件下达到平衡,下列有关叙述正确的是( )①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④加入催化剂,降低了反应的活化能,B的转化率得以提高
⑤增大B的浓度,平衡向正反应方向移动,v(正)、v(逆)都增大,但是K不变
⑥恒温恒容条件下,容器内混合气体的密度不再改变,说明该反应达到平衡状态
A、③⑤⑥ B、①② C、⑤⑥ D、④⑤12. 某化学小组欲测定酸性条件下溶液与溶液反应的化学反应速率,所用的试剂为溶液和溶液,所得c(Cl-)随时间变化的曲线如图所示。下列说法正确的是( ) A、该反应的离子方程式为 B、该反应在的平均反应速率 C、在反应过程中,该反应的化学反应速率变化趋势为先增大后减小 D、起初反应很慢,一段时间后反应速率明显增大,一定是反应放热温度升高的结果13. 我国某科研机构设计如图装置,利用K2Cr2O7实现含苯酚废水的有效处理,处理后的废水毒性降低且不引入其它杂质。一段时间后,中间室中NaCl溶液的浓度减小。下列说法中不正确的是( )
A、该反应的离子方程式为 B、该反应在的平均反应速率 C、在反应过程中,该反应的化学反应速率变化趋势为先增大后减小 D、起初反应很慢,一段时间后反应速率明显增大,一定是反应放热温度升高的结果13. 我国某科研机构设计如图装置,利用K2Cr2O7实现含苯酚废水的有效处理,处理后的废水毒性降低且不引入其它杂质。一段时间后,中间室中NaCl溶液的浓度减小。下列说法中不正确的是( ) A、工作时,N极附近溶液pH升高 B、工作时,每转移3mol电子,N极室和M极室质量变化相差65g C、a为阳离子交换膜,b为阴离子交换膜 D、N电极反应式为14. 2019年诺贝尔化学奖颁给研究锂电池的科学家,一种用作锂电池电解液的锂盐结构如图所示。基态Z原子的电子填充了3个能级,其中2个未成对电子。有W、Z、Y位于同一周期。下列叙述正确的是( )
A、工作时,N极附近溶液pH升高 B、工作时,每转移3mol电子,N极室和M极室质量变化相差65g C、a为阳离子交换膜,b为阴离子交换膜 D、N电极反应式为14. 2019年诺贝尔化学奖颁给研究锂电池的科学家,一种用作锂电池电解液的锂盐结构如图所示。基态Z原子的电子填充了3个能级,其中2个未成对电子。有W、Z、Y位于同一周期。下列叙述正确的是( ) A、原子半径:X>Z>W B、氢化物沸点:X>Z>W C、Y的氢化物可用于刻蚀玻璃 D、第一电离能:Y>Z>W15. 实验室用0.1mol/L的NaOH溶液滴定的溶液。溶液中,含氯微粒a、b的分布系数、NaOH溶液体积V(NaOH)与pH的关系如图所示。[比如的分布系数,]。下列叙述不正确的是( )
A、原子半径:X>Z>W B、氢化物沸点:X>Z>W C、Y的氢化物可用于刻蚀玻璃 D、第一电离能:Y>Z>W15. 实验室用0.1mol/L的NaOH溶液滴定的溶液。溶液中,含氯微粒a、b的分布系数、NaOH溶液体积V(NaOH)与pH的关系如图所示。[比如的分布系数,]。下列叙述不正确的是( ) A、x点对应溶液的pH约为5 B、p点对应的溶液中, C、微粒b为 , 该滴定可选酚酞作指示剂 D、滴定到q点时,溶液中
A、x点对应溶液的pH约为5 B、p点对应的溶液中, C、微粒b为 , 该滴定可选酚酞作指示剂 D、滴定到q点时,溶液中二、综合题
-
16. 用海底锰结核(主要成分为 , 含少量MgO、、、)为原料,制备金属锰、镁的一种工艺流程路线如图所示。

已知:①几种难溶物的溶度积(25℃)如下表所示。
化学式
Ksp
②溶液中某离子浓度时,认为该离子沉淀完全。
完成下列问题:
(1)、Mn在周期表中位置。(2)、SO2分子中心原子的杂化方式 , SO2分子与CO2分子的键角的大小前者后者(填“大于”“小于”或“等于”)。(3)、“锰结核粉末”中与SO2反应的离子方程式为。(4)、“滤液1”中c(Mn2+)为0.18mol/L,则“调节pH”的范围为 , “滤渣2”的成分为。(5)、制取无水时,需要在干燥的HCl气流中加热分解。HCl的作用为。(6)、该工艺流程中除电解余液可循环利用外,还能循环利用的试剂为。17. 氮的化合物制备以及其对环境的影响和消除,一直都是具有重大价值和现实意义的科学研究领域。(1)、I.最近我国科学家结合实验与计算机模拟结果,使用铜催化剂将单个N,N二甲基甲酞胺[(CH3)2NCHO]转化为三甲胺[N(CH3)3]的合成路线。反应历程如图1所示。

制备三甲胺的热化学方程式为(1eV=1.6×10-19 , 反应热数值保留2位有效数字),上述历程中①、②、③三个阶段,反应速率最慢的是。(填阶段编号)
(2)、160℃时,将和以物质的量浓度之比为2:3充入盛有催化剂的刚性容器中,容器内压强变化如图2所示,则该反应的平衡常数Kp=(用分压代替浓度计算,分压=总压×物质的量分数,结果用含P的式子表达);下列条件能够说明该反应达到平衡状态的是。
①
②的分压不再发生变化
③该反应的反应热不再发生变化
④气体的密度不再发生变化
⑤气体的平均摩尔质量不发生变化
(3)、Ⅱ.污染的治理是世界性难题。NO的治理通常有下面两种方法:方法一:用作消除剂,反应原理为 。不同温度条件下:与NO的物质的量之比分别为4:1、3:1、1:3,得到NO脱除率曲线如图3所示。

曲线中的起始浓度为 , 从A点到B点经过4秒,该时间段内NO的脱除平均速率为。
(4)、不论以何种比例混合,温度超过900℃,NO脱除率骤然下降,可能的原因有。(答出1点即可)方法二:通过反应将NO转化为无害的。已知该反应的v正=k正c2(NO)c2(CO),v逆=k逆c(N2)c2(CO2)。(k正、k逆为速率常数,只与温度有关)
(5)、某温度下,若在1L的恒容密闭容器中充入NO、CO、N2、CO2各0.5mol,达平衡时k正∶k逆=1∶4,则起始状态时v正 v逆。(填“>”“<”或“=”)(6)、Ⅲ.近年来,地下水中的氮污染的治理渐受关注。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的可高效转化酸性溶液中的硝态氮(NO),其工作原理如图4所示。
若中混有微量等杂质时,会导致反应的产率降低,推测其可能原因为。
18. 甲醛(HCHO)是无色气体,易溶于水,有特殊的刺激性气味,对人眼、鼻等有刺激作用。40%甲醛溶液沸点为96℃,易挥发。甲醛在碱性溶液中具有极强的还原性。为探究过量甲醛和新制反应的产物成分,进行如下研究:(1)、在如图装置中进行试验,向a中加入溶液和溶液100mL,振荡,再加入40%的甲醛溶液40mL,缓慢加热a,在65℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红色,并有气体产生。
①仪器b的名称是。
②仪器c的作用为。
③能说明甲醛具有还原性的实验现象是。
(2)、查阅资料发现气体产物是副反应产生的。为确认气体产物中含不含CO,将装置A和如图所示的装置连接后进行实验。
①依次连接的合理顺序为:A→B→ → → → →G,
②装置B的作用是③确认气体产物中含而不含CO的现象是。
(3)、课外兴趣小组对实验制取的晶体进行纯度测定:已知:是白色固体,易被氧化。a.称取2.000g样品,将其配成250mL溶液。
b.先向锥形瓶内加入的溶液,加热至40~50℃,冷却后再向其中加入溶液,充分混合。
c.最后用待测的样品溶液与锥形瓶内溶液恰好完全反应,重复三次、平均消耗样品溶液50.00mL (与反应的关系式为:)。
①测定过程中应迅速操作,不宜耗时过长,否则测定的数值将会偏小,原因是。
②通过计算,该样品中的质量分数是 , 可能含有的杂质有和。
19. 叶酸拮抗剂(M)是一种多靶向性抗癌药物。以苯和丁二酸酐为原料合成该化合物的路线如下: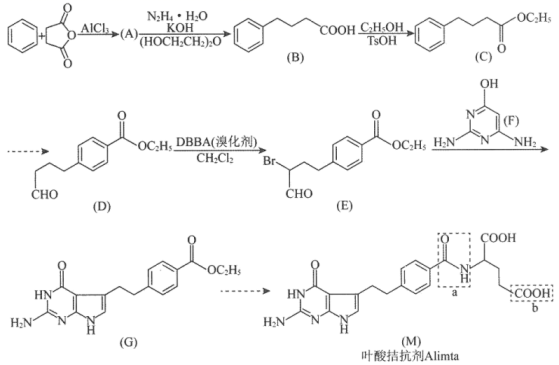
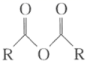
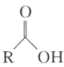
已知:①
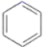 +
+
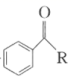 +
+
②


回答下列问题:
(1)、F的分子式。(2)、A的结构简式为。(3)、A→B,D→E的反应类型分别是 , 。(4)、M中虚线框内官能团的名称为a , b。(5)、结合上述信息,写出丁二酸酐和乙二醇合成聚丁二酸乙二醇酯的反应方程式。(6)、B有多种同分异构体,同时满足下列条件的同分异构体有种(不考虑立体异构)。①苯环上有2个取代基
②能够发生银镜反应
③与溶液发生显色反应
其中核磁共振氢谱有五组峰,且峰面积之比为6:2:2:1:1的结构简式为。