河南省名校联盟2021-2022学年高三上学期11月联考化学试题
试卷更新日期:2022-02-21 类型:月考试卷
一、单选题
-
1. 传统文化是中华文明的重要组成部分。下列关于传统文化摘录的化学解读不正确的是( )
选项
传统文化摘录
化学解读
A
墙角数枝梅,凌寒独自开。遥知不是雪,为有暗香来
分子是不断运动的
B
千淘万漉虽辛苦,吹尽狂沙始到金
黄金的化学性质很稳定
C
纷纷灿烂如星陨,㸌㸌喧豗似火攻
焰色反应是物理变化
D
有硇水者,翦银块投之,则旋而为水
“硇水”指盐酸
A、A B、B C、C D、D2. 据西汉东方朔所撰的《神异经·中荒经》载,“西北有宫,黄铜为墙,题曰:地皇之宫。”文中“黄铜”的主要成分是铜锌,还含少量锡、铅。下列说法不正确的是( )A、金属活动性:Zn>Pb>Sn>Cu B、用黄铜制作的高洪太铜锣应置于干燥处保存 C、黄铜器能与稀硝酸发生反应 D、可用灼烧法区分黄铜和黄金首饰3. 下列各组离子在指定溶液中能大量共存的是( )A、能使甲基橙变为黄色的溶液中:、、、 B、的溶液中:、、、 C、明矾溶液中:、、、 D、加入铝粉会产生的溶液中:、、、4. 我国科学家仿生催化合成四环色烯缩酮(Z)的反应原理如图,已知:R为烃基。
下列说法正确的是( )
A、X苯环上的一氯代物只有2种 B、Y的分子式为 C、Z分子中所有原子可能共平面 D、X、Y、Z均能发生加成反应5. 下列操作不能达到目的的是( ) A、图1:制备乙酸乙酯 B、图2:探究硅酸和碳酸的酸性强弱 C、图3:探究溶液的稳定性 D、图4:验证钠在氧气中燃烧6. 下列离子方程式正确的是( )A、向饱和溶液中滴加饱和溶液: B、向稀硝酸中滴加溶液: C、向新制氯水中滴加少量的溶液: D、向溶液中加入小颗粒钠:7. 工业上用制备甲醇,发生的反应为 。下列有关该反应的说法正确的是( )A、反应中每生成18g , 放出49KJ的能量 B、反应中每生成16g , 转移3mol电子 C、选择合适的催化剂能减小反应的活化能和焓变 D、反应物中所有化学键的键能之和大于生成物中所有化学键的键能之和8. 实验室常用标定 , 同时使再生,其反应原理如图。下列说法正确的是( )
A、图1:制备乙酸乙酯 B、图2:探究硅酸和碳酸的酸性强弱 C、图3:探究溶液的稳定性 D、图4:验证钠在氧气中燃烧6. 下列离子方程式正确的是( )A、向饱和溶液中滴加饱和溶液: B、向稀硝酸中滴加溶液: C、向新制氯水中滴加少量的溶液: D、向溶液中加入小颗粒钠:7. 工业上用制备甲醇,发生的反应为 。下列有关该反应的说法正确的是( )A、反应中每生成18g , 放出49KJ的能量 B、反应中每生成16g , 转移3mol电子 C、选择合适的催化剂能减小反应的活化能和焓变 D、反应物中所有化学键的键能之和大于生成物中所有化学键的键能之和8. 实验室常用标定 , 同时使再生,其反应原理如图。下列说法正确的是( ) A、反应1中中的硫元素被还原 B、只发生反应1或只发生反应2时溶液颜色均发生了变化 C、和、能在水溶液中大量共存 D、将反应2设计成原电池,放电时向正极迁移9. 我国科学家设计了一种将电解饱和食盐水与电催化还原相耦合的电解装置(如图)。下列说法不正确的是( )
A、反应1中中的硫元素被还原 B、只发生反应1或只发生反应2时溶液颜色均发生了变化 C、和、能在水溶液中大量共存 D、将反应2设计成原电池,放电时向正极迁移9. 我国科学家设计了一种将电解饱和食盐水与电催化还原相耦合的电解装置(如图)。下列说法不正确的是( ) A、生成CO的一极为阴极 B、阴极上的电极反应式为 C、当电路中转移2mol电子时,阴极增重16g D、阴阳两极的电解质溶液均可用稀硫酸酸化10. 我国科学家实现了无催化剂熔融缩聚合成聚酯,其反应历程如图:
A、生成CO的一极为阴极 B、阴极上的电极反应式为 C、当电路中转移2mol电子时,阴极增重16g D、阴阳两极的电解质溶液均可用稀硫酸酸化10. 我国科学家实现了无催化剂熔融缩聚合成聚酯,其反应历程如图:
下列说法不正确的是( )
A、合成聚酯的反应属于缩聚反应 B、 是产物之一
C、上述转化中有双键的断裂,没有双键的形成
D、合成上述聚酯的单体是二元醇和二元羧酸
11. 短周期主族元素R、X、Y、Z、W的原子序数依次增大,由这五种元素组成的一种化合物M常用作食品的增味剂,M的结构式如图所示。下列说法正确的是( )
是产物之一
C、上述转化中有双键的断裂,没有双键的形成
D、合成上述聚酯的单体是二元醇和二元羧酸
11. 短周期主族元素R、X、Y、Z、W的原子序数依次增大,由这五种元素组成的一种化合物M常用作食品的增味剂,M的结构式如图所示。下列说法正确的是( ) A、原子半径:X>Y B、由R、Y、Z三种元素形成的化合物均为共价化合物 C、熔点:W2Z<R2Z D、工业上采用电解熔融的W2Z制备W单质12. 某实验小组拟探究绿矾()和摩尔盐[]的抗氧化能力,装置如图所示。
A、原子半径:X>Y B、由R、Y、Z三种元素形成的化合物均为共价化合物 C、熔点:W2Z<R2Z D、工业上采用电解熔融的W2Z制备W单质12. 某实验小组拟探究绿矾()和摩尔盐[]的抗氧化能力,装置如图所示。
标准状况下,向两支注射器中分别放入0.01mol绿矾晶体和0.01mol摩尔盐晶体,向右拉动注射器活塞,各吸入20mL空气,关闭注射器针头连接的止水夹,均放置4h,取出两种晶体,用无氧蒸馏水溶解并配制成100mL溶液,实验结果如下表所示:
实验操作
装置1的现象
装置2的现象
放置4h后活塞向左移动的距离
较长
较短
取2mL配制的溶液,滴加2滴KSCN溶液
溶液变为深红色
溶液变为浅红色
取2mL配制的溶液,滴加足量的溶液
产生较少的蓝色沉淀
产生较多的蓝色沉淀
已知:相同条件下,消耗的量越多,抗氧化能力越强。
下列推断正确的是( )
A、绿矾的抗氧化能力比摩尔盐的弱 B、煮沸蒸馏水可得到无氧蒸馏水 C、“溶液变为深红色”说明装置1中的绿矾完全被氧化 D、放置4h后,装置2的固体中:13. 室温下,向10mLHA溶液中滴加的NaOH溶液,溶液的酸度(AG)与NaOH溶液体积的关系如图所示。已知:。
下列说法不正确的是( )
A、在a、b、c、d点对应的溶液中,c点时水的电离程度最大 B、b点对应的溶液中: C、d点对应的溶液中: D、室温下,HA的电离常数约为1.010-4二、多选题
-
14. 以叶蛇纹石[主要成分是 , 含少量Fe2O3、FeO、Al2O3等]为原料提取高纯硅的流程如下:
叶蛇纹石SiO2粗硅SiCl3高纯硅
下列说法不正确的是( )
A、反应2的副产物可作燃料 B、反应3和反应4的副产物可循环利用 C、反应1、2、3、4都是氧化还原反应 D、上述流程中反应3和反应4可在同一容器中进行三、综合题
-
15. 碳化镁()可用于制备乙炔()。制备的原理为。以海水为原料制备碳化镁的工艺如下:
海水溶液
(1)、氢氧化镁浊液中混有少量 , 提纯的操作是。(2)、电解熔融的时,阳极上的电极反应式为。(3)、实验室制备HCl的原理是(浓) , 用图1中的装置制备一瓶纯净的氯化氢。
①气流从左至右,装置导管口的连接顺序为(填标号)。
②D装置干燥管的作用是。
③C装置的反应中利用了浓硫酸的(填标号)。
a.难挥发性 b.强氧化性 c.吸水性
(4)、制备碳化镁的装置如图2所示(装置中试剂均足量)。已知: , 副产物有、等。
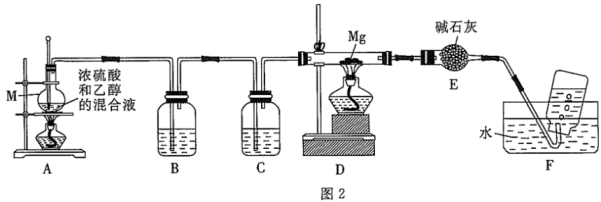
①仪器M的名称是。
②B装置中的试剂是。F装置中集气瓶收集的气体有(除水蒸气外)(填化学式)。
③假设各物质完全反应,根据下列物理量可以计算出的质量的是(填标号)。
a.乙醇的体积和密度 b.镁的质量 c.浓硫酸的体积和密度
16. 以废镍触媒(含、、、、及)为原料制备硫酸镍的工艺流程如图:
已知:①NiS不溶于水或稀硫酸;。
②该工艺流程条件下,有关金属离子开始沉淀和完全沉淀时的pH见下表:
金属离子
开始沉淀时的pH
6.4
2.2
4.1
9.6
完全沉淀时的pH
8.4
3.5
5.4
11.6
回答下列问题:
(1)、“酸溶”时,溶解的化学方程式为。(2)、“滤渣1”的成分是(填化学式)。(3)、“滤液1”的pH约为1.8,在“调节pH”时用氨水逐步调节pH至6.3,依次析出的是(填化学式);取少量“滤液2”,向其中滴入KSCN溶液的目的是。(4)、从“沉镍”到“溶解”还需经过的操作是 , “溶解”时用0.01的硫酸而不用水的原因是。(5)、“滤渣4”并入滤渣(填“1”、“2”或“3”)可实现再利用(6)、某工厂用2t该废镍触媒(NiO含量为75%)制备硫酸镍,设整个流程中Ni的损耗率为20%,最终得到的质量为t。17. 工业上,裂解正丁烷可以获得乙烯、丙烯等化工原料。反应1:
反应2:
已知几种共价键的键能如下表:
共价键
C-H
C=C
C-C
键能/(kJ·mol-1)
413
614
347
(1)、根据上述数据估算,=kJ·mol-1。(2)、正丁烷和异丁烷之间转化的能量变化如图所示。
①正丁烷气体转化成异丁烷气体的热化学方程式为。
②下列有关催化剂的叙述不正确的是(填标号)。
A.能改变反应途径 B.能降低反应焓变
C.能加快反应速率 D.能增大平衡常数
(3)、向密闭容器中投入一定量的正丁烷,发生反应1和反应2,测得正丁烷的平衡转化率(α)与压强(p)、温度(T)的关系如图所示。
①、、由小到大的顺序为。
②随着温度升高,三种不同压强下正丁烷的平衡转化率趋向相等,原因是。
(4)、在一定温度下,向密闭容器中投入正丁烷,同时发生反应1和反应2。测得部分物质的浓度与时间的关系如图,平衡时压强为17akPa。
①7min时改变的条件可能是 (填标号)。
A.增大压强 B.增大正丁烷的浓度 C.加入催化剂
②该温度下,反应1的平衡常数kPa。(提示:组分分压=总压×)
(5)、以惰性材料为电极,正丁烷、空气在熔融盐(以MCO3为电解质)中构成的燃料电池的能量转化率高,通入空气的电极为(填“正极”或“负极”)。18. 工业上采用还原法冾炼黄金(Au)的原理如下:请回答下列问题:
(1)、在元素周期表中,Au与Cu位于同族,基态Au原子比基态Cu原子多2个电子层。基态Au原子的价层电子排布式为 , 金元素位于区。(2)、Zn和Cu相邻,第一电离能:I1(Cu)(填“>”、“<”或“=”,下同)I1(Zn),第二电离能:I2(Cu)I2(Zn)。(3)、1mol中含molσ键。(4)、已知卤化锌的熔点如下表所示:卤化锌
熔点/℃
872
283
394
446
卤化锌的熔点存在差异的主要原因是。
(5)、由金、氯、铯三种元素组成的晶体M,其晶胞结构如图1所示,M的化学式为 , 其中金原子形成了2种不同的配离子(均呈负一价),它们分别是和(写出离子符号,不分顺序)。 (6)、金晶体的晶胞结构如图2所示,其晶胞参数为408pm,金晶体的密度为(只列计算式,设为阿伏加德罗常数的值)。19. XII是某药物的中间体,一种合成XII的路线如图:
(6)、金晶体的晶胞结构如图2所示,其晶胞参数为408pm,金晶体的密度为(只列计算式,设为阿伏加德罗常数的值)。19. XII是某药物的中间体,一种合成XII的路线如图:
已知:III和IV所含官能团相同。
请回答下列问题:
(1)、VII中所含官能团的名称是 , Ⅳ的名称是。(2)、VIII⟶X的反应类型是。(3)、II的结构简式为。(4)、XI⟶XII的化学方程式为。(5)、XIII是VI的同分异构体,同时满足下列条件的XIII的结构(不考虑立体异构)有种。①遇溶液发生显色反应②能发生银镜反应③除苯环外不含其他环
(6)、请设计以1−溴丙烷和Ⅲ为原料合成 的合成路线(其他无机试剂任选)。
的合成路线(其他无机试剂任选)。
-