重庆市九校联盟2021-2022学年高二上学期12月联考化学试题
试卷更新日期:2022-02-21 类型:月考试卷
一、单选题
-
1. 古籍中记载:阳遂金也,取金孟无缘者,执日高三四丈时,以向,持燥艾承之寸馀,有顷焦之,吹之则燃得火。上述记载中是古人对哪种能量的利用( )A、风能 B、水能 C、太阳能 D、地热能2. 钢铁发生析氢腐蚀时,正极上发生的电极反应是( )A、2H++2e-=H2↑ B、Fe2++2e-=Fe C、2H2O+O2+4e-=4OH- D、Fe3++e-=Fe2+3. 下列物质的电离方程式或水解方程式书写正确的是( )A、HCN=H++CN- B、+H2O⇌H3O++ C、+2H2O⇌H2SO3+2OH- D、Al2(SO4)3⇌2Al3++34. 按下列选项要求组成的原电池中,原电池的总反应为Cu+2Ag+=Cu2++2Ag的是( )
A
B
C
D
电极材料
Ag、C
Cu、Ag
Cu、Zn
Cu、Ag
电解质溶液
CuSO4(aq)
CuSO4(aq)
AgNO3(aq)
AgNO3(aq)
A、A B、B C、C D、D5. 对某一可逆反应来说,下列有关使用催化剂和不使用催化剂的说法不正确的是( )A、使用催化剂不能增大反应物的平衡转化率 B、使用催化剂能同等程度改变正、逆反应速率 C、不使用催化剂,反应物在相同时间段内改变的物质的量一定比使用催化剂时少 D、不使用催化剂,平衡时混合物的组成不会改变6. 下列有关沉淀溶解平衡的说法中不正确的是( )A、的溶度积常数表达式 B、难溶于水,溶液中没有和SO C、升高温度,的溶解度增大 D、向悬浊液中加入固体,溶解的量减少7. 已知反应:2NO2(红棕色,g)⇌N2O4(无色,g) ΔH<0。将一定量的NO2充入注射器后封口,起始状态如图甲所示,恒温时,注射器在拉伸或压缩的过程中气体的透光率(气体颜色越深,透光率越小)随时间的变化关系如图乙所示,下列对注射器的移动轨迹判断正确的是( ) A、N→M→N B、N→M→P C、N→P→N D、N→P→M8. 一种采用电解原理获得高浓度HI溶液的装置如图所示,下列有关说法正确的是( )
A、N→M→N B、N→M→P C、N→P→N D、N→P→M8. 一种采用电解原理获得高浓度HI溶液的装置如图所示,下列有关说法正确的是( )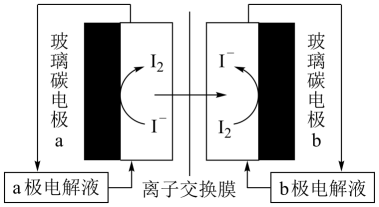 A、玻璃碳电极a与电源正极相连 B、离子交换膜为阴离子交换膜 C、a极电解液为浓溶液 D、该装置是通过牺牲阴极液中的HI来增大阳极液中HI的浓度9. 下列事实能用勒夏特列原理解释的是( )A、向双氧水中加入少量 , 立即产生大量气泡 B、将由组成的平衡体系加压后,体系颜色加深 C、合成氨工业中左右比室温更有利于提高单位时间内氨的产量 D、氯水中存在反应 , 当加入少量溶液时,溶液颜色变浅10. 用如图所示实验装置进行相应实验,不能达到实验目的的是( )
A、玻璃碳电极a与电源正极相连 B、离子交换膜为阴离子交换膜 C、a极电解液为浓溶液 D、该装置是通过牺牲阴极液中的HI来增大阳极液中HI的浓度9. 下列事实能用勒夏特列原理解释的是( )A、向双氧水中加入少量 , 立即产生大量气泡 B、将由组成的平衡体系加压后,体系颜色加深 C、合成氨工业中左右比室温更有利于提高单位时间内氨的产量 D、氯水中存在反应 , 当加入少量溶液时,溶液颜色变浅10. 用如图所示实验装置进行相应实验,不能达到实验目的的是( )A
B
C
D




探究温度对反应平衡的影响
测定酸碱中和反应的反应热
验证对分解反应有催化作用
验证与水反应为放热反应
A、A B、B C、C D、D11. 卤代烃(RI)与端基炔()催化偶联反应的一种机理如图所示。下列说法不正确的是( )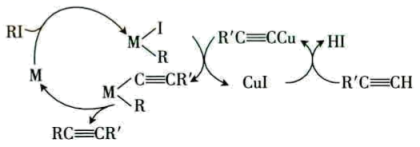 A、偶联反应中RMI和CuI都是催化剂 B、该催化过程中的中间产物有3种 C、该机理的总反应可表示为R'C CH+RIR'CCR+HI D、该催化机理改变了反应路径,但没有改变总反应的反应热12. 在一密闭容器中存在反应: K正。某研究小组研究了在其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
A、偶联反应中RMI和CuI都是催化剂 B、该催化过程中的中间产物有3种 C、该机理的总反应可表示为R'C CH+RIR'CCR+HI D、该催化机理改变了反应路径,但没有改变总反应的反应热12. 在一密闭容器中存在反应: K正。某研究小组研究了在其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )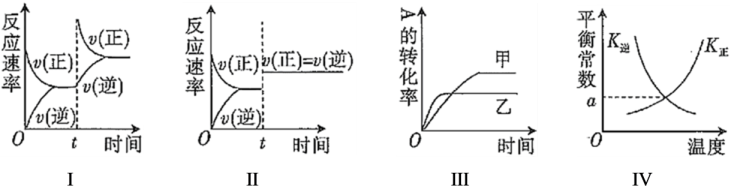 A、图Ⅰ中t时刻改变的条件一定是升高温度 B、图Ⅱ中t时刻改变的条件一定是加入催化剂 C、图Ⅲ中甲和乙改变的条件是温度,且乙的温度更高 D、图Ⅳ中13. 全固态锂硫电池能量密度高、成本低,其工作原理如图所示。其中电极a常用掺有石墨烯的S8材料制作,电池反应式为16Li+xS8=8Li2Sx(2≤x≤8)。下列说法不正确的是( )
A、图Ⅰ中t时刻改变的条件一定是升高温度 B、图Ⅱ中t时刻改变的条件一定是加入催化剂 C、图Ⅲ中甲和乙改变的条件是温度,且乙的温度更高 D、图Ⅳ中13. 全固态锂硫电池能量密度高、成本低,其工作原理如图所示。其中电极a常用掺有石墨烯的S8材料制作,电池反应式为16Li+xS8=8Li2Sx(2≤x≤8)。下列说法不正确的是( ) A、电极b的材料是金属锂 B、放电时,电极a上的反应式可表示为xS8+16Li++16e-=8Li2Sx C、电池充电时,电子从充电电源的负极出发,沿导线流向电极b,再通过电池电解质经电极a流回充电电源的正极 D、电池放电时,当外电路中流过0.3mol电子,负极材料质量减少2.1g14. 常温下,将溶液滴加到某二元弱酸()中,混合溶与或的变化关系如图所示,下列叙述不正确的是( )
A、电极b的材料是金属锂 B、放电时,电极a上的反应式可表示为xS8+16Li++16e-=8Li2Sx C、电池充电时,电子从充电电源的负极出发,沿导线流向电极b,再通过电池电解质经电极a流回充电电源的正极 D、电池放电时,当外电路中流过0.3mol电子,负极材料质量减少2.1g14. 常温下,将溶液滴加到某二元弱酸()中,混合溶与或的变化关系如图所示,下列叙述不正确的是( ) A、 ()的数量级为 B、曲线M表示与的变化关系 C、常温时,溶液显酸性 D、当混合溶液呈中性时,
A、 ()的数量级为 B、曲线M表示与的变化关系 C、常温时,溶液显酸性 D、当混合溶液呈中性时,二、填空题
-
15. 原电池是能源利用的一种方式,在生产、生活、科技等方面都有广泛的应用。(1)、煤既可通过火力发电厂转化为电能,又可通过原电池转化为电能,通过原电池转化为电能的优点有(答两点)。(2)、电工操作中规定,不能把铜线和铝线拧在一起连接线路,原因是。(3)、化学电池的种类很多,依据电解质溶液的酸碱性可将化学电池分为(填数字)类,在图1所示的原电池中,其他条件不变将电解质溶液改为稀硫酸,若电流计指针偏转方向发生了改变,此时金属X可以是(填标号,下同);若电流计指针偏转方向没有发生改变,此时金属X可以是。
A.Mg B.C C.Fe D.Na
 (4)、氢氧燃料电池是宇宙飞船上的一种化学电源,其结构如图2所示。两个电极均由多孔性碳制成,通入的气体从孔隙中逸出,并在电极表面放电,则a极为(填“正极”或“负极”),a极上的电极反应式为。该电池每产生1kW·h电能会生成350gH2O(l),则该电池的能量转化率为(保留四位有效数字)。[已知:2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1]
(4)、氢氧燃料电池是宇宙飞船上的一种化学电源,其结构如图2所示。两个电极均由多孔性碳制成,通入的气体从孔隙中逸出,并在电极表面放电,则a极为(填“正极”或“负极”),a极上的电极反应式为。该电池每产生1kW·h电能会生成350gH2O(l),则该电池的能量转化率为(保留四位有效数字)。[已知:2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1]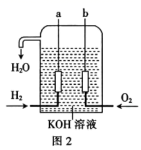 16. 生活中常用到酸和碱,根据所学知识,回答下列问题(以下所有溶液均处于常温下):(1)、现有0.01mol/L的和0.01mol/L的两种溶液。[已知:电离度 , , ]
16. 生活中常用到酸和碱,根据所学知识,回答下列问题(以下所有溶液均处于常温下):(1)、现有0.01mol/L的和0.01mol/L的两种溶液。[已知:电离度 , , ]①的电离方程式为。
②0.01mol/L的的电离度约为%。
③0.01mol/L的的pH=。
④若上述酸和碱等体积充分混合,混合后所得溶液的pH(填“>”、“<”或“=”)7,此时溶液中各离子浓度由大到小的顺序为。
(2)、甲酸钠(HCOONa)属于(填“强”或“弱”)电解质,HCOONa溶液呈碱性的原因是(用离子方程式表示)。0.01mol/L的HCOONa溶液中mol/L。三、综合题
-
17. 乙烯是合成多种塑料的单体,我国科学家开发的特殊催化剂还原制备 , 有利于实现“双碳”目标。
反应原理:
主反应:
副反应:
(1)、已知:、的燃烧热()分别是、。。
。
(2)、在一定温度下,向恒容密闭容器中充入和 , 若只发生主反应,下列情况不能说明主反应达到平衡的是 (填标号)。A.混合气体密度保持不变B.混合气体总压强保持不变
C.乙烯体积分数保持不变D.气体平均摩尔质量保持不变
达到平衡后能提高平衡转化率的措施是 (任填一条)。
(3)、在、、三种不同催化剂作用下(其他条件相同)只发生主反应,测得乙烯的净速率()与温度关系如图1所示。
催化效率最高的是(填“”、“”或“”),A点的正反应速率(填“大于”、“小于”或“等于”)逆反应速率。
(4)、一定温度下,在容积为2L的恒容密闭容器中充入和 , 同时发生了主反应和副反应,达到平衡时的转化率为45%,的选择性为80%,则该温度下,副反应的平衡常数(结果保留2位小数)。提示:的选择性
(5)、常盖下,HCOOH的电离常数 , 将的NaOH溶液和的HCOOH溶液等体积混合,得到混合溶液的pH(填“>”“<”或“=”)7。(6)、以光伏电池为能源,采用电催化还原制备乙烯,装置如图2所示,该装置阴极上的电极反应式为。 18. 焦亚硫酸钠(Na2S2O5)在工业生产和食品加工中均有重要应用,一种生产焦亚硫酸钠的流程如图所示:
18. 焦亚硫酸钠(Na2S2O5)在工业生产和食品加工中均有重要应用,一种生产焦亚硫酸钠的流程如图所示: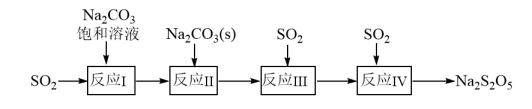
已知:反应I:Na2CO3+2SO2+H2O=2NaHSO3+CO2↑;
反应II:Na2CO3+2NaHSO3=2Na2SO3+CO2↑+H2O。
回答下列问题:
(1)、Na2CO3溶液呈碱性的原因是(用离子方程式表示);Na2CO3溶液中含有的粒子种类有种,Na2CO3溶液中含有的粒子种类(填“大于”、“小于”或“等于”)NaHCO3溶液中含有的粒子种类。(2)、常温时,NaHSO3溶液的pH(填“>”、“<”或“=”)7,理由是。(常温下,H2SO3的两步电离常数为Ka1=1.23×10-2和Ka2=5.6×10-8)。(3)、常温下,浓度相等的CO和SO , 水解程度更大的是 , 上述流程的四步反应中,能说明该结论的是。(4)、测定焦亚硫酸钠(Na2S2O5)含量的一种方法是:取焦亚硫酸钠样品0.5g,加入25mL0.2500mol·L-1标准碘溶液氧化溶解,加1mL稀盐酸、2mL淀粉溶液,用0.2000mol·L-1的硫代硫酸钠标准溶液滴定,发生反应:I2+2S2O=2I-+S4O。滴定至终点时,消耗硫代硫酸钠标准溶液19.80mL。①说明达到滴定终点的现象为。
②该样品中Na2S2O5的百分含量为。