辽宁省名校联盟2021-2022学年高二12月联考化学试题
试卷更新日期:2022-02-21 类型:月考试卷
一、单选题
-
1. 盐类水解在工农业生产和日常生活中有着广泛的应用。下列有关应用或说法与盐类水解无关的是( )A、用热的纯碱溶液洗涤餐具上的油污 B、加入足量Mg(OH)2粉末充分反应并过滤以除去MgCl2溶液中的少量FeCl3 C、用稀硫酸或浓氨水除去铜器表面的铜绿 D、用TiCl4制备TiO2•xH2O时,加入大量水2. “各能级最多容纳的电子数,是该能级原子轨道数的二倍”,支撑这一结论的理论是( )A、构造原理 B、泡利原理 C、洪特规则 D、能量最低原理3. 在现代工业中,锰及其化合物应用于国民经济的各个领域,其中钢铁工业是最重要的领域,用锰量占90%—95%,主要作为炼铁炼钢过程中的脱氧剂和脱硫剂。在自然界中,锰有II、III、IV及VII价态,对于基态锰原子,下列叙述不正确的是( )A、基态锰原子核外电子的运动状态有25种 B、4s电子能量较高,总是在比3s电子离核更远的地方运动 C、电负性比钾高,原子对键合电子的吸引力比钾大 D、锰元素位于周期表的d区4. 制造尼龙—66的原料己二腈NC(CH2)4CN,传统上以乙炔和甲醛为原料经过很长路线才能合成。近年来将丙烯氰电解阴极加氢生成己二腈的电有机合成法在工业化生产中已经非常成熟。其总反应为:4CH2=CHCN+2H2O=2NC(CH2)4CN+O2↑。下列说法不正确的是( )A、若电解过程有1mol电子转移,理论上阳极生成0.25mol气体 B、阳极电极反应式为:2CH2=CHCN+2H++2e-=NC(CH2)4CN C、很多不能自发进行的氧化还原反应可以通过电解法来实现 D、与传统有机合成相比,电有机合成法反应条件温和、反应试剂纯净且生产效率高5. 下列关于金属的腐蚀与防护说法正确的是( )
 A、取图1溶液滴加K3[Fe(CN)6]溶液,溶液变蓝 B、图2是钢铁的吸氧腐蚀,在钢铁表面吸附的水膜呈酸性时不会发生 C、图3图4都要采用辅助阳极,用作辅助阳极的金属材料可以相同 D、图3图4辅助阳极的电极反应类型相同6. 一种电解法制备高纯铬和硫酸的简单装置如图所示。下列说法正确的是( )
A、取图1溶液滴加K3[Fe(CN)6]溶液,溶液变蓝 B、图2是钢铁的吸氧腐蚀,在钢铁表面吸附的水膜呈酸性时不会发生 C、图3图4都要采用辅助阳极,用作辅助阳极的金属材料可以相同 D、图3图4辅助阳极的电极反应类型相同6. 一种电解法制备高纯铬和硫酸的简单装置如图所示。下列说法正确的是( ) A、A膜为阳离子交换膜 B、b为直流电源的正极 C、工作时,甲池中溶液的pH不变 D、阴极反应式为2H++2e-=H2↑7. 短周期元素X、Y,Z、W的原子序数依次增大。用表中信息判断下列说法正确的是( )
A、A膜为阳离子交换膜 B、b为直流电源的正极 C、工作时,甲池中溶液的pH不变 D、阴极反应式为2H++2e-=H2↑7. 短周期元素X、Y,Z、W的原子序数依次增大。用表中信息判断下列说法正确的是( )元素最高价氧化物的水化物
X
Y
Z
W
分子式
H3ZO4
0.1mol•L-1溶液对应的pH(25℃)
1.00
13.00
1.57
0.70
A、元素电负性:W<Z B、简单离子半径:X<Y C、元素第一电离能:W<Z D、简单气态氢化物的稳定性:X<Z8. 某蓄电池放电充电时反应为: , 下列推断不正确的是( )A、放电时,负极的电极反应式是 B、放电时,每转移电子,正极上有被氧化 C、充电时,阳极的电极反应式是 D、该蓄电池的电极可浸在某种碱性电解质溶液中9. 原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+表示,与之相反的用-表示,称为电子的自旋磁量子数。对于基态的氧原子,其价电子自旋磁量子数的代数和为( )A、+或- B、0 C、1或-1 D、+或-10. 已知:T℃时,Ca(OH)2、CaWO4都微溶于水。pCa=-lgc(Ca2+),pX=-lgc(WO)或-lgc(OH-)。T℃时CaWO4、Ca(OH)2的沉淀溶解平衡曲线如图所示,则下列说法正确的是( ) A、图中I代表CaWO4的沉淀溶解平衡曲线 B、向饱和CaWO4溶液中加入饱和石灰水,会出现CaWO4沉淀 C、向饱和石灰水中加入生石灰,恢复原温度,Ksp不变,但溶解度减小 D、Na2WO4溶液与石灰乳混合产生大量CaWO4沉淀,该反应的平衡常数K=10-211. 向0.1 mol•L-1醋酸溶液中逐滴滴入0.1 mol•L-1氢氧化钠溶液,所得溶液离子浓度大小顺序一定不正确的是( )
A、图中I代表CaWO4的沉淀溶解平衡曲线 B、向饱和CaWO4溶液中加入饱和石灰水,会出现CaWO4沉淀 C、向饱和石灰水中加入生石灰,恢复原温度,Ksp不变,但溶解度减小 D、Na2WO4溶液与石灰乳混合产生大量CaWO4沉淀,该反应的平衡常数K=10-211. 向0.1 mol•L-1醋酸溶液中逐滴滴入0.1 mol•L-1氢氧化钠溶液,所得溶液离子浓度大小顺序一定不正确的是( )①c(H+)>c(CH3COO-)>c(OH-)>c(Na+)
②c(CH3COO-)>c(Na+)=c(H+)>c(OH-)
③c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
④c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
⑤c(Na+)>c(CH3COO-)=c(OH-)>c(H+)
⑥c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
⑦c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
A、②③④ B、只有⑥ C、①⑥ D、②④⑤⑥12. 近日,海外媒体报道称,美国芝加哥伊利诺伊大学的研究人员创造了第一个可用的锂碳氧化物电池(简称为Li—CO2电池),新电池的能量密度约是目前锂离子电池能量密度的7倍,可以帮助纯电动车型大大增加续航能力。该电池的工作原理如图所示。下列说法不正确的是( ) A、该电池在可再生能源转换和储存方面具有良好的前景 B、放电时,负极反应式为:4Li++4e-+3CO2=2Li2CO3+C C、充电时转化③发生的反应为2Li2CO3+C+2Br2=3CO2↑+4LiBr D、放电时,碳电极上的电势高于Li电极13. 相同金属在其不同浓度盐溶液中可形成浓差电池。如图所示装置是利用浓差电池电解硫酸钠溶液(a、b电极均为石墨电极),可以制得O2、H2、H2SO4和NaOH。下列说法不正确的是( )
A、该电池在可再生能源转换和储存方面具有良好的前景 B、放电时,负极反应式为:4Li++4e-+3CO2=2Li2CO3+C C、充电时转化③发生的反应为2Li2CO3+C+2Br2=3CO2↑+4LiBr D、放电时,碳电极上的电势高于Li电极13. 相同金属在其不同浓度盐溶液中可形成浓差电池。如图所示装置是利用浓差电池电解硫酸钠溶液(a、b电极均为石墨电极),可以制得O2、H2、H2SO4和NaOH。下列说法不正确的是( ) A、b电极的电极反应为2H2O-4e-=O2↑+4H+ B、c、d离子交换膜依次为阳离子交换膜和阴离子交换膜 C、电池放电过程中,Cu(2)电板上的电极反应为Cu2++2e-=Cu D、电池从开始工作到停止放电,电解池理论上可制得160 g NaOH14. 25℃时,向10mL0.10mol/L的一元弱酸HA(Ka=1.0×10-3)中逐滴加入0.10mol/LNaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示。下列说法不正确的是( )
A、b电极的电极反应为2H2O-4e-=O2↑+4H+ B、c、d离子交换膜依次为阳离子交换膜和阴离子交换膜 C、电池放电过程中,Cu(2)电板上的电极反应为Cu2++2e-=Cu D、电池从开始工作到停止放电,电解池理论上可制得160 g NaOH14. 25℃时,向10mL0.10mol/L的一元弱酸HA(Ka=1.0×10-3)中逐滴加入0.10mol/LNaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示。下列说法不正确的是( ) A、V=10mL时,c(OH-)=c(HA)+c(H+) B、b点时,c(Na+)>c(A-)>c(OH-)>c(H+) C、溶液在a点和b点时水的电离程度相同 D、a点时,c(HA)+c(OH-)=c(Na+)+c(H+)15. 如图是0.01mol/L甲溶液滴定0.01mol/L乙溶液的导电能力变化曲线,其中曲线③是盐酸滴定CH3COONa溶液,其他曲线是醋酸滴定NaOH溶液或者NaOH溶液滴定盐酸。下列说法正确的是( )
A、V=10mL时,c(OH-)=c(HA)+c(H+) B、b点时,c(Na+)>c(A-)>c(OH-)>c(H+) C、溶液在a点和b点时水的电离程度相同 D、a点时,c(HA)+c(OH-)=c(Na+)+c(H+)15. 如图是0.01mol/L甲溶液滴定0.01mol/L乙溶液的导电能力变化曲线,其中曲线③是盐酸滴定CH3COONa溶液,其他曲线是醋酸滴定NaOH溶液或者NaOH溶液滴定盐酸。下列说法正确的是( ) A、仅通过曲线③可以推断相同条件下导电能力:盐酸>CH3COONa溶液 B、b点溶液呈中性 C、曲线①是醋酸滴定NaOH溶液导电能力变化曲线 D、溶液的导电能力与离子浓度和离子带电量有关,与离子种类无关
A、仅通过曲线③可以推断相同条件下导电能力:盐酸>CH3COONa溶液 B、b点溶液呈中性 C、曲线①是醋酸滴定NaOH溶液导电能力变化曲线 D、溶液的导电能力与离子浓度和离子带电量有关,与离子种类无关二、综合题
-
16. 近年来,我国航空航天事业成果显著,航空航天材料技术快速发展。(1)、“天宫二号”航天器使用了钛合金,质量轻,强度位于金属之首。钛在周期表中的位置为 , 基态钛原子的价层电子排布式为。(2)、“北斗三号”导航卫星使用的太阳能电池材料砷化镓是优良的化合物半导体,砷的电负性略镓(填“>”“<”),基态镓原子电子占据最高能级的电子云轮廓图为形。(3)、“C919”飞机机身使用的复合材料——碳纤维和环氧树脂。
①下列电子排布图能表示碳原子的最低能量状态的是。碳在成键时,能将一个2s电子激发进入2p能级而参与成键,写出该激发态原子的核外电子排布式。
A.
 B.
B.
C.
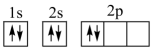 D.
D.
②氧原子的基态原子核外有个未成对电子,有种不同形状的电子云。
17. 双极膜由阳离子交换膜、催化剂层和阴离子交换膜组合而成,在直流电场作用下可将水解离,在双极膜的两侧分别得到H+和OH- , 将其与阳离子交换膜(阳膜)、阴离子交换膜(阴膜)组合,可有多种应用。(1)、海水淡化:模拟海水淡化,并获得浓盐酸和浓氢氧化钠溶液。双极膜组合电解装置示意图如图。
①X极是极。
②图中双极膜的右侧得到的是(填“H+”或“OH-”),电解后在出口可获得较浓的盐酸(填“a”“b”或“c”)。
③电解过程中阳极区溶液中的n(OH-)(填“变大”“变小”或“基本不变”)。
(2)、新型Zn—CO2水介质电池,为解决环境和能源问题提供了一种新途径。电池示意图如图,电极为金属锌和选择性催化材料。放电时温室气体CO2被转化为储氢物质甲酸等。
①放电时电池负极反应为。
②放电时,1molCO2转化为HCOOH,转移的电子数为mol。
③充电时,电池总反应为。
18. 铁、铜及其化合物在日常生活及工业生产中用途非常广泛。(1)、I.FeCl3是常用的金属蚀刻剂和净水剂。
FeCl3净水的原理是(用离子方程式及语言表示)。(2)、FeCl3在溶液中分三步水解:Fe3++H2OFe(OH)2++H+ K1;Fe(OH)2++H2OFe(OH)+H+ K2;Fe(OH)+H2OFe(OH)3+H+ K3。以上水解反应的平衡常数K1、K2、K3由大到小的顺序是。(3)、配制FeCl3溶液时,常将FeCl3晶体溶于浓盐酸中,使用时加蒸馏水稀释至指定浓度。某同学误将FeCl3直接放入自来水中(含有Mg2+、Ca2+、HCO、Cl-等杂质离子),看到红褐色沉淀和大量气泡,试解释出现该现象的原因(用离子方程式表示)。(4)、II.CuCl2常用作电镀添加剂、催化剂及饲料添加剂。①25℃时Fe(OH)2、Fe(OH)3、Cu(OH)2的Ksp如表所示,计算当溶液中Fe2+、Cu2+浓度均为0.1mol/L时,Fe(OH)2沉淀完全及Cu(OH)2开始沉淀时的pH值(已知lg2=0.3,离子浓度小于1.0×10-5mol/L视为沉淀完全)。
分子式
Ksp
开始沉淀时的pH
沉淀完全时的pH
Fe(OH)2
4.0×10-17
6.3
a=
Fe(OH)3
2.79×10-39
1.5
2.8
Cu(OH)2
1.6×10-20
b=
6.6
②为了除去CuCl2溶液中含有的少量FeCl2 , 可以用氧化剂将FeCl2氧化为FeCl3 , 调控溶液pH(填范围),将FeCl3转化为Fe(OH)3除去。
19. 已知CaCrO4微溶于水,某传统测定CaCrO4溶度积的实验如下:①配制250 mL待标定的K2CrO4溶液。
②标定测得K2CrO4溶液浓度为0.6025 mol/L。
③按下表数据将0.2000 mol/LCaCl2溶液、K2CrO4溶液及蒸馏水混匀,静置(溶液体积变化忽略不计)。
④取上层清液于锥形瓶中,加入H2SO4和H3PO4溶液酸化,溶液由黄色转变为橙色,加入指示剂,用0.2000 mol/L(NH4)2Fe(SO4)2溶液滴定,数据记入下表。
组别
体积(mL)
物质
1
2
3
4
5
6
CaCl2
25.00
25.00
25.00
25.00
25.00
25.00
K2CrO4
15.00
16.00
17.00
18.00
19.00
20.00
蒸馏水
10.00
9.00
8.00
7.00
6.00
5.00
取上层清液
10.00
10.00
10.00
10.00
10.00
10.00
耗(NH4)2Fe(SO4)2
13.33
15.00
16.78
18.42
20.15
21.89
⑤滴定测出上层清液中的c(),进而计算出上层清液中的c(Ca2+),即得Ksp(CaCrO4)。
回答下列问题:
(1)、步骤①中无需使用下列哪些仪器(填标号)。 (2)、基态Cr原子的电子排布式为。(3)、步骤④中所得橙色溶液中铬元素的主要存在形式为(填化学式);滴定时还原产物为Cr3+ , 写出反应的离子方程式。(4)、根据第2组滴定数据,计算得上层清液中c()=mol/L。(5)、滴定时,有一组数据出现了明显异常,所测c()偏大,原因可能有____(填标号)。A、滴定终点读数时仰视刻度线 B、达终点时滴定管尖嘴有标准液悬挂 C、盛装待测液的锥形瓶未润洗 D、摇动锥形瓶时有液体溅出(6)、利用上表数据经计算绘制出如下图点,请根据图点绘出溶度积曲线。
(2)、基态Cr原子的电子排布式为。(3)、步骤④中所得橙色溶液中铬元素的主要存在形式为(填化学式);滴定时还原产物为Cr3+ , 写出反应的离子方程式。(4)、根据第2组滴定数据,计算得上层清液中c()=mol/L。(5)、滴定时,有一组数据出现了明显异常,所测c()偏大,原因可能有____(填标号)。A、滴定终点读数时仰视刻度线 B、达终点时滴定管尖嘴有标准液悬挂 C、盛装待测液的锥形瓶未润洗 D、摇动锥形瓶时有液体溅出(6)、利用上表数据经计算绘制出如下图点,请根据图点绘出溶度积曲线。 (7)、请结合图线推测Ksp(CaCrO4)≈(保留两位有效数字)。
(7)、请结合图线推测Ksp(CaCrO4)≈(保留两位有效数字)。