北京市房山区2020-2021学年高二上学期期末考试化学试题
试卷更新日期:2022-02-21 类型:期末考试
一、单选题
-
1. 下列装置工作时,将电能转化为化学能的是( )




A.风力发电机
B.硅太阳能电池
C. 纽扣式银锌电池
D. 电解熔融氯化钠
A、A B、B C、C D、D2. 关于化学反应与能量的说法中,错误的是( )A、需要点燃的反应属于吸热反应 B、能量变化是化学变化的基本特征之一 C、化学变化中能量变化主要是由化学键变化引起的 D、化学变化中能量变化的大小与反应物的质量多少有关3. 下列微粒能与水电离产生的离子作用生成弱电解质的是( )A、 B、K+ C、 D、Cl-4. 下列物质加入水中,不影响水的电离平衡的是( )A、H2SO4 B、NaCl C、NaOH D、CH3COONa5. 下列食品添加剂中,其使用目的与反应速率有关的是( )A、抗氧化剂 B、调味剂 C、着色剂 D、增稠剂6. 下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)( )A
B
C
D

NaCl溶于水

电解CuCl2溶液

CH3COOH在水中电离

H2与Cl2反应能量变化
NaCl=Na++Cl−
CuCl2=Cu2++2Cl−
CH3COOHCH3COO−+H+
H2(g)+Cl2(g)=2HCl(g)
ΔH=−183kJ·mol−1
A、A B、B C、C D、D7. 某同学用0.1 mol/L 的盐酸滴定20.00 mL NaOH溶液,测定其浓度。下列操作正确的是( )A、需用NaOH溶液润洗锥形瓶 B、用量筒量取20.00 mL NaOH溶液 C、滴定前,使酸式滴定管尖嘴部分充满盐酸 D、充分反应后,滴入酚酞溶液,观察是否到达滴定终点8. 相同温度下,下列溶液按pH由小到大顺序排列的是 ( )①0.1mol/L HCl溶液 ②0.1mol/L H2SO4溶液 ③0.1mol/L CH3COOH溶液 ④0.1mol/L CH3COONa溶液
A、①②③④ B、②①③④ C、①③②④ D、④③②①9. 硫代硫酸钠溶液与稀硫酸反应的化学方程式为: Na2S2O3+ H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是( )实验
反应温度/℃
Na2S2O3溶液
稀H2SO4
H2O
V/mL
c/(mol·L-1)
V/mL
c/(mol·L-1)
V/mL
A
25
5
0.1
10
0.1
5
B
25
5
0.2
5
0.2
10
C
35
5
0.1
10
0.1
5
D
35
5
0.2
5
0.2
10
A、A B、B C、C D、D10. 痛风病与关节滑液中形成的尿酸钠(NaUr)有关(NaUr增多,病情加重),其化学原理为:HUr(aq)+Na+(aq)NaUr(s)+H+(aq) ∆H<0。下列说法错误的是( )A、寒冷季节更易诱发关节疼痛 B、大量饮水会增大痛风病发作的可能性 C、饮食中摄入过多食盐,会加重痛风病病情 D、患痛风病的人应少吃能代谢产生更多尿酸的食物11. 硫酸盐(含、)气溶胶是PM2.5的成分之一、近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下:
下列说法错误的是( )
A、该过程有H2O参与 B、NO2是生成硫酸盐的氧化剂 C、硫酸盐气溶胶呈酸性 D、该过程没有新化学键的生成12. 下列实验操作及现象与推论解释不相符的是( )选项
操作及现象
推论或解释
A
电解CuCl2溶液,阴极得到Cu;
电解NaCl溶液,阴极得不到Na
得电子能力:Cu2+>H+>Na+
B
用同浓度NaOH溶液滴定等体积等pH的HCl与CH3COOH溶液,后者消耗NaOH溶液体积多
HCl在水中完全电离,CH3COOH在水溶液中存在电离平衡
C
用pH计测定相同浓度的CH3COONa溶液和NaClO溶液的pH,前者的pH小于后者的
HClO的酸性弱于CH3COOH
D
将固体CaSO4加入饱和Na2CO3溶液中,一段时间后,检验固体成分为CaCO3
相同温度下溶解度:CaSO4 < CaCO3
A、A B、B C、C D、D13. 向某密闭容器中充入 NO2 , 发生反应:2NO2(g) N2O4(g)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表:(已知:N2O4 为无色气体)t/℃
27
35
49
70
NO2%
20
25
40
66
N2O4%
80
75
60
34
下列说法错误的是( )
A、27℃时,该平衡体系中 NO2 的转化率为 B、平衡时,NO2的消耗速率为N2O4消耗速率的2倍 C、室温时,将盛有NO2的密闭玻璃球放入冰水中其颜色会变浅 D、增大NO2起始量,可增大相同温度下该反应的化学平衡常数14. 某同学研究FeSO4溶液和AgNO3溶液的反应,设计如下对比实验。实验

Ⅰ

Ⅱ
现象
连通电路后,电流表指针向右偏转,分别取反应前和反应一段时间后甲烧杯中的溶液,滴加KSCN溶液,前者几乎无色,后者显红色
连通电路后,电流表指针向左发生微小的偏转,丙、丁烧杯中均无明显现象
下列说法正确的是( )
A、仅由Ⅰ中的现象可推知Ag+的氧化性强于Fe3+ B、Ⅱ中电流表指针向左偏转的原因是Fe2+氧化了银电极 C、Ⅱ中若将银电极换成石墨电极,电流表指针可能不再向左偏转 D、对比Ⅰ、Ⅱ可知,Ⅰ中NO3-氧化了Fe2+二、综合题
-
15. 25℃,向20.00 mL 0.100 mol·L−1 CH3COOH中滴加0.100 mol·L−1 NaOH过程中,pH变化如图所示。
 (1)、A点溶液pH1.(填“>”、“<”或“=”)。(2)、下列有关B点溶液的说法正确的是(填字母序号)。
(1)、A点溶液pH1.(填“>”、“<”或“=”)。(2)、下列有关B点溶液的说法正确的是(填字母序号)。a.溶质为:CH3COOH、CH3COONa
b.微粒浓度满足:c(Na+) + c(H+) = c(CH3COO−) + c(OH−)
c.微粒浓度满足:c(Na+) = c(CH3COOH) + c(CH3COO−)
(3)、A、C两点水的电离程度:AC(填“>”、“<”或“=”)。(4)、滴加 20 mL NaOH 溶液时,D点溶液的pH >7,原因是(用离子方程式表示)。16. 过氧化氢(H2O2)是重要的化工产品,广泛应用于绿色化学合成。医疗消毒等领域。回答下列问题:(1)、已知:H2(g)+O2(g)=H2O(l) △H1=-286 kJ·mol-1H2(g)+O2(g)=H2O2(l) △H2=-188 kJ·mol-1
①过氧化氢分解反应2H2O2(l)=2H2O(l)+O2(g)的 △H=kJ·mol-1。
②不同温度下过氧化氢分解反应的平衡常数K(313K)K(298K) (填 “>”、 “<”或“=”)。
(2)、H2O2早期制备方法:Ba(NO3)2BaOBaO2滤液H2O2①I为分解反应,产物除BaO、O2外,还有一种红棕色气体。该反应的化学方程式是。
②II为可逆反应,促进该反应正向进行的措施是。
③III中生成H2O2 , 反应的化学方程式是。
④减压能够降低蒸馏温度,从H2O2的化学性质角度说明V中采用减压蒸馏的原因:。
(3)、电化学制备方法:已知反应2H2O2=2H2O+O2↑能自发进行,反向不能自发进行,通过电解可以实现由H2O和O2为原料制备H2O2 , 如图为制备装置示意图。
①a极的电极反应式是。
②下列说法正确的是。
A.该装置可以实现化学能转化为电能
B.电极b连接电源正极
C.该方法相较于早期制备方法具有原料廉价,对环境友好等优点
17. 铁及其化合物是生活中常见的物质。(1)、铁件表面镀铜可有效防止铁被腐蚀,电镀时,以CuSO4溶液为电解液,铜作(填 “阳”或“阴”)极,铜离子向极移动,阴极的电极反应式为。(2)、下图中,为了减缓海水对铁闸门A的腐蚀,材料B可以选择(填字母序号)。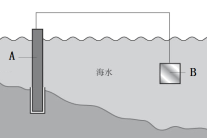
a.碳棒 b.锌板 c.铜板
用电化学原理解释材料B需定期拆换的原因:。
(3)、将FeCl3溶液滴加到Mg(OH)2悬浊液中,有红褐色沉淀产生。该变化的离子方程式为。18. 合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。(1)、反应N2(g)+3H2(g)⇌2NH3(g)的化学平衡常数表达式为。(2)、请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是。序号
化学反应
K(298K)的数值
①
N2(g) + O2(g)⇌ 2NO(g)
5×10-31
②
N2(g) + 3H2(g)⇌2NH3(g)
4.1×106
(3)、对于反应N2(g)+3H2(g)⇌2NH3(g),在一定条件下氨的平衡含量如下表。温度/℃
压强/MPa
氨的平衡含量
200
10
81.5%
550
10
8.25%
①该反应为(填“吸热”或“放热”)反应。
②其他条件不变时,温度升高氨的平衡含量减小的原因是(填字母序号)。
a.温度升高,正反应速率减小,逆反应速率增大,平衡逆向移动
b.温度升高,浓度商(Q)变大,Q>K,平衡逆向移动
c.温度升高,活化分子数增多,反应速率加快
d.温度升高,K变小,平衡逆向移动
③哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,可能的原因是。
(4)、图1表示500℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中M点数据计算N2的平衡体积分数; (5)、图2是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是(填“温度”或“压强”);判断L1、L2的大小关系并说明理由。
(5)、图2是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是(填“温度”或“压强”);判断L1、L2的大小关系并说明理由。 19. 为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:(1)、为分析Fe3+和Cu2+对H2O2分解反应的催化效果,甲同学设计如下实验(三支试管中均盛有10 mL 5% H2O2 ) :
19. 为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:(1)、为分析Fe3+和Cu2+对H2O2分解反应的催化效果,甲同学设计如下实验(三支试管中均盛有10 mL 5% H2O2 ) :试管
Ⅰ
Ⅱ
Ⅲ
滴加试剂
5滴0.1mol/LFeCl3
5滴0.1mol/L CuCl2
5滴0.3 mol/LNaCl
产生气泡情况
较快产生细小气泡
缓慢产生细小气泡
无气泡产生
①实验结论是。
②实验Ⅲ的目的是。
(2)、为分析不同微粒对H2O2分解的催化作用,乙同学向四支盛有10mL5% H2O2的试管中滴加不同溶液,实验记录如下:试管
Ⅰ
Ⅱ
Ⅲ
Ⅳ
滴加试剂
2滴1mol/L
Na2SO4
2滴1mol/L
CuSO4
2滴1mol/L CuSO4和2滴1mol/L NaCl
2滴1mol/L CuSO4和4滴1mol/L NaCl
产生气泡情况
无气泡产生
均产生气泡,且气泡速率从Ⅱ到Ⅳ依次加快
结合实验(1)的Ⅲ,实验(2)可得出的结论是。
(3)、丙同学对实验中Fe3+催化H2O2分解反应的机理产生了兴趣。查阅资料:Fe3+催化H2O2分解反应时发生了两步氧化还原反应:i.2Fe3++H2O2 = 2Fe2++O2↑+2H+ ;ⅱ.……
①ii的离子方程式是。
②该小组同学利用下列实验方案了证实上述催化过程。请将实验方案补充完整。
a.取2 mL 5%H2O2溶液于试管中,滴加5滴0.1mol/L FeCl3溶液,充分振荡,迅速产生气泡, , 证明反应ⅰ的发生。
b.另取2mL 5%H2O2溶液于试管中,滴加 , 证明反应ⅱ的发生。
③H2O2溶液中无FeCl3时“反应过程—能量”示意图如图所示,请在图中画出H2O2溶液中加入FeCl3后,对应的“反应过程—能量”图。
