四川省泸州市2021-2022学年高一上学期期末统考化学试题
试卷更新日期:2022-02-21 类型:期末考试
一、单选题
-
1. 下列物质属于电解质的是( )A、Cu B、KNO3 C、盐酸 D、SO22. 2021 年3月,四川广汉三星堆遗址再次启动发掘,下列三星堆文物是由合金材料制成的是( )A、象牙 B、青铜神树 C、玉璋 D、陶器3. 下列物质都能使糖水中的色素褪色,其原理不属于氧化漂白的是( )A、新制氯水 B、HClO C、活性炭 D、H2O24. 下列关于胶体的叙述中,正确的是( )A、胶体粒子能透过半透膜 B、胶体不稳定,放置片刻沉降 C、将Fe3+(aq)加入NaOH(aq)可快速制得Fe(OH)3胶体 D、用可见光束照射Fe(OH)3胶体,从侧面看到一条光亮的“通路”5. 下列有关实验安全的说法正确的是( )A、点燃H2之前应先检验气体纯度 B、将水注入浓硫酸配制稀硫酸 C、用吹灭的方法熄灭酒精灯 D、金属钠着火,可用泡沫灭火器灭火6. 化学创造美好生活。 下列叙述不正确的是( )A、铝易被空气氧化,铝保存在煤油中 B、漂白粉使用时加稀醋酸,可增强漂白性 C、碳化硅硬度大,可用作砂纸的磨料 D、硅胶具有较强吸附水的能力,可用作干燥剂7. NA代表阿伏加德罗常数,下列叙述正确的是( )A、3.2g氧气含有的质子数为8NA B、1L 0.1mol/L Na2SO4水溶液,含有的氧原子数为0.4 NA C、1mol Na与O2完全反应生成Na2O2 , 转移电子数为NA D、相同物质的量的CO和CO2气体所含碳原子数均为NA8. 下列物质的性质实验对应的离子方程式正确的是( )A、将醋酸溶液滴到大理石上有气泡产生: 2H++CaCO3=CO2↑+Ca2++H2O B、氯化铝溶液中滴入少量氢氧化钠溶液: Al3++3OH-= Al(OH)3↓ C、稀硫酸与AgNO3溶液反应:H2SO4+2Ag+ = 2H++Ag2SO4↓ D、向FeCl3溶液中加入Fe粉,溶液变为浅绿色:Fe3++Fe=2Fe2+9. 下列有关现象的描述正确的是( )A、向硫酸镁溶液中逐滴滴入氨水,先产生白色沉淀,后沉淀溶解 B、过氧化钠加入水后迅速滴加2滴酚酞,溶液最终呈蓝色 C、CaCl2溶液中通入CO2 , 生成白色沉淀 D、铜在氯气中燃烧,产生棕黄色烟10. 高铁酸钾(K2FeO4) 是一种新型、高效、多功能水处理剂,其固体溶于水发生如下反应:4K2FeO4+10H2O=4Fe(OH)3(胶体)+8KOH+3O2↑,下 列有关叙述不正确的是( )A、K2FeO4具有强氧化性,有杀菌消毒功能 B、该反应中氧化产物与还原产物的物质的量之比为3∶4 C、该反应每生成22.4LO2转移4mol电子 D、生成Fe(OH)3胶体具有吸附和絮凝作用而净化水11. 用下列实验装置进行相应实验,设计符合题意且能达到实验目的的是( )
 A、用图一方式萃取振荡 B、用图二装置过滤 C、用图三装置进行蒸馏 D、用图四装置检验碳酸氢钠的热分解12. 某400mL水溶液中,可能含有以下离子中的某几种: Na+、 Ba2+、Al3+、 Fe3+、SO、NO , 现将样品平均分为两份,分别进行如下图实验。据此推断,正确的是( )
A、用图一方式萃取振荡 B、用图二装置过滤 C、用图三装置进行蒸馏 D、用图四装置检验碳酸氢钠的热分解12. 某400mL水溶液中,可能含有以下离子中的某几种: Na+、 Ba2+、Al3+、 Fe3+、SO、NO , 现将样品平均分为两份,分别进行如下图实验。据此推断,正确的是( ) A、一定不存在Ba2+、Fe3+、 NO B、可能存在Al3+ C、无法确定Na+ , 需焰色反应进一步确定 D、该溶液中SO离子浓度为0.1mol/L
A、一定不存在Ba2+、Fe3+、 NO B、可能存在Al3+ C、无法确定Na+ , 需焰色反应进一步确定 D、该溶液中SO离子浓度为0.1mol/L二、填空题
-
13. 回答下列问题:(1)、工业上,FeCl3溶液作为将铜箔刻制成电路的“腐蚀液”,产物是CuCl2和 , 回收铜,可向腐蚀后的溶液中加入 ( 选填“钠块”铁粉”或“银粉”)(2)、过氧化钠(Na2O2) 中氧的化合价为 , 它可用于呼吸面具中的供氧剂,其反应中氧化剂与还原剂的物质的量之比为。(3)、某化学兴趣小组拟开展探究FeSO4溶液性质的实验。回答下列问题:
①用绿矾(FeSO4· 7H2O)配制500mL 0.1mol/L的FeSO4溶液,需要用到的玻璃仪器除量筒、烧杯、玻璃棒外,还需使用(填仪器名称)。
②下列操作可能使所配溶液浓度偏大的是(填选项编号)。
A.未洗涤烧杯和玻璃棒
B.定容时俯视容量瓶的刻度线定容
C.配制溶液前容量瓶中有少量的蒸馏水
D.摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
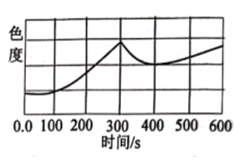
③FeSO4溶液露置在空气中颜色会加深,如图为该溶液露置在空气中,并在300s时加入10滴维生素C溶液,其色度(即颜色的色调和饱和度)随时间变化的图像,则维生素C导致溶液色度变化的原因是。
三、综合题
-
14. 某化学小组制备Cl2并探究Cl2的性质,其装置如下图:

请回答下列问题:
(1)、A中发生的反应方程式为2KMnO4+16HCl(浓)= 2KCl+5Cl2↑+2MnCl2+8H2O,该反应中氧化剂为 , 其离子方程式为。(2)、此法制取的Cl2中会混有的杂质气体为和水蒸汽,为了除去杂质,C中所盛放的药品是。(3)、若反应后装置D硬质玻璃管中有Fe粉剩余,将反应后的固体加水振荡,检验溶液中是否含有Fe2+的实验方案是:取少量溶解后的溶液于试管中,滴加少量。若观察到现象,且未见使湿润淀粉KI试纸变蓝的气体,则证明含Fe2+。(可供选择的试剂: KSCN 溶液、KMnO4 稀溶液、NaOH 溶液)(4)、E中装有紫色石蕊试液,则E中现象是。(5)、F中盛有FeBr2溶液,G中装有NaBr溶液,当G溶液中产生红棕色Br2时,F中发生反应的离子方程式为。15. 明矾是生活中常见的净水剂,用铝土矿(含30%SiO2、40.8%Al2O3和少量Fe2O3等)制取明矾的工艺如下: (1)、焙烧除铁反应:4(NH4)2SO4+Fe2O32NH4Fe(SO4)2+3H2O+6A↑(Al2O3少部分发生类似反应)。气体A的化学式为。(2)、操作①的名称是 , 操作①后,需洗涤固体D表面吸附的离子,判断固体D是否洗涤干净的实验方法是:取最后一次洗涤后的浸出液于试管中,滴加KSCN溶液,观察到 , 说明已洗涤干净。(3)、固体D加稀硫酸反应的离子方程式为。(4)、操作③的具体步骤是蒸发、、过滤、洗涤、干燥。(5)、固体E与NaOH固体焙烧可制备防火材料,下列装置适合的是(填字母编号)。
(1)、焙烧除铁反应:4(NH4)2SO4+Fe2O32NH4Fe(SO4)2+3H2O+6A↑(Al2O3少部分发生类似反应)。气体A的化学式为。(2)、操作①的名称是 , 操作①后,需洗涤固体D表面吸附的离子,判断固体D是否洗涤干净的实验方法是:取最后一次洗涤后的浸出液于试管中,滴加KSCN溶液,观察到 , 说明已洗涤干净。(3)、固体D加稀硫酸反应的离子方程式为。(4)、操作③的具体步骤是蒸发、、过滤、洗涤、干燥。(5)、固体E与NaOH固体焙烧可制备防火材料,下列装置适合的是(填字母编号)。a.
 b.
b. c.
c. d.
d. (6)、不计过程中的损失,投入5t铝土矿,理论上可制得明矾t(明矾的相对分子质量为474)。16. 受疫情影响,自2020年底,芯片短缺就一直 占据汽车行业话题榜首。当前芯片主要是硅基芯片。回答相关问题:
(6)、不计过程中的损失,投入5t铝土矿,理论上可制得明矾t(明矾的相对分子质量为474)。16. 受疫情影响,自2020年底,芯片短缺就一直 占据汽车行业话题榜首。当前芯片主要是硅基芯片。回答相关问题:资料:①SiHCl3 能与H2O剧烈反应,在空气中易自燃;②粗SiHCl3 (沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃)
(1)、I.制备高纯硅的主要工艺流程如图所示:

流程①的化学反应方式为。(2)、流程③提纯SiHCl3的操作名称是。(3)、流程④的化学反应为置换反应,其化学方程式为。(4)、II.流程④制备高纯硅的装置如图(热源及夹持装置略去)。
若要从下列玻璃仪器中选择部分来组装A处的气体发生装置,不需要的是 (填字母编号);装置B的作用是;对C中烧瓶加热至33.0℃左右的目是 ,让H2与SiHCl3在D装置中高温反应。
a. 分液漏斗 b.锥形瓶 c.酒精灯 d.漏斗 e.导管
(5)、为保证制备高纯硅实验的成功,操作的关键是检查实验装置的气密性,以及和控制好反应温度。
-