辽宁省辽阳市2021-2022学年高一上学期期末考试化学试题
试卷更新日期:2022-02-21 类型:期末考试
一、单选题
-
1. 钒钛磁铁矿中,伴有较丰富的钒(V)、钛(Ti)资源。钛(Ti)的原子序数为22,为钛的一种核素。下列说法正确的是( )A、、互为同位素 B、与互为同素异形体 C、中含有50个中子 D、的中子数与质子数之差为282. 下列不能用作反应仪器的是( )




A.试管
B.坩埚
C.容量瓶
D.圆底烧瓶
A、A B、B C、C D、D3. 下列物质的俗名与其成分相匹配且有关叙述合理的是( )A、铁红(),可用作红色油漆的颜料 B、硬铝(Al、),硬度大,密度小,抗腐蚀 C、液氯(),黄绿色气体,具有漂白性 D、小苏打(),可用于治疗胃酸过多4. 下列物质不含共价键的是( )A、 B、 C、 D、5. 下列材料不属于合金的是( )A、铸造下水井盖的生铁 B、储氢用的合金 C、可用于机器人“皮肤”的橡胶 D、可用于军用车辆的超级钢6. 铁及其化合物是中学化学中重要的物质。下列有关铁及其化合物说法正确的是( )A、被腐蚀的铁制品属于可回收垃圾 B、不能通过物理方法将铁粉和铝粉分离 C、铁锈的主要成分是 D、指南针中因含有而可以指定方位7. 下列各组离子因能反应生成气体而不能大量共存的是( )A、、、、 B、、、、 C、、、、 D、、、、8. 下表是元素周期表的一部分,其中X、Y、Z、W均为短周期主族元素,已知Z的最外层电子数是其电子层数的3倍,下列说法不正确的是( )X
Y
Z
W
A、简单离子半径: B、仅由X与Z形成的化合物中只存在共价键 C、最简单氢化物的沸点: D、最高价氧化物对应水化物的酸性:9. 向含有一定物质的量的和的混合溶液中逐渐加入粉至过量,该溶液的质量随加入铁粉的质量的变化关系图为( )A、 B、
B、 C、
C、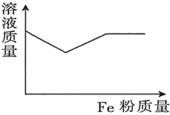 D、
D、 10. 已知常温下,在溶液中发生如下反应:① ② ③ , 由此推断下列说法正确的是( )A、还原性: B、X元素在反应③中被还原 C、反应可以进行 D、氧化性:11. 下列有关实验操作及现象与实验目的相符的是( )
10. 已知常温下,在溶液中发生如下反应:① ② ③ , 由此推断下列说法正确的是( )A、还原性: B、X元素在反应③中被还原 C、反应可以进行 D、氧化性:11. 下列有关实验操作及现象与实验目的相符的是( )选项
实验目的
实验操作及现象
A
除去某溶液中含有的杂质
向该溶液中通入足量的
B
验证某溶液已变质
取少量该溶液,向其中滴加溶液,溶液变红
C
检验某溶液为溶液
用净的的铂丝蘸取少量的该溶液置于精灯上灼烧,火焰呈黄色
D
验证某溶液中含有
取少量该溶液,向其中先加入稀盐酸酸化,再加入溶液,产生白色沉淀
A、A B、B C、C D、D12. 下列反应对应的离子方程式正确的是( )A、将溶液与酸性溶液混合: B、向稀硫酸中加入少量氧化亚铁: C、向稀盐酸中加入少量铁粉: D、向氢氧化钠稀溶液中加入适量的铝片:13. 设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )A、和于密闭容器中充分反应后,容器中分子总数为0.2NA B、溶于水后,生成的HClO分子总数为0.2NA C、0.1mol/L的溶液中,含有的数目为0.3NA D、与一定量反应,生成和的混合物,钠失去的电子数为2NA14. X、Y、Z均为元素周期表中前三周期元素,、、三种简单离子的电子层结构相同,下列说法正确的是( )A、原子序数:Z>X B、原子半径:Y>Z C、气态氢化物的稳定性: D、离子半径:15. 某化学小组用如图装置,模拟呼吸面具中的有关反应测定样品中Na2O2的纯度。已知实验中Na2O2样品的质量为8.0g,实验结束后共收集到标准状况下1.12L气体,下列说法中不正确的是( ) A、装置Ⅰ中a的作用是保持上下压强一致,使液体顺利滴下 B、装置Ⅲ中可观察到淡黄色固体颜色逐渐变浅,最后变为白色固体 C、装置Ⅱ的作用是除去挥发出来的HCl D、样品中Na2O2的纯度为48.75%
A、装置Ⅰ中a的作用是保持上下压强一致,使液体顺利滴下 B、装置Ⅲ中可观察到淡黄色固体颜色逐渐变浅,最后变为白色固体 C、装置Ⅱ的作用是除去挥发出来的HCl D、样品中Na2O2的纯度为48.75%二、填空题
-
16. 分类是学习化学的一种重要方法,科学合理的分类对于系统掌握知识、提高学习效率、解决问题都有着重要的意义。请回答下列问题:(1)、现有以下物质:①固体 ②稀硫酸 ③熔融KCl ④KOH溶液 ⑤ ⑥铜,上述物质中能导电的是(填标号,下同),属于电解质的是。写出少量的⑤通入④中发生反应的化学方程式:。(2)、请对下列过程形成的分散系进行分类:
①将植物油加入水中,充分搅拌;
②一定温度下,向蒸馏水中加入氯化钠至恰好饱和;
③将颗粒直径为的氧化铜分散在塑料中制备的复合材料;
④将饱和氯化铁溶液加入沸水中加热至呈红褐色。
属于溶液的是(填标号,下同);属于胶体的是。
(3)、常用碘酸钠和亚硫酸氢钠反应来制备单质碘,其化学方程式为。①该反应中被还原的是(填化学式)。
②用单线桥法标出电子的转移方向和数目:。
三、综合题
-
17. 下表为元素周期表的短周期部分,①~⑦代表七种短周期元素。
①
②
③
④
⑤
⑥
⑦
已知:⑤的焰色试验火焰呈黄色。
请填写下列空白:
(1)、②在元素周期表中的位置为;①的原子结构示意图为。(2)、③的一种核素的中子数为10,其原子符号为(用形式表示)。(3)、④和⑦中非金属性较弱的是(填元素符号)。(4)、①和⑤中原子半径较大的是(填元素符号),与⑤同族的下一周期元素和③的最简单氢化物反应的离子方程式为。(5)、将⑥的氧化物加入⑤的最高价氧化物对应水化物的溶液中,发生反应的离子方程式为。18. 根据所学知识回答下列问题:(1)、常温下镁、铝都具有较强的抗腐蚀性,主要原因是。(2)、标准状况下,与同条件下含有相同的氢原子数。(3)、标准状况下,的质量为g。(4)、实验室用与100mL足量的浓盐酸制取氯气,发生反应:(浓)。当完全反应时,参加反应的HCl的物质的量为 , 假设反应后溶液的体积仍为100mL,则反应后的溶液中生成的的物质的量浓度为mol/L。(5)、实验室需配制溶液,实际应称量绿矾()的质量为。配制时,其正确的操作顺序是(填标号,每个标号只能用一次)。①用水洗涤烧杯内壁和玻璃棒2~3次,洗涤液均注入容量瓶,摇匀
②将准确称量的绿矾倒入烧杯中,再加适量水溶解
③将已冷却的溶液沿玻璃棒注入容量瓶中
④将容量瓶盖紧,反复上下颠倒,摇匀
⑤改用胶头滴管加水,使溶液凹面恰好与刻度线相切
⑥继续往容量瓶内小心加水,直到液面接近刻度线下处
19. 我国某现代化铜冶炼厂排放的废水中含有较多的、、、和少量的 , 为了减少污染并变废为宝,该铜冶炼厂以该废水为原料制备硫酸钠、硫酸亚铁晶体()并回收金属铜,设计了如下流程(流程中加入的试剂均过量)。
已知:加入的试剂①为溶液。
回答下列问题:
(1)、操作a的名称为;溶液A中所含的溶质主要为(填化学式)。(2)、加入的试剂③为(填试剂名称)。(3)、检验溶液D中的金属阳离子的具体操作及现象为 , 写出检验过程中属于氧化还原反应的离子方程式:。(4)、若取2mL溶液G加入试管中,然后滴加氢氧化钠溶液,可观察到的现象为 , 此现象中涉及的氧化还原反应的化学方程式为。
-