广东省汕尾市2021-2022学年高三上学期期末调研考试化学试题
试卷更新日期:2022-02-21 类型:期末考试
一、单选题
-
1. 中华文化源远流长,下列关于四大发明的说法正确的是( )A、黑火药的使用不涉及化学变化 B、造纸术所得的纸属于纯净物 C、指南针所用的磁性材料为Al2O3 D、印刷术中所用的胶泥印章属于硅酸盐材料2. 广东省非物质文化遗产闻名全国。下列说法正确的是( )A、潮汕牛肉丸制作过程中可加入NaCl调味 B、顺德双皮奶可用过量SO2漂白,使色泽更加鲜白 C、厚街腊肠可加入过量亚硝酸盐,延长食用期 D、清远走地鸡可用过量激素喂食,缩短发有成长期3. 2021年10月16日,我国神舟十三号载人飞船发射取得圆满成功。下列说法不正确的是( )A、飞船可以用液氢作燃料,液氢属于清洁能源 B、飞船在推进过程中,化学能转变为热能 C、太空陨石中的20Ne的质子数为20 D、大气层中的O3与空气中的O2互为同素异形体4. 绿水青山就是金山银山。下列说法正确的是( )A、过度开荒伐木,促进制造业发展 B、积极研发推广风能、水能等,减少碳排放 C、注重饮食卫生,大量使用一次性木筷、饭盒 D、为节约成本,碎玻璃、废旧电池等生活垃圾无需分类5. 木糖醇广泛存在于各种水果、蔬菜、谷类中,是一种常用的食品甜味添加剂,其分子结构如下图所示,下列说法正确的是( )
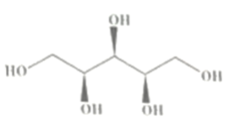 A、该分子中所有碳原子和氧原子共平面 B、木糖醇的分子式为C5H12O5 C、木糖醇不能使酸性KMnO4溶液褪色 D、1mol木糖醇最多可与5molNaOH反应6. 劳动创造美好生活。下列劳动做法与所述的化学知识没有关联的是( )
A、该分子中所有碳原子和氧原子共平面 B、木糖醇的分子式为C5H12O5 C、木糖醇不能使酸性KMnO4溶液褪色 D、1mol木糖醇最多可与5molNaOH反应6. 劳动创造美好生活。下列劳动做法与所述的化学知识没有关联的是( )选项
劳动做法
化学知识
A
用食醋清洗水壶中的水垢
乙酸能够发生酯化反应
B
用草木灰(主要成分为K2CO3)做化肥
K元素是植物生长必不可少的元素
C
医用酒精用于杀菌消毒
乙醇能使蛋白质变性
D
烘培面包使用小苏打做膨松剂
NaHCO3受热分解产生CO2
A、A B、B C、C D、D7. 某兴趣小组要配制物质的最浓度为0.1mL/L的NaCl溶液,下列装置中不需要使用的是( )A、 B、
B、 C、
C、 D、
D、 8. 苯甲酸(C6H5COOH)是一种有机弱酸,下列说法正确的是( )A、常温下,0.1mol/L的C6H5COONa溶液的pH=13 B、相同温度下,相同浓度的盐酸与苯甲酸溶液的pH:盐酸<苯甲酸溶液 C、中和等体积等物质的量浓度的盐酸与苯甲酸溶液,所需NaOH的量:盐酸>苯甲酸溶液 D、C6H5COONa溶液中存在关系:c(C6H5COO—)=c(Na+)=c(H+)=c(OH-)9. 铅蓄电池是应用广泛的二次电池,其工作原理可表示为Pb(s)+PbO2(s)+2H2SO4(aq)2PbSO4(s)+2H2O(l)。下列说法不正确的是( )A、Pb是电池的负极材料 B、放电时,SO移向Pb电极 C、充电时,PbO2电极接外电源负极 D、放电时,PbO2电极增重64g时,外电路理论上通过2NA个电子10. 部分含氮物质的分类与相应化合价的关系如下图所示,下列说法不正确的是( )
8. 苯甲酸(C6H5COOH)是一种有机弱酸,下列说法正确的是( )A、常温下,0.1mol/L的C6H5COONa溶液的pH=13 B、相同温度下,相同浓度的盐酸与苯甲酸溶液的pH:盐酸<苯甲酸溶液 C、中和等体积等物质的量浓度的盐酸与苯甲酸溶液,所需NaOH的量:盐酸>苯甲酸溶液 D、C6H5COONa溶液中存在关系:c(C6H5COO—)=c(Na+)=c(H+)=c(OH-)9. 铅蓄电池是应用广泛的二次电池,其工作原理可表示为Pb(s)+PbO2(s)+2H2SO4(aq)2PbSO4(s)+2H2O(l)。下列说法不正确的是( )A、Pb是电池的负极材料 B、放电时,SO移向Pb电极 C、充电时,PbO2电极接外电源负极 D、放电时,PbO2电极增重64g时,外电路理论上通过2NA个电子10. 部分含氮物质的分类与相应化合价的关系如下图所示,下列说法不正确的是( ) A、d物质可以用排水法收集 B、b物质可以用分离液态空气的方法获得 C、a物质溶于水可得到f D、e的水溶液具有氧化性11. 设NA是阿伏加德罗常数的值,下列说法正确的是( )A、1mol甲基(—CH3)所含的电子数为7NA B、28g乙烯所含的C—H键数目为4NA C、2molSO2与足量O2充分反应生成SO3的分子数为2NA D、0.1mol/LNaCl溶液所含的Na+数目为0.1NA12. 科学探究与创新意识是重要的化学学科核心素养。下列实验操作与类比均合理的一项是( )
A、d物质可以用排水法收集 B、b物质可以用分离液态空气的方法获得 C、a物质溶于水可得到f D、e的水溶液具有氧化性11. 设NA是阿伏加德罗常数的值,下列说法正确的是( )A、1mol甲基(—CH3)所含的电子数为7NA B、28g乙烯所含的C—H键数目为4NA C、2molSO2与足量O2充分反应生成SO3的分子数为2NA D、0.1mol/LNaCl溶液所含的Na+数目为0.1NA12. 科学探究与创新意识是重要的化学学科核心素养。下列实验操作与类比均合理的一项是( )选项
实验操作
类比
A
电解CuSO4溶液可以得到Cu单质
电解Al2(SO4)3溶液可以制备Al单质
B
Fe在常温下遇到浓硫酸钝化
Mg在常温下遇到浓硫酸也会纯化
C
CCl4可以萃取碘水中的I2
CCl4可以萃取溴水中的Br2
D
往NaHCO3溶液中滴入酚酞溶液,溶液变红
NaHSO4溶液也能使酚酞溶液变红
A、A B、B C、C D、D13. 短周期主族元素W、X、Y、Z的原子序数依次增大,W原子的核外电子数为1,X的最外层电子数是电子层数的2倍,Y与Z同主族且核电荷数为Z的一半。下列说法正确的是( )A、原子半径:Z>Y>X B、Z的氧化物对应的水化物都是强酸 C、单质沸点:W>Y D、W与X可形成多种化合物14. 下列反应方程式书写正确的是( )A、铁与足量氯气反应:2Fe+3Cl22FeCl3 B、金属Na在空气中加热:4Na+O2Na2O C、NaAlO2溶液中通入过量CO2:2AlO+CO2+3H2O=2Al(OH)3↓+CO D、Cl2与水反应:Cl2+H2O⇌2H++Cl-+ClO-15. Na2A是一种常见的强碱弱酸盐,常温下,某兴趣小组向20.00mL0.1mol/L的Na2A溶液中滴加0.1mol/L的盐酸,溶液的pH与加入的盐酸体积的关系如下图所示。下列说法正确的是( )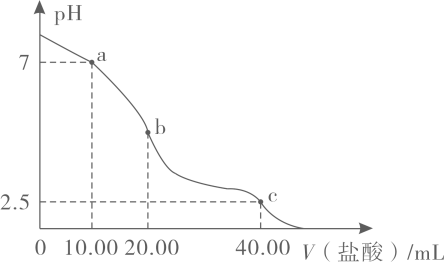 A、盐酸可以装在碱式滴定管中 B、Ka2(H2A)>Kh1(A2-) C、b点溶液中的溶质只有NaHA D、c点存在:c(A2-)+c(HA-)+c(H2A)=0.1mol/L16. 近年来,我国在能源研发与能量转化领城所获得的成就领跑全球。下图是我国科学家研发的一种能量转化装置,利用该装置可实现将CO2转化为CO,并获得NaClO溶液。下列说法不正确的是( )
A、盐酸可以装在碱式滴定管中 B、Ka2(H2A)>Kh1(A2-) C、b点溶液中的溶质只有NaHA D、c点存在:c(A2-)+c(HA-)+c(H2A)=0.1mol/L16. 近年来,我国在能源研发与能量转化领城所获得的成就领跑全球。下图是我国科学家研发的一种能量转化装置,利用该装置可实现将CO2转化为CO,并获得NaClO溶液。下列说法不正确的是( ) A、a为太阳能电池的正极 B、该装置可实现多种能量之间的转化 C、电极Y的反应为Cl--2e-+H2O=ClO-+2H+ D、当有22.4 LCO2参与反应时,外电路通过2NA个电子
A、a为太阳能电池的正极 B、该装置可实现多种能量之间的转化 C、电极Y的反应为Cl--2e-+H2O=ClO-+2H+ D、当有22.4 LCO2参与反应时,外电路通过2NA个电子二、综合题
-
17. 氮化锶(Sr3N2)常用于生产荧光材料,在潮湿环境中容易水解并产生一种具有刺激性气味的气体,实验室常用金属Sr与N2在加热条件下获得,某兴趣小组利用下图装置(夹持装置省略)制取Sr3N2。请回答下列问题:
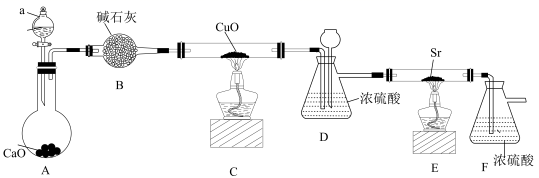 (1)、装置B的名称是;装置D中长颈漏斗的作用是。(2)、装置A中所发生反应的离子方程式为。实验室也经常使用加热Ca(OH)2与(填化学式)固体混合物的方法制备NH3。(3)、装置C中CuO的作用是与NH3反应制备N2 , 该过程中氧化剂与还原剂的物质的量之比为。(4)、装置E中所发生反应的化学方程式为。装置F的作用是。(5)、金属Sr在加热条件下能与O2反应,故制备过程中,打开分液漏斗活塞后,应该先点燃(填“C”或“E”,后同)处酒精灯,一段时间后再点燃处酒精灯。18. 锂电池是目前应用广泛的新型电池,一种回收钴酸锂废旧电池(主要成分为LiCoO2 , 同时含有少量Fe、Al、C单质)的流程如下图所示。
(1)、装置B的名称是;装置D中长颈漏斗的作用是。(2)、装置A中所发生反应的离子方程式为。实验室也经常使用加热Ca(OH)2与(填化学式)固体混合物的方法制备NH3。(3)、装置C中CuO的作用是与NH3反应制备N2 , 该过程中氧化剂与还原剂的物质的量之比为。(4)、装置E中所发生反应的化学方程式为。装置F的作用是。(5)、金属Sr在加热条件下能与O2反应,故制备过程中,打开分液漏斗活塞后,应该先点燃(填“C”或“E”,后同)处酒精灯,一段时间后再点燃处酒精灯。18. 锂电池是目前应用广泛的新型电池,一种回收钴酸锂废旧电池(主要成分为LiCoO2 , 同时含有少量Fe、Al、C单质)的流程如下图所示。
请回答下列问题:
(1)、LiCoO2中Co元素的化合价为。(2)、请写出“碱浸”过程中所发生反应的化学方程式。(3)、加入适量盐酸,LiCoO2溶解后生成的Co3+能将Fe2+氧化为Fe3+。请写出该反应的离子方程式: , 过滤后所得滤渣的主要成分为(写化学式)。(4)、已知Fe3+能与C2O结合成[Fe(C2O4)3]3- , [Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+ , 该过程中(填“有”或“没有”)发生元素化合价的变化;从FeCl3溶液中得到FeCl3·6H2O晶体的操作是:往溶液中加入适量盐酸后,蒸发浓缩、冷却结晶、、洗涤、干燥。(5)、已知Ksp(Li2CO3)=8×10-4 , 滤液B中c(Li+)=0.2mol/L。要生成Li2CO3沉淀,则加入的等体积的Na2CO3溶液中,c(CO)不低于mol/L(忽略溶液混合引起的体积变化),检验滤液中含有Na+的实验方法为。19. 氮氧化物(NOx)能够引起光化学烟雾、酸雨等系列环境问题。减少NOx排放,并将其转化为无害气体,已成为当今世界的热点议题。请回答下列问题:(1)、已知:N2(g)+O2(g)=2NO(g) ΔH1
2C(s)+O2(g)=2CO(g) ΔH2
2CO(g)+2NO(g)=2CO2(g)+N2(g) ΔH3
则C(s)+2NO(g)=CO2(g)+N2(g) ΔH4=(用含有ΔH1、ΔH2、ΔH3的代数式表示)。
(2)、在600℃的恒容密闭容器中发生反应:2CO(g)+2NO(g)2CO2(g)+N2(g) ΔH3<0,该反应的平衡常数表达式为K= , 达到平衡状态的依据为(填标号)。a.混合气体总质量保持不变
b.各组分气体的体积分数保持不变
c.容器内混合气体密度保持不变
d.容器内混合气体压强保持不变
(3)、NO能与氧气反应生成NO2 , 其反应历程如下:第1步:2NO(g)N2O2(g) (快反应)
第2步:N2O2(g)+O2(g)2NO2(g) (慢反应)
则总反应的反应速率由第步决定。
(4)、在一定条件下,NH3能与NO2反应生成N2 , 该反应的化学方程式为 , 消耗17gNH3时,转移电子数为。(5)、利用电化学法能将NO转化为N2 , 其工作原理如下图所示:
①电极I应连接外电源极:
②电极II上发生的电极反应式为。
20. 硫酸亚铁铵又称莫尔盐,其化学成分为(NH4)2Fe(SO4)2·6H2O,在定量分析、电镀冶炼、医学等领域都有广泛用途。请回答下列问题:(1)、基态N原子的核外电子排布式为。(2)、Fe元素位于元素周期表的区,电负性大小:OS(填“>”“<”或“=”)。(3)、SO的空间结构为形,中心原子轨道的杂化方式为。(4)、液氨中存在的分子间作用力包括。(5)、H2O在不同条件下可得到不同结构的晶体,其中一种冰晶体的立方晶胞结构如下图所示:
①每个晶胞中所含的氢键数目为;
②设NA为阿伏加德罗常数的值,晶胞边长为anm,则晶胞密度为g·cm-3。
21. 化合物H是一种常用的抗真菌药物,其合成路线如下图所示。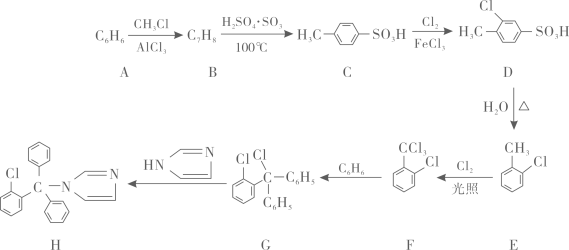
已知:
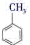 与Cl2在FeCl3作用下能得到甲基邻、对位两种产物。请回答下列问题:(1)、A的结构简式为 , B(填“能”或”不能”)使酸性KMnO4溶液褪色。(2)、B→C的反应类型为反应,E分子中所含的官能团名称为。(3)、请写出D→E的化学方程式:。(4)、B→E的过程不采取直接用甲苯与Cl2在FeCl3作用下反应的原因是。(5)、化合物I与G互为同分异构体,且满足下列条件:
与Cl2在FeCl3作用下能得到甲基邻、对位两种产物。请回答下列问题:(1)、A的结构简式为 , B(填“能”或”不能”)使酸性KMnO4溶液褪色。(2)、B→C的反应类型为反应,E分子中所含的官能团名称为。(3)、请写出D→E的化学方程式:。(4)、B→E的过程不采取直接用甲苯与Cl2在FeCl3作用下反应的原因是。(5)、化合物I与G互为同分异构体,且满足下列条件:①含有3个苯环,且不直接相连;
②核磁共振氢谱有5组峰,且峰面积之比为2:2:1:1:1。
请写出I的结构简式:。
(6)、结合上述信息,请以C6H6、CH3Cl为原料,无机试剂任选,写出邻二甲苯的合成路线:。例:AB……D