浙江省嘉兴市2021-2022学年高二上学期期末检测化学试题
试卷更新日期:2022-02-21 类型:期末考试
一、单选题
-
1. 下列物质的水溶液因水解显酸性的是( )A、 B、NaHSO3 C、 D、HCl2. 下列物质属于非电解质的是( )A、甲酸 B、蔗糖 C、Cl2 D、KOH3. 下列化学用语的表述不正确的是( )A、35Cl和37Cl的原子结构示意图均可表示为:
 B、HClO的结构式:H-O-Cl
C、基态碳原子的轨道表示式:
B、HClO的结构式:H-O-Cl
C、基态碳原子的轨道表示式: D、HF的电子式:
D、HF的电子式: 4. Ca元素基态原子的N能层中的电子数为( )A、8 B、2 C、18 D、105. 下列电离方程式不正确的是( )A、 B、 C、 D、6. 下列说法不正确的是( )A、同位素示踪法常用于研究化学反应历程 B、可以利用物质的颜色变化和浓度变化间的比例关系来测量反应速率 C、采用合适的催化剂可以使一些不自发的化学反应得以实现 D、勒夏特列原理无法解释将平衡体系加压后颜色变深7. 利用如图所示装置进行中和热测定实验,下列说法不正确的是( )
4. Ca元素基态原子的N能层中的电子数为( )A、8 B、2 C、18 D、105. 下列电离方程式不正确的是( )A、 B、 C、 D、6. 下列说法不正确的是( )A、同位素示踪法常用于研究化学反应历程 B、可以利用物质的颜色变化和浓度变化间的比例关系来测量反应速率 C、采用合适的催化剂可以使一些不自发的化学反应得以实现 D、勒夏特列原理无法解释将平衡体系加压后颜色变深7. 利用如图所示装置进行中和热测定实验,下列说法不正确的是( ) A、向盛装酸溶液的烧杯中加碱溶液时要小心缓慢 B、烧杯间填满碎泡沫塑料是为了减少实验过程中的热量损失 C、使用环形玻璃搅拌棒既可以搅拌又可以避免损坏温度计 D、测定酸溶液后的温度计要用蒸馏水清洗、干燥后再测碱溶液的温度8. 埋在地下的钢管常用如图所示方法加以保护,使其免受腐蚀,下列说法不正确的是( )
A、向盛装酸溶液的烧杯中加碱溶液时要小心缓慢 B、烧杯间填满碎泡沫塑料是为了减少实验过程中的热量损失 C、使用环形玻璃搅拌棒既可以搅拌又可以避免损坏温度计 D、测定酸溶液后的温度计要用蒸馏水清洗、干燥后再测碱溶液的温度8. 埋在地下的钢管常用如图所示方法加以保护,使其免受腐蚀,下列说法不正确的是( ) A、金属棒的材料可能为镁 B、钢管附近土壤的pH增大 C、这种方法称为外加电流的阴极保护法 D、镀锌铁片的镀层破坏后铁皮仍耐腐蚀的原理与此相同9. 用下列仪器或装置(夹持装置略)进行实验,由实验现象不能得到相应结论的是( )
A、金属棒的材料可能为镁 B、钢管附近土壤的pH增大 C、这种方法称为外加电流的阴极保护法 D、镀锌铁片的镀层破坏后铁皮仍耐腐蚀的原理与此相同9. 用下列仪器或装置(夹持装置略)进行实验,由实验现象不能得到相应结论的是( )选项
A
B
C
D
实验及现象

热水中烧瓶内气体颜色变深

试管中出现白色沉淀

①中产生白色沉淀②中产生红褐色沉淀

Cu上无气泡,Fe上有气泡
结论
2NO2(g)N2O4(g)是放热反应
酸性:H2CO3>H2SiO3
溶解度:Mg(OH)2>Fe(OH)3
还原性:Fe>Cu
A、A B、B C、C D、D10. 如图是元素周期表前四周期的一部分,下列有关说法正确的是( )X
W
Y
R
Z
A、电负性:W>X B、第一电离能:W>Y C、五种元素形成的单质中,Z形成的单质沸点最高 D、R与其同主族下一周期元素的原子序数相差1811. 甲烷燃烧时的能量变化如下图,有关描述不正确的是( ) A、反应①和反应②均为放热反应 B、相同温度下,等物质的量的CO2(g)能量比CO(g)低 C、由图可以推得: D、反应②的热化学方程式:12. 下列有关说法正确的是( )A、所有非金属元素都分布在元素周期表的p区 B、构成原电池的两个电极不可采用相同的电极材料 C、第一电离能的大小可作为判断元素金属性强弱的依据 D、铜锌原电池放电一段时间后溶液温度升高,此时化学能同时转化为电能和热能13. 在一密闭容器中,反应 aA(气)bB(气)达平衡后,保持温度不变,把容器体积压缩到原来的一半且达到新平衡时,A的浓度是原来的1.5倍,则下列说法不正确的是( )A、平衡向正反应方向移动 B、物质A的转化率变小 C、物质B的质量分数增加了 D、a>b14. 某小组利用硫代硫酸钠溶液与稀硫酸反应: , 探究反应条件对速率的影响,下列有关说法正确的是( )
A、反应①和反应②均为放热反应 B、相同温度下,等物质的量的CO2(g)能量比CO(g)低 C、由图可以推得: D、反应②的热化学方程式:12. 下列有关说法正确的是( )A、所有非金属元素都分布在元素周期表的p区 B、构成原电池的两个电极不可采用相同的电极材料 C、第一电离能的大小可作为判断元素金属性强弱的依据 D、铜锌原电池放电一段时间后溶液温度升高,此时化学能同时转化为电能和热能13. 在一密闭容器中,反应 aA(气)bB(气)达平衡后,保持温度不变,把容器体积压缩到原来的一半且达到新平衡时,A的浓度是原来的1.5倍,则下列说法不正确的是( )A、平衡向正反应方向移动 B、物质A的转化率变小 C、物质B的质量分数增加了 D、a>b14. 某小组利用硫代硫酸钠溶液与稀硫酸反应: , 探究反应条件对速率的影响,下列有关说法正确的是( )选项
反应温度/℃
溶液
稀
V/mL
c/(mol/L)
V/mL
c/(mol/L)
V/mL
①
25
10
0.1
10
0.1
0
②
25
5
0.1
10
0.1
x
③
25
10
0.1
5
0.2
5
④
50
10
0.1
10
0.1
0
A、可通过产生浑浊的时间或单位时间内产生气体的体积判断反应的快慢 B、①④探究温度对速率的影响,实验时将溶液混合后置于相应温度的水浴中 C、①③两组实验可探究硫酸浓度对反应速率的影响 D、x=5,②③两组实验可探究浓度对反应速率的影响15. 下列有关说法不正确的是( )A、常温下,1mLpH=5的盐酸稀释至1L,c(H+)约为 B、往浅绿色的溶液中加入盐酸,可抑制水解,溶液绿色加深 C、常温下,溶液呈酸性,0.1mol/L醋酸铵溶液呈中性,说明醋酸是弱电解质 D、常温下,pH和体积均相同的盐酸和醋酸溶液,16. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )A、6.8g液态中含有0.05NA个阳离子 B、溶液中含有微粒数小于0.1NA C、电解精炼铜时,电路中通过NA个电子,阳极消耗32g铜 D、标况下,2.24L氯气溶于水中,所得溶液中17. 下列说法正确的是( )A、从(g)→(l)→(s),熵依次增加 B、可逆反应都有一定的限度,限度越大反应物的转化率一定越高 C、可逆反应,若总键能:反应物>生成物,则升高温度不利于提高反应物的转化率 D、对于气体反应,其他条件不变,增大压强反应速率加快,与活化分子的百分含量无关18. 下列离子方程式正确的是( )A、电解饱和食盐水: B、饱和溶液与固体反应: C、少量通入NaClO溶液 D、向氢氧化钡溶液中加入稀硫酸:19. 一定温度下,体系中,c(Ag+)和c(Cl-)的关系如图所示,下列说法正确的是( ) A、a、b、c三点对应的Ksp:a点>b点>c点 B、AgCl在c点的溶解度比b点的大 C、AgCl溶于水形成的饱和溶液中, D、b点的溶液中加入固体,沿曲线向c点方向变化20. 化学家正在研究尿素燃料电池,尿素燃料电池结构如图所示,用这种电池直接去除城市废水中的尿素,下列有关描述正确的是( )
A、a、b、c三点对应的Ksp:a点>b点>c点 B、AgCl在c点的溶解度比b点的大 C、AgCl溶于水形成的饱和溶液中, D、b点的溶液中加入固体,沿曲线向c点方向变化20. 化学家正在研究尿素燃料电池,尿素燃料电池结构如图所示,用这种电池直接去除城市废水中的尿素,下列有关描述正确的是( ) A、甲电极为电池的正极 B、乙电极的电极反应式为:O2+4e-+2H2O=4OH- C、电池工作时氢离子向甲电极移动 D、电池工作时,理论上净化1molCO(NH2)2消耗标准状况下33.6LO2浓度的废水21. 工业上用氨水作为沉淀剂去除酸性废水中的铅元素。除铅时,体系中含铅微粒的物质的量分数(d)与溶液pH的关系如图。[已知:Pb(OH)2难溶于水]
A、甲电极为电池的正极 B、乙电极的电极反应式为:O2+4e-+2H2O=4OH- C、电池工作时氢离子向甲电极移动 D、电池工作时,理论上净化1molCO(NH2)2消耗标准状况下33.6LO2浓度的废水21. 工业上用氨水作为沉淀剂去除酸性废水中的铅元素。除铅时,体系中含铅微粒的物质的量分数(d)与溶液pH的关系如图。[已知:Pb(OH)2难溶于水]
下列说法错误的是( )
A、氨水中: B、酸性废水中的含铅微粒有Pb2+、Pb(OH)+ C、 时,溶液中的离子有且仅有 和 D、 时,除铅效果最好22. 已知5mL0.01mol·L-1KI溶液与1mL0.01mol·L-1CuCl2溶液发生反应:2CuCl2(aq)+4KI(aq)2CuI(s)+I2(aq)+4KCl(aq),达到平衡,下列说法不正确的是( )A、该反应的平衡常数 B、往平衡体系中加入CuI固体,平衡不移动 C、分离出部分I2和原平衡状态比,正逆反应速率最终都减慢 D、静置,取上层清液加入NaOH溶液出现蓝色沉淀,表明该化学反应存在限度23. HCHO(g)与O2在羟基磷灰石(HAP)表面发生催化氧化生成CO2、H2O(g)的历程可能如图所示(E1、E2和E3分别表示各阶段物质的能量):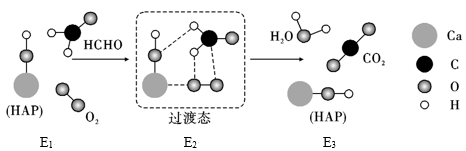
已知:HCHO(g)+O2(g)=CO2(g)+H2O(g)ΔH=-526.7kJ·mol-1
下列说法正确的是( )
A、E1>E2>E3 B、HAP能减小上述反应的焓变 C、HAP可使上述反应在较低的温度下迅速进行 D、若改通18O2 , 则反应可表示为HCHO+18O2=C18O2+H2O24. 常温时,用0.10mol·L-1NaOH溶液滴定25.00mL0.10mol·L-1某一元酸HX溶液,滴定过程中pH变化如图所示。下列说法正确的是( ) A、HX为强酸 B、在A点,c(X)>c(Na+)>c(H+)>c(OH-) C、在B点,两者恰好完全反应 D、在C点,c(X)+c(HX)=0.10mol·L-125. 已知:A(g)+2B(g)3C(g)ΔH<0,向一恒温恒容的密闭容器中充入1molA和3molB发生反应,t1时达到平衡状态Ⅰ,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是( )
A、HX为强酸 B、在A点,c(X)>c(Na+)>c(H+)>c(OH-) C、在B点,两者恰好完全反应 D、在C点,c(X)+c(HX)=0.10mol·L-125. 已知:A(g)+2B(g)3C(g)ΔH<0,向一恒温恒容的密闭容器中充入1molA和3molB发生反应,t1时达到平衡状态Ⅰ,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是( ) A、容器内压强不变,表明反应达到平衡 B、t2时改变的条件:向容器中加入C C、平衡时A的体积分数φ:φ(Ⅱ)=φ(Ⅰ) D、平衡常数K:K(II)<K(I)
A、容器内压强不变,表明反应达到平衡 B、t2时改变的条件:向容器中加入C C、平衡时A的体积分数φ:φ(Ⅱ)=φ(Ⅰ) D、平衡常数K:K(II)<K(I)二、填空题
-
26. 完成下列问题(1)、元素Mn与Fe的部分电离能数据如下表所示:
元素
Mn
Fe
电离能/(kJ/mol)
I1
717
759
I2
1509
1561
I3
3248
2957
根据表中数据可知,气态再失去1个电子比气态再失去1个电子难,对此,你的解释是。
(2)、已知18g葡萄糖固体在人体组织中被O2完全氧化为CO2气体和液态水,能产生280kJ热量。写出该反应的热化学方程式。三、综合题
-
27. 为探究固体化合物X(仅含四种元素)的组成和性质,某同学设计并完成如下实验。

请回答:
(1)、蓝色溶液中的金属阳离子是(填写化学式),该金属元素的基态原子价层电子排布式是。(2)、黑色化合物→砖红色化合物的化学方程式是。(3)、X的化学式是。28. 氯碱工业是高能耗产业,节能技术的研发是当前的重要课题。(1)、一种节能技术是将电解池与燃料电池相组合,相关物料传输与转化关系如下图所示,其中的电极未标出,所用的离子交换膜都只允许阳离子通过。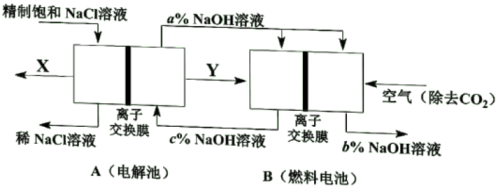
①当产生0.5molX时,A中通过离子交换膜的Na+有mol。
②写出燃料电池B中负极上的电极反应式。
③比较图中NaOH质量分数a%、b%、c%由大到小的顺序。
(2)、降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2 , 避免水电离的H+直接得电子生成H2 , 降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应式为。29. 以废锂电池正极材料(主要成分为和Al,含少量C、Fe单质)为原料可制备。已知:Co元素的常见化合价为+2、+3,钴酸锂()不溶于水。步骤Ⅰ:取一定量的废锂电池,加入适量的稀硫酸和30%的溶液,待固体充分溶解,过滤。
步骤Ⅱ:向滤液中滴加NaOH溶液,调节pH进行除杂,过滤。
步骤Ⅲ:向步骤Ⅱ的滤液中加入溶液,水浴加热至50℃左右,反应生成沉淀。
步骤Ⅳ:在纯氧中加热分解得到。
回答下列问题:
(1)、步骤Ⅰ为加快溶解速率,可采取的措施有、(任写两条)。(2)、步骤Ⅰ中在和作用下转化为可溶性硫酸盐和 , 该转化中体现了的性。(3)、已知步骤Ⅱ中Fe元素以形式存在于滤液中。若溶液中 , 欲使溶液中 , 的浓度均小于 , 需控制的pH范围为。已知:室温下, , , 。(4)、写出步骤Ⅲ反应的离子方程式。(5)、步骤Ⅳ加热升温过程中测得固体的质量变化如图所示。加热分解制备需要控制的温度范围为。已知 , , , 30. 当今研发二氧化碳利用技术降低空气中二氧化碳含量成了研究热点。(1)、Ⅰ.二氧化碳催化加氢制甲醇,有利于减少温室气体CO2 , 总反应可表示为:
30. 当今研发二氧化碳利用技术降低空气中二氧化碳含量成了研究热点。(1)、Ⅰ.二氧化碳催化加氢制甲醇,有利于减少温室气体CO2 , 总反应可表示为:该反应一般认为通过如下步骤来实现:
①
②
=kJ/mol。
(2)、一定条件下,向体积为1L的恒容密闭容器中通入1mol CO2和3molH2发生上述反应,达到平衡时,容器中为amol,CO为bmol,反应①的平衡常数为(用含a,b的代数式表示)。 (3)、总反应在Ⅰ、Ⅱ两种不同催化剂作用下建立平衡过程中,的转化率[]随时间(t)的变化曲线如图。活化能:过程Ⅰ过程Ⅱ(填“<”,“>”,“=”),t2时刻改变了某一反应条件,下列说法正确的是。
(3)、总反应在Ⅰ、Ⅱ两种不同催化剂作用下建立平衡过程中,的转化率[]随时间(t)的变化曲线如图。活化能:过程Ⅰ过程Ⅱ(填“<”,“>”,“=”),t2时刻改变了某一反应条件,下列说法正确的是。A.恒温恒压,t2时刻通入惰性气体
B.恒温恒容,t2时刻通入一定量氢气
C.n点的v(正)一定大于m点的v(逆)
D.t2时刻,可能是移走了一部分水蒸气
Ⅱ.二氧化碳也可用于尿素的制备:
(4)、一定条件下,向某恒容密闭容器中充入2mol和1mol , 6min时达到平衡,测得容器中尿素的物质的量为0.4mol,0-2min内尿素的物质的量随时间的变化趋势如图所示。若反应时间达到2min时,迅速将体系升温(仅发生上述反应),请在图中画出2-8min内容器中尿素的物质的量随时间的变化趋势曲线。 31. 二氧化氯(ClO2)是一种高效的饮用水消毒剂,易溶于水而不与水反应。(1)、某ClO2泡腾片的有效成分为NaClO2 , NaHSO4 , NaHCO3 , 其溶于水时,NaClO2和NaHSO4反应生成ClO2和Cl- , 并逸出大量气体,逸出气体的主要成分是(填化学式)。(2)、测定某水样中ClO浓度可采用氧化还原滴定法:量取25.00mL水样于碘量瓶中,加水稀释至50.00mL,加入过量KI,再滴入适量稀硫酸,充分反应后,滴加1mL淀粉溶液,用0.01000mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
31. 二氧化氯(ClO2)是一种高效的饮用水消毒剂,易溶于水而不与水反应。(1)、某ClO2泡腾片的有效成分为NaClO2 , NaHSO4 , NaHCO3 , 其溶于水时,NaClO2和NaHSO4反应生成ClO2和Cl- , 并逸出大量气体,逸出气体的主要成分是(填化学式)。(2)、测定某水样中ClO浓度可采用氧化还原滴定法:量取25.00mL水样于碘量瓶中,加水稀释至50.00mL,加入过量KI,再滴入适量稀硫酸,充分反应后,滴加1mL淀粉溶液,用0.01000mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。已知:ClO+4I−+4H+=2H2O+2I2+Cl− , I2+2S2O=2I−+S4O
①滴定终点的现象是:。
②下列关于滴定分析的操作,不正确的是。
A.用量筒量取25.00mL水样
B.滴定时要适当控制滴定速度
C.装标准溶液的滴定管,滴定前尖嘴处有气泡,滴定后气泡消失,造成测定结果偏低
D.终点读数时俯视滴定管液面,会造成测定结果偏低
E.再次滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
③计算水样中ClO的浓度
(3)、ClO2可用隔膜电解NaClO3制备,装置如图所示。制备时先在NaClO3溶液中通入少量ClO2气体,写出阴极上的电极反应式:。
-