山东省济南市2021-2022上学期高二上学期期末考试化学试题
试卷更新日期:2022-02-21 类型:期末考试
一、单选题
-
1. 从科技前沿到日常生活,化学无处不在。下列说法不正确的是( )A、我国首次在实验室实现了二氧化碳到淀粉的合成,生物酶催化剂的使用改变了反应历程 B、神舟十三号顺利升空时,火箭尾部喷射的气体呈红棕色是因为部分助燃剂转化为 C、水是21世纪最宝贵的资源之一,明矾与高铁酸钾均可作水处理剂,两者处理水的原理相同 D、2022年北京冬奥会将采用石墨烯材料制造户外保暖穿戴设备,石墨烯中碳原子为杂化2. 下列实验装置能达到目的的是( )
 A、直接蒸干溶液获取晶体 B、实验室简易制取少量 C、比较浓度对化学反应速率的影响 D、验证铁的吸氧腐蚀3. 已知某容器中存在反应, , 。下列说法不正确的是( )A、保持恒容,向容器中充入 , 各种物质的物质的量浓度均增大 B、保持恒温,增大压强,物质的量浓度减小 C、保持恒容,降低温度,气体的平均相对分子质量变大 D、当容器内颜色不再变化时,两反应均达到平衡状态4. 已知主族元素X、Y处于同周期,电负性 , 下列说法中一定不正确的是( )A、最高化合价: B、最简单气态氢化物的稳定性: C、含氧酸的酸性: D、X和Y形成的化合物中,X显负价,Y显正价5. 合成氨反应的反应历程和能量变化如图所示(*R表示微粒处于吸附状态)。下列说法不正确的是( )
A、直接蒸干溶液获取晶体 B、实验室简易制取少量 C、比较浓度对化学反应速率的影响 D、验证铁的吸氧腐蚀3. 已知某容器中存在反应, , 。下列说法不正确的是( )A、保持恒容,向容器中充入 , 各种物质的物质的量浓度均增大 B、保持恒温,增大压强,物质的量浓度减小 C、保持恒容,降低温度,气体的平均相对分子质量变大 D、当容器内颜色不再变化时,两反应均达到平衡状态4. 已知主族元素X、Y处于同周期,电负性 , 下列说法中一定不正确的是( )A、最高化合价: B、最简单气态氢化物的稳定性: C、含氧酸的酸性: D、X和Y形成的化合物中,X显负价,Y显正价5. 合成氨反应的反应历程和能量变化如图所示(*R表示微粒处于吸附状态)。下列说法不正确的是( ) A、 B、决定总反应速率的反应历程为 C、升高温度,该反应历程中基元反应的速率均加快 D、反应历程中的最低能垒(活化能)为6. 已知电离常数 , 下列反应的离子方程式正确的是( )A、向等物质的量浓度的NaOH和的混合溶液中滴加3倍体积的等浓度的稀盐酸 B、将少量的双氧水滴入酸性高锰酸钾溶液中: C、将少量通入“84”消毒液中: D、将少量氯气通入纯碱溶液中:7. 采用电催化氧化法可将污水中毒性较大的含氯有机物转化为低毒性物质,提高产物的可生物降解性。其原理如图所示。下列说法正确的是( )
A、 B、决定总反应速率的反应历程为 C、升高温度,该反应历程中基元反应的速率均加快 D、反应历程中的最低能垒(活化能)为6. 已知电离常数 , 下列反应的离子方程式正确的是( )A、向等物质的量浓度的NaOH和的混合溶液中滴加3倍体积的等浓度的稀盐酸 B、将少量的双氧水滴入酸性高锰酸钾溶液中: C、将少量通入“84”消毒液中: D、将少量氯气通入纯碱溶液中:7. 采用电催化氧化法可将污水中毒性较大的含氯有机物转化为低毒性物质,提高产物的可生物降解性。其原理如图所示。下列说法正确的是( ) A、装置中的离子交换膜为质子交换膜 B、电路中每通过2 mol电子,阳极可收集到 C、阴极电极反应: D、电解过程中阴极室的酸碱性保持不变8. 某酸性废水中含有大量的和少量 , 利用该废水为原料制备纳米级的流程如下:
A、装置中的离子交换膜为质子交换膜 B、电路中每通过2 mol电子,阳极可收集到 C、阴极电极反应: D、电解过程中阴极室的酸碱性保持不变8. 某酸性废水中含有大量的和少量 , 利用该废水为原料制备纳米级的流程如下:
下列说法不正确的是( )
A、通发生的反应: B、流程中可用替代 C、开始向滤液1中加入时,观察到有少量气泡产生,该气体为 D、中阴、阳离子的空间结构均为正四面体9. 下列有关电解质溶液的说法正确的是( )A、常温下的HA溶液与的BOH溶液等体积混合,溶液 , 则BOH为强碱 B、向某溶液中加入少量晶体,所得溶液中水解程度增大,pH增大 C、用同浓度的NaOH溶液分别中和等体积等pH的盐酸和醋酸溶液,盐酸消耗的NaOH溶液体积多 D、溶液与溶液等体积混合后存在:10. 短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子核外未成对电子数为3,基态Y原子核外s轨道的电子数与p轨道的电子数相同,Z元素在短周期中金属性最强,基态W原子核外最高能级含有5个电子。下列说法正确的是( )A、原子半径: B、化合物ZW中阴阳离子最外层均满足8电子稳定结构 C、基态原子的第一电离能: D、与分子的空间结构相同11. 根据下列实验操作和实验现象,得出相应实验结论不正确的是( )实验操作
实验现象
实验结论
A
向AgCl悬浊液中加入少量KI固体
沉淀由白色转化为黄色
B
向的溶液中加入足量铁粉,振荡,加1滴KSCN溶液
黄色逐渐消失,加KSCN溶液颜色不变
还原性:
C
测定饱和溶液与饱和溶液的pH
后者pH更大
的水解程度小于
D
向滴有酚酞的溶液中加入少量固体
生成白色沉淀,且红色逐渐变浅
溶液中存在水解平衡
A、A B、B C、C D、D12. 向某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图甲所示[阶段c(B)未画出]。图乙为改变条件平衡体系中化学反应速率随时间变化的情况,、、、时刻均改变一种条件,且改变的条件均不同。已知时刻为使用催化剂。下列说法正确的是( ) A、B的起始物质的量为0.02 mol B、若s,生成物C在段的化学反应速率为 C、时刻改变的条件可能为降温 D、时刻改变的条件可能为充入0.1 mol B
A、B的起始物质的量为0.02 mol B、若s,生成物C在段的化学反应速率为 C、时刻改变的条件可能为降温 D、时刻改变的条件可能为充入0.1 mol B二、多选题
-
13. 刀片式(简称LFP)电池的使用大幅降低了高端全电动汽车的成本。下列说法不正确的是( )A、基态P原子核外未成对电子数为5 B、基态Li原子核外电子的空间运动状态为球形 C、基态的价层电子排布式为 D、基态O原子核外电子空间运动状态有5种14. 钠离子电池成本优势明显,有望在大规模储能中取代传统铅酸电池。下图为一种钠离子电池放电的示意图,关于该电池说法不正确的是( )
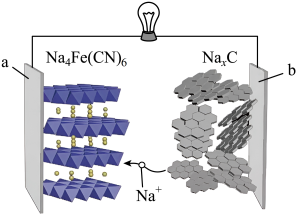 A、b为电池的负极 B、放电时b极反应: C、充电时a极反应: D、用该电池给铅酸电池充电时,b电极接铅酸电池的正极15. 常温下,将NaOH溶液滴加到某二元弱酸溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列说法正确的是( )
A、b为电池的负极 B、放电时b极反应: C、充电时a极反应: D、用该电池给铅酸电池充电时,b电极接铅酸电池的正极15. 常温下,将NaOH溶液滴加到某二元弱酸溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列说法正确的是( ) A、NaHX溶液中 B、当时, C、水的电离程度:上的点大于上的点 D、a点溶液中的数量级为
A、NaHX溶液中 B、当时, C、水的电离程度:上的点大于上的点 D、a点溶液中的数量级为三、综合题
-
16. 在29种生命必需的元素中,按体内含量的高低可分为常量元素(如:氧、碳、氢、氮、磷等)和微量元素(如:钒、锰、钴等),回答下列问题:(1)、胞嘧啶(
 )是核酸(DNA和RNA)中的主要碱基组成成分之一。该分子中所有元素的电负性由小到大的顺序为(填元素符号)。基态N原子核外电子的运动状态有种,1 mol
)是核酸(DNA和RNA)中的主要碱基组成成分之一。该分子中所有元素的电负性由小到大的顺序为(填元素符号)。基态N原子核外电子的运动状态有种,1 mol 中含有键的数目为mol。 (2)、与分子结构相似,键角(填“>”“<”或“=”),其原因为。(3)、锰在人体代谢、骨骼的形成和维生素C的合成过程中必不可少;钴是维生素B12组成部分;钒能降低血液中胆固醇的含量,还具有胰岛素的作用。基态Co原子核外电子排布式为 , 基态价电子排布式为 , 的空间结构为。17. 酸碱滴定法与氧化还原滴定法均为重要的定量分析法,应用广泛。回答下列问题:(1)、Ⅰ.酸碱中和滴定
中含有键的数目为mol。 (2)、与分子结构相似,键角(填“>”“<”或“=”),其原因为。(3)、锰在人体代谢、骨骼的形成和维生素C的合成过程中必不可少;钴是维生素B12组成部分;钒能降低血液中胆固醇的含量,还具有胰岛素的作用。基态Co原子核外电子排布式为 , 基态价电子排布式为 , 的空间结构为。17. 酸碱滴定法与氧化还原滴定法均为重要的定量分析法,应用广泛。回答下列问题:(1)、Ⅰ.酸碱中和滴定选择酚酞作指示剂,用标准NaOH溶液测定白醋中醋酸的浓度,以检测白醋是否符合国家标准。测定过程如图所示:

已知:国家标准规定酿造白醋中醋酸含量不得低于。
①滴定达到终点时的现象是滴入半滴标准NaOH溶液后。
②某次实验滴定开始和结束时。碱式滴定管中的液面如图所示,则消耗NaOH溶液的体积为mL。

③已知实验所用标准NaOH溶液的浓度为 , 根据上述滴定结果可知该白醋(填“符合”或“不符合”)国家标准。
④下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是(填编号)。
A.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定过程中摇动锥形瓶时有液滴溅出
D.读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数
E.碱式滴定管在滴定前有气泡,滴定后气泡消失
(2)、若用溶液分别滴定体积均为20.00 mL、浓度均为的盐酸和醋酸溶液,得到滴定过程中pH随加入NaOH溶液体积而变化的两条滴定曲线如图所示。
①滴定醋酸的曲线是(填“Ⅰ”或“Ⅱ”)。
②和的关系: (填“>”“=”或“<”)。
③若25℃时,的醋酸与的氢氧化钠溶液等体积混合量中性,则醋酸的电离常数为(用含a的代数式表示)。
(3)、Ⅱ.氧化还原滴定的纯度(杂质不参与反应)通常利用“间接碘量法”测定。已知: 。步骤如下:
①称取1.250 g胆矾产品配成100 mL溶液;
②取其中25.00 mL溶液,滴加KI溶液至不再产生沉淀;
③用标准溶液滴定,平行滴定3次。
若标准溶液的平均用量为10.00 mL,则胆矾产品纯度为%。
18. 氢气是一种重要的工业气体,可用于合成二甲醚()、氨气等。回答下列问题:(1)、工业上用和反应合成甲醚: 在催化剂存在的恒容密闭容器里,保持、初始加入量不变,测得在不同温度下,反应相同的时间,容器内的物质的量与温度的关系如图1所示。
①氢气的物质的量在温度高于800后增大的可能原因是、。
②“直接二甲醚()燃料电池”被称为绿色电源,其工作原理如图2所示,正极为电极(填“A”或“B”),写出A电极的电极反应式:。
(2)、工业上常用氨水吸收二氧化硫,可生成。判断常温下溶液呈性(填“酸”或“碱”),判断依据是。(已知:的;的;)(3)、一定条件下,与可合成尿素:。某温度下,在容积为1 L的恒容密闭容器中,按不同氨碳比加入总量为3 mol的和混合气体发生反应。反应达到平衡时有关量随氨碳比的变化曲线如图3所示。其中,曲线c表示尿素在平衡体系中的体积百分比。
①表示转化率的曲线是(填“a”或“b”);
②M点对应的百分比为%(保留三位有效数字)。
19. 研究 , , 等气体的无害化处理对治理大气污染、建设生态文明具有重要意义。已知,① , 反应体系中每摩尔气态物质分解为气态基态原子消耗的能量如下表所示:
CO
NO
812 kJ
1076 kJ
1490 kJ
632 kJ
②
③
(1)、试写出NO与CO反应生成无污染物气体的热化学方程式。(2)、将与按体积比1∶1充入恒容密闭容器中发生反应:①保持恒温,下列能说明反应达到平衡状态的是(填标号)。
a.体系压强保持不变 b.混合气体密度保持不变
c.和NO的体积比保持不变 d.每消耗的同时生成
②℃、℃时,物质的分压变化如图所示。根据题意可知:(填“>”“<”或“=”),由平衡状态a到b,改变的条件是。
 (3)、与CO在一定条件下的反应为: , 某温度下,在1 L密闭容器中充入和 , 此时容器的压强为p,5秒时反应达到平衡,容器的压强减小。回答下列问题:
(3)、与CO在一定条件下的反应为: , 某温度下,在1 L密闭容器中充入和 , 此时容器的压强为p,5秒时反应达到平衡,容器的压强减小。回答下列问题:①反应开始到平衡时CO的平均反应速率;(用含p的代数式表示,已知:某气体的分压=总压×该气体的物质的量分数)
②若此温度下,某时刻测得、、、的浓度分别为、、、 , 要使反应向逆反应方向进行,a的取值范围是。
20.(1)、Ⅰ.双极膜(BP)是一种能将水分子解离为和的特殊离子交换膜。应用双极膜制取聚合硫酸铁净水剂(简称PFS)的电化学装置如图所示。
回答下列问题:
图中装置的能量转化形式为 , a、b均为石墨电极,b极的电极反应式为。
(2)、M为(填“阴离子”或“阳离子”)交换膜,图中甲是(填“”或“”)(3)、电流过大,会使PFS产品的纯度降低,原因可能是。(4)、Ⅱ.某化工厂用石灰乳—PFS法处理含砷废水的工艺流程如图所示:
已知:
a.常温下,难溶物、的均大于的 , 可溶;
b.常温下,溶液中含砷微粒的分布分数与pH的关系如图。

回答下列问题:
下列说法不正确的是(填序号)。
a.溶液的
b.的为
c.溶液中,
(5)、“一级沉降”中,石灰乳的作用是。(6)、“二级沉降”中,溶液的pH在8~10之间,PFS形成的胶体粒子可以通过沉淀反应进一步减少溶液中的As含量。该沉淀反应的离子方程式为。