湖南省长沙市雅礼教育集团2021-2022学年高二上学期期末考试化学试题
试卷更新日期:2022-02-21 类型:期末考试
一、单选题
-
1. 化学知识和技术发展离不开伟大化学家。下列人物与其贡献不匹配的是( )A、侯德榜——工业制备烧碱 B、勒夏特列——化学平衡的移动 C、李比希——元素定量分析 D、盖斯——反应热的计算2. 下列电解质在水溶液中的电离方程式书写正确的是( )A、 B、 C、 D、3. 属于氧化还原反应且反应过程中能量变化符合如图所示的是( )
 A、 B、 C、 D、4. 在恒温、恒容条件下,以下措施中一定能够使可逆反应:的正反应速率增大的是( )A、减小C或D的浓度 B、通入无关气体导致压强增大 C、增大A或B的浓度 D、减小A或B的浓度5. 研究表明,在等温、等压及除了体积功以外不做其他功的条件下,化学反应的方向可以用反应的焓变和熵变来综合判断,判据为ΔH-TΔS。任何温度下都能正向自发进行的一项是( )A、CH4(g) = C(s) +2H2(g) ΔH=+74.8 kJ·mol-1 ΔS=+80.7 J·mol-1·K-1 B、C2H2(g)+3H2(g)= 2CH4(g) ΔH=-376.4 kJ·mol-1 ΔS=-220.2J·mol-1·K-1 C、2CO(g)=2C(s,石墨)+O2(g) ΔH=+221.0 kJ·mol-1 ΔS=-178.8J·mol-1·K-1 D、2KClO3(s)=2KCl(s)+3O2(g) ΔH=-78.0 kJ·mol-1 ΔS=+494.4J·mol-1·K-16. 温度为T时,将(s)置于抽成真空的容器中,当达到平衡时,测得体系总压强为6kpa,则此条件下该反应的平衡常数Kp为( )A、6 B、9 C、12 D、367. 下列实验操作或数据记录正确的是( )
A、 B、 C、 D、4. 在恒温、恒容条件下,以下措施中一定能够使可逆反应:的正反应速率增大的是( )A、减小C或D的浓度 B、通入无关气体导致压强增大 C、增大A或B的浓度 D、减小A或B的浓度5. 研究表明,在等温、等压及除了体积功以外不做其他功的条件下,化学反应的方向可以用反应的焓变和熵变来综合判断,判据为ΔH-TΔS。任何温度下都能正向自发进行的一项是( )A、CH4(g) = C(s) +2H2(g) ΔH=+74.8 kJ·mol-1 ΔS=+80.7 J·mol-1·K-1 B、C2H2(g)+3H2(g)= 2CH4(g) ΔH=-376.4 kJ·mol-1 ΔS=-220.2J·mol-1·K-1 C、2CO(g)=2C(s,石墨)+O2(g) ΔH=+221.0 kJ·mol-1 ΔS=-178.8J·mol-1·K-1 D、2KClO3(s)=2KCl(s)+3O2(g) ΔH=-78.0 kJ·mol-1 ΔS=+494.4J·mol-1·K-16. 温度为T时,将(s)置于抽成真空的容器中,当达到平衡时,测得体系总压强为6kpa,则此条件下该反应的平衡常数Kp为( )A、6 B、9 C、12 D、367. 下列实验操作或数据记录正确的是( )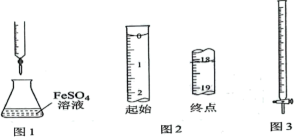 A、用图1装置进行溶液滴定未知浓度溶液 B、若起始液面如图2所示,则记录滴定终点读数为19.90mL C、在进行中和滴定时,选用图3滴定管盛装NaOH标准溶液 D、选用图3滴定管量取20.50mL未知浓度的溶液8. 下表是几种弱酸常温下的电离平衡常数:
A、用图1装置进行溶液滴定未知浓度溶液 B、若起始液面如图2所示,则记录滴定终点读数为19.90mL C、在进行中和滴定时,选用图3滴定管盛装NaOH标准溶液 D、选用图3滴定管量取20.50mL未知浓度的溶液8. 下表是几种弱酸常温下的电离平衡常数:1.8×10-5
K1=4.3×10-7
K2=5.6×10-11
K1=9.1×10-8
K2=1.1×10-12
K1=7.5×10-3
K2=6.2×10-8
K3=2.2×10-13
则下列说法中不正确的是( )
A、碳酸的酸性强于氢硫酸 B、多元弱酸的酸性主要由第一步电离决定 C、常温下,加水稀释醋酸,溶液中所有离子浓度都减小 D、向弱酸溶液中加少量NaOH溶液,电离平衡常数不变9. 点蚀又称为孔蚀,是一种集中于金属表面很小的范围并深入到金属内部的腐蚀形态。某铁合金钝化膜破损后的孔蚀如图,则下列说法正确的是( )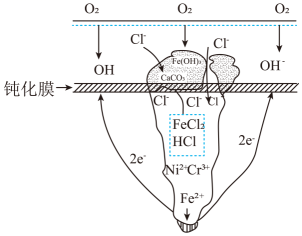 A、为防止孔蚀发生可以将外接电源正极与金属相连 B、蚀孔外每吸收2.24L , 则此时HCl可以氧化0.2mol Fe C、在腐蚀的过程中钝化膜作为负极 D、依题孔隙中局部可能发生析氢腐蚀10. 下列有关的说法中,其中正确的是( )
A、为防止孔蚀发生可以将外接电源正极与金属相连 B、蚀孔外每吸收2.24L , 则此时HCl可以氧化0.2mol Fe C、在腐蚀的过程中钝化膜作为负极 D、依题孔隙中局部可能发生析氢腐蚀10. 下列有关的说法中,其中正确的是( ) A、在氯酸钾加热分解的反应中,当其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率~时间图像可用图一表示 B、若在恒压容器中发生反应: , 达到平衡后再充入适量He,其反应速率~时间图像可用图二表示 C、 , 在加热升温的条件下平衡向逆反应方向移动的主要原因是该反应为放热反应,加热温度升高时导致正反应速率减慢、而逆反应速率加快 D、对于可逆反应 , 当其他条件相同时,若增加单质碳(C)的量可使平衡一定正向移动11. 已知一种生产聚苯乙烯的工业流程如下所示:
A、在氯酸钾加热分解的反应中,当其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率~时间图像可用图一表示 B、若在恒压容器中发生反应: , 达到平衡后再充入适量He,其反应速率~时间图像可用图二表示 C、 , 在加热升温的条件下平衡向逆反应方向移动的主要原因是该反应为放热反应,加热温度升高时导致正反应速率减慢、而逆反应速率加快 D、对于可逆反应 , 当其他条件相同时,若增加单质碳(C)的量可使平衡一定正向移动11. 已知一种生产聚苯乙烯的工业流程如下所示: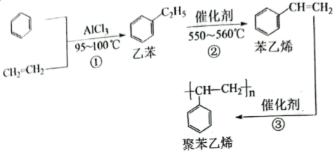
则下列有关的叙述正确的是( )
A、反应①属于取代反应 B、1mol苯乙烯最多可与5mol 发生加成反应 C、鉴别苯与苯乙烯可采用酸性溶液或溴水 D、聚苯乙烯分子中所有原子可能都处于同一平面内12. 电有机合成反应温和高效,体系简单,环境友好。若电解合成1,2-二氯乙烷的实验装置如下图所示,则下列说法中不正确的是( ) A、该装置工作时,NaCl溶液的浓度不断减小 B、液相反应中,和CuCl不断被消耗,故需定期补充 C、依题可知离子交换膜y应为阳离子膜,其可允许通过 D、该装置总反应为
A、该装置工作时,NaCl溶液的浓度不断减小 B、液相反应中,和CuCl不断被消耗,故需定期补充 C、依题可知离子交换膜y应为阳离子膜,其可允许通过 D、该装置总反应为二、多选题
-
13. 某有机物结构如图所示,关于该物质的下列说法正确的是( )
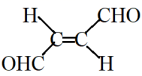 A、该物质可使酸性高锰酸钾溶液褪色 B、该物质可发生加聚反应 C、该物质的分子式为C4H6O2 D、该物质不存在顺反异构14. 常温下,二元弱酸溶液中含磷元素粒子的浓度之和为0.1 , 溶液中各含磷粒子的pc-pOH关系如图所示。图中pc表示各含磷粒子的浓度负对数(),pOH表示OH的浓度的负对数[]。下列有关说法不正确的是( )
A、该物质可使酸性高锰酸钾溶液褪色 B、该物质可发生加聚反应 C、该物质的分子式为C4H6O2 D、该物质不存在顺反异构14. 常温下,二元弱酸溶液中含磷元素粒子的浓度之和为0.1 , 溶液中各含磷粒子的pc-pOH关系如图所示。图中pc表示各含磷粒子的浓度负对数(),pOH表示OH的浓度的负对数[]。下列有关说法不正确的是( )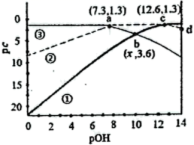 A、为酸式盐 B、b点时, C、曲线③表示pc()随pOH的变化 D、d点溶液中:
A、为酸式盐 B、b点时, C、曲线③表示pc()随pOH的变化 D、d点溶液中:三、填空题
-
15. 青蒿素是我国科学家从传统中药中发现的能够治疗疟疾的有机化合物,其分子结构如图所示,它可以用某有机溶剂X从中药中提取。
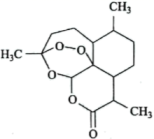 (1)、下列关于青蒿素的说法不正确的是(填字母)。
(1)、下列关于青蒿素的说法不正确的是(填字母)。a.属于芳香族化合物 b.分子中含有酯基和醚键
c.其易溶于有机溶剂X,不易溶于水 d.其分子的空间结构不是平面形结构
(2)、从中药中提取青蒿素需要应用柱色谱等提纯分离方法,下图所示是中学化学中常用的混合物分离和提纯的装置,请根据装置A、B、C、D回答下列问题: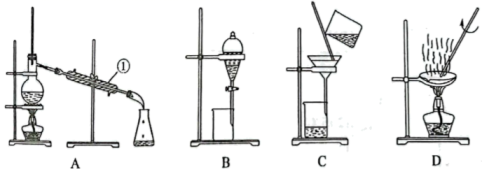
a.装置A中①的名称是。
b.从硫酸钡和硫酸钠的混合体系中分离出硫酸钡,可选择上述装置(填字母)。
c.碘水中提取碘单质可选用以下哪种试剂(填序号)。
①酒精 ②苯 ③乙酸 ④四氯化碳
(3)、使用现代分析仪器对有机化合物X的分子结构进行测定,得到相关结果如下:①根据图1,可确定X的相对分子质量为74。

②根据图2,推测X可能所属的有机化合物类别和其分子式分别为、。

③根据以上结果和图3(两个峰且面积比为2:3),推测X的结构简式。
 16. 请按要求回答下列问题:(1)、
16. 请按要求回答下列问题:(1)、 系统命名为;已知手性碳原子是指与四个各不相同原子或基团相连的碳原子,则上述物质中含有的手性碳原子个数为。 (2)、A的化学式为 , 已知A只有一种化学环境的氢原子;则A的结构简式为。(3)、某烃的分子式为 , 其能使酸性高锰酸钾溶液褪色,写出该物质生成高分子化合物的反应方程式 , 此反应类型为。(4)、1,3-丁二烯与一定量溴水发生加成反应可能生成的产物有种(不考虑立体异构),请任写出其中一种的结构简式。17. 实验室用酸碱中和滴定法测定某市售白醋中醋酸的浓度。回答下列问题:(1)、量取待测白醋溶液20.00mL于中,滴加2滴酚酞作指示剂;将0.1000mol/LNaOH溶液盛装于碱式滴定管中,调至“0”刻度并进行滴定;当出现现象时,停止滴定,并记录NaOH溶液的最终读数。(2)、在完成上述第1次滴定后,重复滴定3次.记录数据如下:
系统命名为;已知手性碳原子是指与四个各不相同原子或基团相连的碳原子,则上述物质中含有的手性碳原子个数为。 (2)、A的化学式为 , 已知A只有一种化学环境的氢原子;则A的结构简式为。(3)、某烃的分子式为 , 其能使酸性高锰酸钾溶液褪色,写出该物质生成高分子化合物的反应方程式 , 此反应类型为。(4)、1,3-丁二烯与一定量溴水发生加成反应可能生成的产物有种(不考虑立体异构),请任写出其中一种的结构简式。17. 实验室用酸碱中和滴定法测定某市售白醋中醋酸的浓度。回答下列问题:(1)、量取待测白醋溶液20.00mL于中,滴加2滴酚酞作指示剂;将0.1000mol/LNaOH溶液盛装于碱式滴定管中,调至“0”刻度并进行滴定;当出现现象时,停止滴定,并记录NaOH溶液的最终读数。(2)、在完成上述第1次滴定后,重复滴定3次.记录数据如下:实验数据(mL)/滴定次数
1
2
3
4
V(样品)
20.00
20.00
20.00
20.00
V[NaOH(aq)](消耗)
15.95
15.00
15.05
14.95
①计算得:c(CH3COOH)=mol•L-1。
②碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“无影响”)。
(3)、用0.1molNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。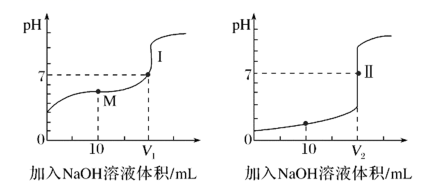
①滴定醋酸的曲线是(填“Ⅰ”或“Ⅱ”)。
②V1和V2的关系:V1V2(填“>”、“=”或“<”)。
③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是。
18. 钴酸锂电池的正极材料含有钴酸锂(LiCoO2)、铝箔及少量铁等,其通过如下图流程可回收铝、钴、锂。请回答下列问题: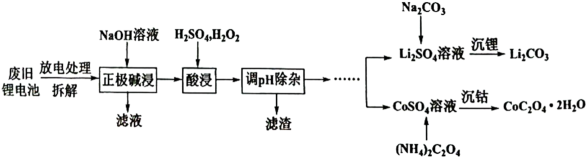 (1)、中Co的化合价为。(2)、钴酸锂电池放电总反应为: , 则其负极的电极反应式为。(3)、“酸浸”时Co、Li元素的浸出率随温度的变化如图所示:
(1)、中Co的化合价为。(2)、钴酸锂电池放电总反应为: , 则其负极的电极反应式为。(3)、“酸浸”时Co、Li元素的浸出率随温度的变化如图所示: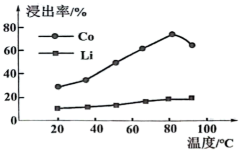
“酸浸”的适宜温度约为℃[所填数据限整数],若酸浸主要反应的化学方程式为: , 则上述反应过程中消耗的氧化剂与还原剂物质的量之比为。
(4)、“调pH除杂”的目的是使沉淀完全[即],则常温下应控制[保留到小数点后1位,另外已知常温时的为]。(5)、沉锂的离子反应方程式为。(6)、准确称取4.575g的样品,在空气中加热分解获取金属氧化物,固体样品的剩余质量随温度的变化如下图所示(已知385℃及以上残留固体均为金属氧化物),请写出B处物质与浓盐酸反应的化学方程式。