四川省成都市2021-2022学年高三上学期第一次诊断性检测理综化学试题
试卷更新日期:2022-02-21 类型:高考模拟
一、单选题
-
1. 化学与生产、生活息息相关。下列叙述不正确的是( )A、橱窗所用有机玻璃为高分子化合物 B、家庭装修用水性涂料代替油性涂料有利于健康 C、应用光伏发电可缓解温室效应及减少酸雨发生 D、用己烷萃取玉米胚芽中的油脂时发生了化学反应2. 某科学小组构想用锂元素的转化过程来持续合成氨,原理如图。设NA为阿伏加德罗常数的值,下列说法正确的是( )
 A、2g14N2和16O2的混合气体中含有质子数目为NA B、22.4LN2与过量锂反应断裂的N≡N键的数目为NA C、1molLi3N与过量水反应,收集的气态氨分子数目为NA D、0.1mol•L-1LiOH溶液中含有阴、阳离子总数为0.2NA3. 某有机合成中间体的结构简式如图所示。下列对该有机物的相关分析正确的是( )
A、2g14N2和16O2的混合气体中含有质子数目为NA B、22.4LN2与过量锂反应断裂的N≡N键的数目为NA C、1molLi3N与过量水反应,收集的气态氨分子数目为NA D、0.1mol•L-1LiOH溶液中含有阴、阳离子总数为0.2NA3. 某有机合成中间体的结构简式如图所示。下列对该有机物的相关分析正确的是( ) A、该有机物与
A、该有机物与 互为同系物
B、该有机物苯环上的一氯代物为8种
C、该有机物分子中所有碳原子可能共面
D、1mol该有机物最多与2molNaHCO3反应
4. X、Y、Z、W为原子序数依次增大的短周期主族元素。X的一种核素无中子;X与W的最外层电子数相同;Y、Z元素的单质均为空气的主要成分。下列说法不正确的是( )A、Y的简单离子半径较W的大 B、化合物W2Z与W2Z2的化学键类型完全相同 C、Z的简单气态氢化物较Y的稳定 D、X、Y、Z三种元素形成化合物的水溶液可能呈酸性或碱性5. 下列实验设计正确的是( )
互为同系物
B、该有机物苯环上的一氯代物为8种
C、该有机物分子中所有碳原子可能共面
D、1mol该有机物最多与2molNaHCO3反应
4. X、Y、Z、W为原子序数依次增大的短周期主族元素。X的一种核素无中子;X与W的最外层电子数相同;Y、Z元素的单质均为空气的主要成分。下列说法不正确的是( )A、Y的简单离子半径较W的大 B、化合物W2Z与W2Z2的化学键类型完全相同 C、Z的简单气态氢化物较Y的稳定 D、X、Y、Z三种元素形成化合物的水溶液可能呈酸性或碱性5. 下列实验设计正确的是( ) A、装置甲铝热反应 B、装置乙随关随停制氨 C、装置丁形成喷泉且充满烧瓶 D、装置丁比较醋酸与硼酸酸性6. 某化学小组为了探究原电池和电解池的基本原理,设计装置如图。下列相关分析不正确的是( )
A、装置甲铝热反应 B、装置乙随关随停制氨 C、装置丁形成喷泉且充满烧瓶 D、装置丁比较醋酸与硼酸酸性6. 某化学小组为了探究原电池和电解池的基本原理,设计装置如图。下列相关分析不正确的是( ) A、电池I工作时,石墨电极发生反应:Ag++e-=Ag B、电池I中Cu块取出前后灯泡亮度没有变化 C、电解池II工作时,电子从b端流向a端 D、电解池II工作一段时间后,b与石墨C2电极之间会产生蓝色沉淀7. X为一元弱酸,YOH为一元强碱。常温下,向难溶强电解质(YX)的悬浊液中加入某酸,测得c(Y+)与c(H+)的变化关系如图实线所示。下列说法不正确的是( )
A、电池I工作时,石墨电极发生反应:Ag++e-=Ag B、电池I中Cu块取出前后灯泡亮度没有变化 C、电解池II工作时,电子从b端流向a端 D、电解池II工作一段时间后,b与石墨C2电极之间会产生蓝色沉淀7. X为一元弱酸,YOH为一元强碱。常温下,向难溶强电解质(YX)的悬浊液中加入某酸,测得c(Y+)与c(H+)的变化关系如图实线所示。下列说法不正确的是( ) A、M点时,c(X-)<c(Y+) B、水的电离程度:N>P C、实验时可加入的酸为盐酸 D、难溶物XY的溶度积K为a22
A、M点时,c(X-)<c(Y+) B、水的电离程度:N>P C、实验时可加入的酸为盐酸 D、难溶物XY的溶度积K为a22二、综合题
-
8. 亚硫酰氯(SOCl2)是一种重要化工试剂,被广泛应用于结晶水合物的脱水和有机合成。工业上合成方法之一是:PCl5(s)+SO2(g)=POCl3(1)+SOCl2(1) ΔH=-101.4kJ·mol-1。已知相关物质的熔沸点及水解性如表:
物质
熔点/℃
沸点/℃
水解性
POCl3
1.2
105.5
易水解
SOCl2
-104.5
76
易水解
PCl5
160(升华)
167
易水解
某小组在实验室模拟工业制亚硫酰氯设计如图实验。

试回答下列问题:
(1)、A装置中发生反应的化学方程式为。(2)、B装置中盛装的a试剂为;C装置中X仪器的名称是。(3)、①反应过程中C装置的烧瓶要放在冰水浴中,原因是。②判断PCl5已与SO2完全反应的实验现象是。
(4)、反应结束后,从双颈烧瓶中的液体得到较纯净的亚硫酰氯需进行的操作是。(5)、①用SOCl2与MgCl2•6H2O混合加热可得无水MgCl2 , 其反应方程式为。②因常发生副反应,SOCl2不宜用于FeCl3•6H2O的脱水反应制取无水FeCl3。试设计实验证明两者混合加热时发生了副反应。
9. 黄钠铁矾[Na3Fe3(SO4)3(OH)6]被用于作净水剂。以高品质的硫铁矿(主要成分为FeS2 , 含少量SiO2)为原料制取黄钠铁矾,工艺流程如图: (1)、“盐浸”时的反应为FeS2+Fe2(SO4)3→FeSO4+S↓(未配平),其中氧化剂和还原剂的物质的量之比为;滤渣的主要成分为SiO2和。(2)、“氧化”时发生反应的离子方程式为;用空气代替NaClO进行该反应具有成本低等优点,但存在的缺点。(3)、“沉铁”过程,控制不同条件可以得到不同的沉淀,所得沉淀与温度、pH的关系如图所示(图中阴影部分表示黄钠铁矾稳定产生的区域)。
(1)、“盐浸”时的反应为FeS2+Fe2(SO4)3→FeSO4+S↓(未配平),其中氧化剂和还原剂的物质的量之比为;滤渣的主要成分为SiO2和。(2)、“氧化”时发生反应的离子方程式为;用空气代替NaClO进行该反应具有成本低等优点,但存在的缺点。(3)、“沉铁”过程,控制不同条件可以得到不同的沉淀,所得沉淀与温度、pH的关系如图所示(图中阴影部分表示黄钠铁矾稳定产生的区域)。
①80℃时,加入碳酸钠偏多时得到的黄钠铁矾中含有的杂质是。
②生成黄钠铁矾的离子反应方程式。
③由图在pH=2时,温度过高或过低,不易制得黄钠铁矾。试解释其原因。
(4)、测定黄钠铁矾样品中铁的质量分数:称取样品2.000g置于锥形瓶中,加入足量稀H2SO4溶解,滴入稍过量的KI溶液,待充分反应后,调节溶液近中性,滴入几滴淀粉溶液,用0.1500mol•L-1Na2S2O3溶液平行滴定,平均消耗20.00mL。(已知:I2+2S2O=2I-+S4O)①滴定终点的实验现象是。
②样品中铁的质量分数为。
10. 为了达到碳中和,研发二氧化碳的利用技术成为热点。(1)、用二氧化碳氧化乙烷制乙烯,其反应步骤如下:IC2H6(g)=C2H4(g)+H2(g) ΔH=+136kJ·mol-1
IICO2(g)=CO(g)+O2(g) ΔH=+283kJ·mol-1
III.H2(g)+O2(g)=H2O(l) ΔH=-285kJ·mol-1
该工艺总反应的热化学方程式为。
(2)、用二氧化碳和甲烷反应可以制工业合成气(CO、H2)。T℃,在1L的密闭容器中分别投入0.2molCO2和0.2molCH4 , 发生反应:CO2(g)+CH4(g)=2CO(g)+2H2(g),经5min达到平衡,测得生成CO为0.2mol,则:①0~5min内用H2表示的反应速率为。
②平衡时CH4的转化率为。
③保持体积不变,其他条件相同时,开始投入0.4molCO2和0.4molCH4 , 反应达到平衡后生成CO的物质的量0.4mol(填“>”、“<”或“=”)。
(3)、用二氧化碳与氢气催化加氢制乙醇,其反应原理为:2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g) ΔH<0。经实验测定在不同投料比x1、x2、x3时CO2的平衡转化率与温度的关系如图曲线所示[x=]:
①x1、x2、x3由大到小的顺序。
②从平衡角度分析,随温度升高,不同投料比时CO2的平衡转化率趋于相近的原因是。
③在x= , 温度为T,体积恒定的密闭容器中投入1molCO2时,初始压强为po , 经一段时间反应达到平衡,CO2的转化率为50%,列式表示该反应的压强平衡常数Kp=(用平衡分压代替平衡浓度计算,分压=总压x物质的量分数)。
(4)、用电解法可将CO2转化为多种原料,原理如图。若铜电极上只产生C2H4和CO气体,写出产生C2H4的电极反应式;电解后溶液pH(填“变大”、“变小”或“不变”)(忽略溶液体积的变化)。 11. 推广磷酸亚铁锂电池的新能源汽车对减少二氧化碳排放和大气污染具有重要意义。工业上用FeCl3、NH4H2PO4、LiCl及苯胺(
11. 推广磷酸亚铁锂电池的新能源汽车对减少二氧化碳排放和大气污染具有重要意义。工业上用FeCl3、NH4H2PO4、LiCl及苯胺(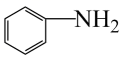 )为原料制磷酸亚铁锂材料。
)为原料制磷酸亚铁锂材料。回答下列问题:
(1)、基态铁原子核外电子运动状态有种;基态Fe3+较基态Fe2+稳定的原因是。(2)、在NH4H2PO4中的N、P、O三种元素的电负性由大到小的顺序是;NH的空间构型为;H2PO中P原子的杂化轨道类型为。(3)、1mol 中含有molσ键;苯胺水溶性大于苯的主要原因是。 (4)、构想某锂电池的负极材料晶体是锂原子嵌入石墨烯层间,晶体结构如图。
中含有molσ键;苯胺水溶性大于苯的主要原因是。 (4)、构想某锂电池的负极材料晶体是锂原子嵌入石墨烯层间,晶体结构如图。
①石墨的硬度小、熔沸点高的原因分别是。
②如图晶体的化学式为;该晶体中最近的两个碳原子核间距离为142pm,石墨烯层间距离为335pm,则该晶体的密度为g•cm-3(用NA表示阿伏加德罗常数,列式即可)。
12. 有机物M( )是一种合成镇痛药的主要成分。某小组设计如图的合成路线:
)是一种合成镇痛药的主要成分。某小组设计如图的合成路线:
已知:①RCNR—COOH
②RX+

 +HX(1)、B的化学名称;A→B的原子利用率为;M中含氧官能团的名称为。(2)、D的结构简式为。(3)、F→M的化学反应方程式为。(4)、
+HX(1)、B的化学名称;A→B的原子利用率为;M中含氧官能团的名称为。(2)、D的结构简式为。(3)、F→M的化学反应方程式为。(4)、 的同分异构体有多种,其中同时含有苯环结构和碳碳三键的结构有种,写出其同分异构体中满足核磁共振氢谱有四组峰,峰面积之比为1:2:2:2的结构简式。(写出一种即可) (5)、参照上述合成路线,设计以
的同分异构体有多种,其中同时含有苯环结构和碳碳三键的结构有种,写出其同分异构体中满足核磁共振氢谱有四组峰,峰面积之比为1:2:2:2的结构简式。(写出一种即可) (5)、参照上述合成路线,设计以 、CH3—CN、CH3CH2NH2为原料制备
、CH3—CN、CH3CH2NH2为原料制备 的合成路线(无机试剂任选)。
的合成路线(无机试剂任选)。