江苏省镇江市丹阳市2021-2022学年九年级上学期期末化学试题
试卷更新日期:2022-02-17 类型:期末考试
一、单选题
-
1. 下列属于纯净物的是( )A、葡萄酒 B、纯牛奶 C、蒸馏水 D、不锈钢2. 下列物质的用途主要与其化学性质有关的是( )A、用干冰进行人工降雨 B、用汽油作汽车的燃料 C、用石墨作电池的电极 D、用食盐作冬天融雪剂3. 下列化学用语正确的是( )A、镁离子——Mg+2 B、三个氮原子——3H C、水银——Hg D、氯酸钾——KCl4. 下列做法正确的是( )A、垃圾分类,资源再生 B、油锅起火,用水浇灭 C、煤气泄漏,开灯检查 D、焚烧秸秆,增肥环保5. 下列归类正确的是( )
选项
归类
内容
A
反应容器
试管、量筒、集气瓶
B
可燃气体
氢气、氧气、天然气
C
常见溶液
碘酒、液氮、食盐水
D
白色固体
氧化镁、碳酸氢铵、五氧化二磷
A、A B、B C、C D、D6. 下列有关“粗盐的初步提纯”的实验操作不符合规范要求的是( )A、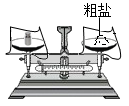 称量
B、
称量
B、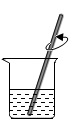 溶解
C、
溶解
C、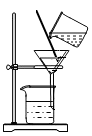 过滤
D、
过滤
D、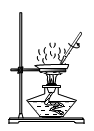 蒸发
7. 下列实验方法正确的是( )A、用量筒量取6.85mL蒸馏水 B、用水来区别CaCO3和NaCl两种固体 C、用明矾使硬水转化为软水 D、用铁丝代替红磷测定空气中氧气含量8. 下列排序正确的是( )A、铁元素质量分数: B、20℃物质的溶解性: C、利用金属的年代: D、氮元素的化合价:9. 下列指定反应的化学方程式正确的是( )A、实验室用双氧水制氧气: B、碳酸氢铵受热分解: C、铁丝和稀盐酸反应: D、电解饱和食盐水:10. 利用催化剂将甲转化为丙的微观示意图如下。下列说法不正确的是( )
蒸发
7. 下列实验方法正确的是( )A、用量筒量取6.85mL蒸馏水 B、用水来区别CaCO3和NaCl两种固体 C、用明矾使硬水转化为软水 D、用铁丝代替红磷测定空气中氧气含量8. 下列排序正确的是( )A、铁元素质量分数: B、20℃物质的溶解性: C、利用金属的年代: D、氮元素的化合价:9. 下列指定反应的化学方程式正确的是( )A、实验室用双氧水制氧气: B、碳酸氢铵受热分解: C、铁丝和稀盐酸反应: D、电解饱和食盐水:10. 利用催化剂将甲转化为丙的微观示意图如下。下列说法不正确的是( ) A、转化①是化合反应 B、转化②中乙和丁的分子个数比为1:1 C、甲和丙完全燃烧的产物相同 D、丙中碳、氢、氧元素质量比为3:1:411. 高铁酸钾(K2FeO4)是一种既能杀菌消毒,又能絮凝净水的水处理剂。高铁酸钾与水反应的化学方程式:。下列说法正确的是( )A、X的化学式为O3 B、高铁酸钾贮存和运输时要密封防潮 C、反应中有3种元素的化合价发生改变 D、高铁酸钾杀菌消毒未发生化学变化12. 利用如图装置进行燃烧条件的探究。试管①中充满氮气,试管②③中充满氧气,升温至40℃,仅观察到②中的白磷燃烧。下列叙述不正确的是( )
A、转化①是化合反应 B、转化②中乙和丁的分子个数比为1:1 C、甲和丙完全燃烧的产物相同 D、丙中碳、氢、氧元素质量比为3:1:411. 高铁酸钾(K2FeO4)是一种既能杀菌消毒,又能絮凝净水的水处理剂。高铁酸钾与水反应的化学方程式:。下列说法正确的是( )A、X的化学式为O3 B、高铁酸钾贮存和运输时要密封防潮 C、反应中有3种元素的化合价发生改变 D、高铁酸钾杀菌消毒未发生化学变化12. 利用如图装置进行燃烧条件的探究。试管①中充满氮气,试管②③中充满氧气,升温至40℃,仅观察到②中的白磷燃烧。下列叙述不正确的是( )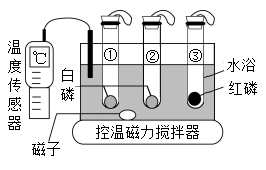 A、由实验①②可验证燃烧需要氧气 B、由实验②③可推知着火点高低:红磷>白磷 C、利用水浴控温可调节可燃物的着火点 D、①③两支试管内的白磷和红磷可回收再利用13. 下列物质的转化在给定条件下均能实现的是( )A、 B、 C、 D、14. 下列实验操作能达到实验目的的是( )
A、由实验①②可验证燃烧需要氧气 B、由实验②③可推知着火点高低:红磷>白磷 C、利用水浴控温可调节可燃物的着火点 D、①③两支试管内的白磷和红磷可回收再利用13. 下列物质的转化在给定条件下均能实现的是( )A、 B、 C、 D、14. 下列实验操作能达到实验目的的是( )选项
物质
目的
主要实验操作
A
CO2和N2
鉴别
分别通入紫色石蕊试液中,观察现象
B
CH4中是否混有H2
检验
点燃,在火焰上方罩干冷烧杯,观察现象
C
CaCl2溶液中混有盐酸
除杂
加入过量铁粉,充分反应后过滤
D
KNO3、NaCl混合固体
分离
溶解、过滤、洗涤、烘干、蒸发
A、A B、B C、C D、D15. 如图为一种烟气脱硫的流程。下列说法不正确的是( ) A、烟气脱硫能减少SO2对空气的污染 B、理论上,生产过程中需不断补充CaS C、脱硫塔中发生的主要反应为 D、流程中产生的CO2可作绿色植物的温室肥料,实现CO2“零排放”16. 下列说法正确的是( )A、H2O和H2O2组成元素相同,化学性质也一定相同 B、溶液中有晶体析出时,溶质质量减小,溶液质量也一定减小 C、置换反应生成单质和化合物,有单质和化合物生成的反应也一定是置换反应 D、20℃,称取5.0gCa(OH)2固体,加入95.0mL蒸馏水充分搅拌,得到5.0%的澄清石灰水17. T2℃时,将70.0gKNO3、KCl固体分别加入到各盛有200.0g水的两个烧杯中,完全溶解,降温到T1℃,现象如图1所示。下列说法正确的是( )
A、烟气脱硫能减少SO2对空气的污染 B、理论上,生产过程中需不断补充CaS C、脱硫塔中发生的主要反应为 D、流程中产生的CO2可作绿色植物的温室肥料,实现CO2“零排放”16. 下列说法正确的是( )A、H2O和H2O2组成元素相同,化学性质也一定相同 B、溶液中有晶体析出时,溶质质量减小,溶液质量也一定减小 C、置换反应生成单质和化合物,有单质和化合物生成的反应也一定是置换反应 D、20℃,称取5.0gCa(OH)2固体,加入95.0mL蒸馏水充分搅拌,得到5.0%的澄清石灰水17. T2℃时,将70.0gKNO3、KCl固体分别加入到各盛有200.0g水的两个烧杯中,完全溶解,降温到T1℃,现象如图1所示。下列说法正确的是( ) A、甲中加入的固体是KNO3 B、T1℃时,甲中溶液一定不饱和,乙中溶液一定饱和 C、T1℃时,将甲、乙中的物质混合,充分搅拌,一定有固体剩余 D、T2℃时,KCl溶液由a点转化到b点,可加入KCl或恒温蒸发水18. 烧杯中有铜锌合金粉末10.0g,向其中先后滴加FeSO4溶液和CuSO4溶液各50.0g,剩余固体的质量与滴加溶液质量关系如下图所示,(已知:)。下列说法正确的是( )
A、甲中加入的固体是KNO3 B、T1℃时,甲中溶液一定不饱和,乙中溶液一定饱和 C、T1℃时,将甲、乙中的物质混合,充分搅拌,一定有固体剩余 D、T2℃时,KCl溶液由a点转化到b点,可加入KCl或恒温蒸发水18. 烧杯中有铜锌合金粉末10.0g,向其中先后滴加FeSO4溶液和CuSO4溶液各50.0g,剩余固体的质量与滴加溶液质量关系如下图所示,(已知:)。下列说法正确的是( ) A、a点对应溶液中的溶质有两种 B、向b点固体中加入稀硫酸,冒气泡 C、m=9.9 D、该CuSO4溶液溶质的质量分数为16%19. 我国科学家屠呦呦因研制出青蒿素(C15H22O5)和双氢青蒿素(C15H24O5)而荣获诺贝尔奖。下列有关说法正确的是( )A、青蒿素和双青蒿素都属于氧化物 B、碳、氢、氧三种元素均为人体必须的微量元素 C、青蒿素和双氢青蒿素的分子构成一定不同 D、青蒿素和双氢青蒿素中碳、氧元素的质量比都是3:120. 有一包金属粉末,可能由Mg、Zn、Fe、Al、Ag等金属中的一种或几种组成。取该样品4.8g,加入100g稀硫酸恰好完全反应,只得到0.4gH2和无色溶液,下列说法正确的是( )A、样品中一定只含有Mg B、样品中一定不含有Fe,可能含有Ag C、稀硫酸的溶质质量分数为9.8% D、无色溶液中溶质总质量为24g
A、a点对应溶液中的溶质有两种 B、向b点固体中加入稀硫酸,冒气泡 C、m=9.9 D、该CuSO4溶液溶质的质量分数为16%19. 我国科学家屠呦呦因研制出青蒿素(C15H22O5)和双氢青蒿素(C15H24O5)而荣获诺贝尔奖。下列有关说法正确的是( )A、青蒿素和双青蒿素都属于氧化物 B、碳、氢、氧三种元素均为人体必须的微量元素 C、青蒿素和双氢青蒿素的分子构成一定不同 D、青蒿素和双氢青蒿素中碳、氧元素的质量比都是3:120. 有一包金属粉末,可能由Mg、Zn、Fe、Al、Ag等金属中的一种或几种组成。取该样品4.8g,加入100g稀硫酸恰好完全反应,只得到0.4gH2和无色溶液,下列说法正确的是( )A、样品中一定只含有Mg B、样品中一定不含有Fe,可能含有Ag C、稀硫酸的溶质质量分数为9.8% D、无色溶液中溶质总质量为24g二、填空题
-
21. 用化学符号表示:(1)、金刚石;(2)、最常用的溶剂;(3)、2个钠离子;(4)、人体缺少元素会导致甲状腺疾病。22. 选择下列适当的物质填空(选填序号):
A.活性炭 B.盐酸 C.石灰石 D.镁粉 E.洗洁精F.食盐G.硝酸铵H.武德合金
(1)、可用作制保险丝的是;(2)、生活中作乳化剂的是;(3)、溶于水温度降低的是;(4)、可除去冰箱异味的是;(5)、可用作制照明弹的是;(6)、可用于工业炼铁的是。23. 2021年10月16日,神舟十三号载人飞船成功发射,将3位宇航员送入中国天宫空间站。(1)、燃料舱内使用的燃料有偏二甲肼(C2H8N2)、液氢等,助燃剂为四氧化二氮(N2O4)、液氧等。①发射时C2H8N2)与N2O4剧烈反应,生成二氧化碳、水和一种常见的气体单质。
②用液氢、液氧作推进剂时,为使两者恰好完全反应,则加注液氢、液氧的质量比为(最简整数比)。
(2)、核心舱内配置了再生式生命保障系统,包括氧气制备、二氧化碳去除等子系统。①空间站中的氧气主要来自于电解水,在直流电源的(选填“正极”或“负极”)上产生氧气。
②宇航员呼出的二氧化碳用含氢氧化锂(LiOH)的过滤网吸收,生成碳酸锂(Li2CO3)和水,反应的化学方程式为。
(3)、飞船舱段建造使用铝合金、钛合金代替常规材料。①铝在空气中具有很好的抗腐蚀性能,原因是。
②常温下钛与稀硫酸不发生化学反应,则金属钛比金属铁的金属活动性(选填“弱”或“强”)。
24. 废旧电瓶车电池中含有LiMn2O4 , 为变废为宝,向其中加入稀H2SO4 , 并通入氧气,生成Li2SO4和一种黑色固体。将反应后的混合物过滤,在滤渣中加入双氧水,迅速产生大量气泡。(1)、在双氧水产生气泡时,滤渣的作用是。(2)、写出产生黑色固体的化学方程式(其中LiMn2O4与H2SO4的化学计量数之比为2:1)。三、综合题
-
25. 利用铁粉、炭粉、氯化钠进行铁的锈蚀实验,实验装置如下图所示。
 (1)、使用氯化钠溶液的目的是。(2)、十几分钟后打开止水夹可观察到的现象是。26. 请结合下图回答问题。
(1)、使用氯化钠溶液的目的是。(2)、十几分钟后打开止水夹可观察到的现象是。26. 请结合下图回答问题。 (1)、仪器名称:① , ②。(2)、用高锰酸钾制备并收集一瓶较纯净的氧气,选用的装置组合是(填字母),反应的化学方程式 , 可用D装置收集氧气的原因是。(3)、实验室制取H2的化学方程式为 , 装置C替代B装置作发生装置,其优点是。用G装置收集H2 , 气体应从(选填“m”或“n”)端通入。(4)、现用装置C制取CO2 , 反应的化学方程式为 , 在装置C中连接压强传感器(如图H)测定装置C内压强变化,图I记录压强随时间变化情况。图Ⅰ中c点对应的操作是(选填“关闭活塞”或“打开活塞”)。
(1)、仪器名称:① , ②。(2)、用高锰酸钾制备并收集一瓶较纯净的氧气,选用的装置组合是(填字母),反应的化学方程式 , 可用D装置收集氧气的原因是。(3)、实验室制取H2的化学方程式为 , 装置C替代B装置作发生装置,其优点是。用G装置收集H2 , 气体应从(选填“m”或“n”)端通入。(4)、现用装置C制取CO2 , 反应的化学方程式为 , 在装置C中连接压强传感器(如图H)测定装置C内压强变化,图I记录压强随时间变化情况。图Ⅰ中c点对应的操作是(选填“关闭活塞”或“打开活塞”)。 27. KClO3用于实验室制取氧气,工业制备KClO3的流程如图:
27. KClO3用于实验室制取氧气,工业制备KClO3的流程如图: (1)、过滤操作需使用的玻璃仪器有:烧杯、、玻璃棒。(2)、“干燥”时温度不宜过高的原因是。(3)、反应②为: , 向过滤后的滤液中滴加 , 充分搅拌,观察到产生泡沫少,且出现白色垢状物。(4)、洗涤KClO3固体时,为减少产品的损失,洗涤剂最好用(选填序号)。
(1)、过滤操作需使用的玻璃仪器有:烧杯、、玻璃棒。(2)、“干燥”时温度不宜过高的原因是。(3)、反应②为: , 向过滤后的滤液中滴加 , 充分搅拌,观察到产生泡沫少,且出现白色垢状物。(4)、洗涤KClO3固体时,为减少产品的损失,洗涤剂最好用(选填序号)。a、冰水 b、热水 c、KClO3饱和溶液
28. 在高温下,铁与水蒸气能发生反应生成一种常见的铁的氧化物和一种气体。资料:①无水氯化钙具有吸水性:
②常见铁的氧化物有关信息如表:
常见铁的氧化物
FeO
Fe2O3
Fe3O4
颜色、状态
黑色粉末
红棕色粉末
黑色粉末
能否被磁铁吸引
否
否
能
③四氧化三铁能与稀盐酸反应:。
(1)、Ⅰ、探究“铁与水蒸气”反应的气体产物【实验探究】取适量的铁粉与湿棉花(棉花的成分不参加反应)于反应装置A中。按下图所示进行实验,试管内放一团湿棉花的目的是;实验时棉花没有燃烧,其原因是;观察到C处管口有淡蓝色火焰,烧杯内壁有水雾。说明产生的气体是。
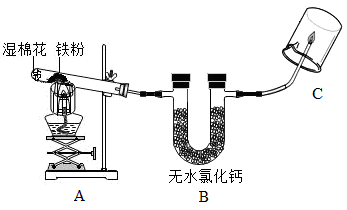 (2)、Ⅱ、探究“铁与水蒸气”反应后剩余固体的成分及含量
(2)、Ⅱ、探究“铁与水蒸气”反应后剩余固体的成分及含量【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引。
【猜想与假设】猜想1:剩余固体是;
猜想2:剩余固体是Fe和Fe3O4。
(3)、【实验验证】甲同学取样品于烧杯中,加入足量的稀盐酸,观察到(填实验现象),溶液由无色变为黄绿色,说明猜想2正确。(4)、【实验结论】铁和水蒸气反应的化学方程式为。(5)、【含量测定】乙同学取A装置中剩余黑色固体50g,与足量的CO反应后,所得固体质量为43.6g,则剩余黑色固体中Fe3O4的质量分数为。29. 现有一包固体粉末,可能含有CaCO3、NH4HCO3、NaOH、CuSO4、Fe粉、C中的一种或几种。进行如下实验:(1)、取少量固体样品加热,无氨味,则原固体中一定不含。(2)、另取固体样品溶于足量水,温度无明显变化;过滤,得到无色溶液和滤渣,则原固体中一定不含、。(3)、将(2)中滤渣洗涤烘干后,称取10g滤渣加入足量稀盐酸,有大量气泡产生,固体全部消失,则原固体中一定不含有;再将产生的气体通入足量澄清石灰水中,产生7.5g白色沉淀,则原固体中一定含有。30.(1)、(一)对古代金属制品的认识“三星堆遗址”出土了黄金面罩、象牙、青铜艺术品、残存的丝织品等重要文物,其中属于金属材料的有(选填序号)。
a、黄金面罩 b、象牙 c、青铜面具 d、丝织品
(2)、《吕氏春秋·别类篇》载有“金(铜)柔锡柔,合两柔则刚”,表明青铜的硬度比纯铜(选填“大”或“小”)。(3)、文物中的“黄金面罩”依然金光闪闪,而“青铜面具”则布满锈斑,由此现象可知金的化学性质比铜更(选填“活泼”或“不活泼”)。(4)、青铜面具出土时表面存在绿色锈蚀,原因是铜与空气中O2、H2O、CO2反应,在表面慢慢生成一层铜绿【Cu2(OH)2CO3】,写出反应的化学方程式。(5)、(二)古代金属铜的冶炼方法方法一:“火法炼铜”是将孔雀石【主要成分Cu2(OH)2CO3】与木炭一起加热,就得到红色的金属铜;
方法二:《淮南万毕术》中记载“曾青得铁则化为铜”,先用孔雀石制取硫酸铜,再用“湿法炼铜”获得铜。其流程如下:

方法一中涉及的反应方程式:;:
(6)、步骤①的反应方程式为 , 加入过量稀硫酸的目的是。(7)、步骤②中发生反应的化学方程式(任写一个),固体B的成分。(8)、与“火法炼铜”相比,“湿法炼铜”的优点有(至少答一条)。(9)、(三)某碱式碳酸铜的组成测定某碱式碳酸铜成分可表示为Cux(OH)Y(CO3)z,为探究其组成,用如图装置对样品27.1g进行热分解实验,观察到样品固体先变成黑色,然后部分出现红色。
资料:①浓硫酸具有吸水性,浓氢氧化钠溶液能充分吸收CO2。
②CuO加热会生成红色的Cu2O和O2。

装配好实验装置后,先要 , 再加入样品。
(10)、D装置中的实验现象是。(11)、停止加热后仍需继续通N2 , 可防止倒吸和。(12)、测得实验前后各装置的质量变化如下表。温度/℃
装置A
装置B
装置C
装置D
实验前/g
227.1
100.0
100.0
100.0
实验后/g
219.0
102.7
104.4
101.0
①该碱式碳酸铜的化学式为。
②最后装置A剩余固体中铜、氧元素质量比(最简整数比)。