江苏省扬州市仪征市2021-2022学年九年级上学期期末化学试题
试卷更新日期:2022-02-17 类型:期末考试
一、单选题
-
1. 我国宣布力争于2060年前实现“碳中和”,即二氧化碳的排放与吸收互相平衡(如图)。下列措施不利于实现碳中和的是( )
 A、大力植树造林 B、提倡使用一次性餐具 C、利用太阳能发电 D、倡导公共交通出行2. 华夏造物历史悠久,《天工开物》中记载的下列造物过程涉及化学变化的是( )A、炼生铁 B、晒海盐 C、钉木舟 D、织衣布3. 下列物质由离子构成的是( )A、氯化钠 B、汞 C、水 D、氧气4. “古丈毛尖”闻名全国。绿茶中含有丰富的硒,硒有防癌、抗癌作用,这里的“硒”指的是( )A、分子 B、原子 C、元素 D、离子5. 下列物质放入水中能形成溶液的是( )A、蔗糖 B、豆油 C、面粉 D、泥沙6. 加油站、面粉加工厂、煤矿矿井内必须张贴的图标是( )A、
A、大力植树造林 B、提倡使用一次性餐具 C、利用太阳能发电 D、倡导公共交通出行2. 华夏造物历史悠久,《天工开物》中记载的下列造物过程涉及化学变化的是( )A、炼生铁 B、晒海盐 C、钉木舟 D、织衣布3. 下列物质由离子构成的是( )A、氯化钠 B、汞 C、水 D、氧气4. “古丈毛尖”闻名全国。绿茶中含有丰富的硒,硒有防癌、抗癌作用,这里的“硒”指的是( )A、分子 B、原子 C、元素 D、离子5. 下列物质放入水中能形成溶液的是( )A、蔗糖 B、豆油 C、面粉 D、泥沙6. 加油站、面粉加工厂、煤矿矿井内必须张贴的图标是( )A、 B、
B、 C、
C、 D、
D、 7. 笋肉锅贴是扬州著名的小吃。制作过程必须用到铁板锅,这是利用了铁的( )A、导热性 B、延展性 C、导电性 D、抗腐蚀性8. 下列关于用微粒知识解释生活中现象的说法,不正确的是( )A、酒香不怕巷子深——微粒在不停运动 B、1滴水中含有1.67×1021个H2O分子——微粒是很小的 C、气体可以压缩——微粒大小可以改变 D、食盐溶液能导电——溶液中存在能自由移动的离子9. 下列有关生活常识的说法不正确的是( )A、家中油锅着火,可用锅盖盖灭 B、纯净水是天然饮品,不含任何化学物质 C、废旧电池应集中处理 D、铝易在空气中形成一层致密的氧化膜10. “矽”在1871年的《化学鉴原》最早出现,它的含量在地壳中占第二位。现代化学中“矽”元素名称和元素符号是( )A、氧O B、硅Si C、铝AI D、铁Fe11. 金属是一类重要的材料。下列有关金属的说法正确的是( )A、不锈钢是绝对不会生锈的铁合金 B、武德合金的熔点比其成分金属高 C、日常生活中,钢铁表面刷油漆可以防止生锈 D、“曾青得铁则化为铜”的原理是用铜置换出铁12. 叶酸(C19H19N7O6)有促进骨髓细胞成熟的作用,下列有关叶酸的说法不正确的是( )A、由4种元素组成 B、相对分子质量为(12×19+1×19+14×7+16×6) C、碳、氢2种原子的个数比为1:1 D、碳元素的质量分数计算式×100%13. 利用如图装置进行燃烧条件的探究。试管①中充满氮气,试管②③中充满氧气,升温至40℃,仅观察到②中的白磷燃烧。下列叙述不正确的是( )
7. 笋肉锅贴是扬州著名的小吃。制作过程必须用到铁板锅,这是利用了铁的( )A、导热性 B、延展性 C、导电性 D、抗腐蚀性8. 下列关于用微粒知识解释生活中现象的说法,不正确的是( )A、酒香不怕巷子深——微粒在不停运动 B、1滴水中含有1.67×1021个H2O分子——微粒是很小的 C、气体可以压缩——微粒大小可以改变 D、食盐溶液能导电——溶液中存在能自由移动的离子9. 下列有关生活常识的说法不正确的是( )A、家中油锅着火,可用锅盖盖灭 B、纯净水是天然饮品,不含任何化学物质 C、废旧电池应集中处理 D、铝易在空气中形成一层致密的氧化膜10. “矽”在1871年的《化学鉴原》最早出现,它的含量在地壳中占第二位。现代化学中“矽”元素名称和元素符号是( )A、氧O B、硅Si C、铝AI D、铁Fe11. 金属是一类重要的材料。下列有关金属的说法正确的是( )A、不锈钢是绝对不会生锈的铁合金 B、武德合金的熔点比其成分金属高 C、日常生活中,钢铁表面刷油漆可以防止生锈 D、“曾青得铁则化为铜”的原理是用铜置换出铁12. 叶酸(C19H19N7O6)有促进骨髓细胞成熟的作用,下列有关叶酸的说法不正确的是( )A、由4种元素组成 B、相对分子质量为(12×19+1×19+14×7+16×6) C、碳、氢2种原子的个数比为1:1 D、碳元素的质量分数计算式×100%13. 利用如图装置进行燃烧条件的探究。试管①中充满氮气,试管②③中充满氧气,升温至40℃,仅观察到②中的白磷燃烧。下列叙述不正确的是( ) A、由实验①②可验证燃烧需要氧气 B、由实验②③可推知着火点高低:红磷>白磷 C、图中小气球有密闭装置、缓冲气压等作用 D、利用水浴控温可改变可燃物的着火点14. NH3的合成开启了工业催化新纪元,为世界粮食增产做出了巨大贡献。以N2和H2为反应物的微观过程如下,下列说法不正确的是( )
A、由实验①②可验证燃烧需要氧气 B、由实验②③可推知着火点高低:红磷>白磷 C、图中小气球有密闭装置、缓冲气压等作用 D、利用水浴控温可改变可燃物的着火点14. NH3的合成开启了工业催化新纪元,为世界粮食增产做出了巨大贡献。以N2和H2为反应物的微观过程如下,下列说法不正确的是( ) A、化学变化中,分子可分,原子不可分 B、反应结束后催化剂的质量不变 C、参加反应的H2与N2质量比为1:14 D、该反应能体现化学可以造福人类15. 如图所示,向装有水的试管中加入某种固体物质后,U型管左侧液面上升,右侧液面下降。则加入的固体物质可能是()
A、化学变化中,分子可分,原子不可分 B、反应结束后催化剂的质量不变 C、参加反应的H2与N2质量比为1:14 D、该反应能体现化学可以造福人类15. 如图所示,向装有水的试管中加入某种固体物质后,U型管左侧液面上升,右侧液面下降。则加入的固体物质可能是() A、食盐 B、蔗糖 C、硝酸铵 D、氢氧化钠16. 物质的组成和结构决定性质,性质决定用途。下列叙述不正确的是( )A、洗洁精具有乳化作用,可以洗去油污 B、氧气具有可燃性,可以作为燃料 C、干冰升华吸热,可以用于人工降雨 D、金刚石硬度大,可以用于刻划玻璃17. NaCl和KNO3的溶解度曲线如图所示,下列说法正确的是( )
A、食盐 B、蔗糖 C、硝酸铵 D、氢氧化钠16. 物质的组成和结构决定性质,性质决定用途。下列叙述不正确的是( )A、洗洁精具有乳化作用,可以洗去油污 B、氧气具有可燃性,可以作为燃料 C、干冰升华吸热,可以用于人工降雨 D、金刚石硬度大,可以用于刻划玻璃17. NaCl和KNO3的溶解度曲线如图所示,下列说法正确的是( ) A、NaCl的溶解度一定大于KNO3 B、NaCl的溶解度受温度影响的程度比KNO3大 C、40℃时,100gKNO3饱和溶液中含有63.9gKNO3 D、将60℃时210gKNO3饱和溶液降温至20℃,析出KNO3晶体78.4g18. “配制100g溶质质量分数为5%的NaCl溶液”实验示意图如下,其中正确的是( )A、取用NaCl
A、NaCl的溶解度一定大于KNO3 B、NaCl的溶解度受温度影响的程度比KNO3大 C、40℃时,100gKNO3饱和溶液中含有63.9gKNO3 D、将60℃时210gKNO3饱和溶液降温至20℃,析出KNO3晶体78.4g18. “配制100g溶质质量分数为5%的NaCl溶液”实验示意图如下,其中正确的是( )A、取用NaCl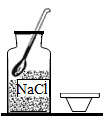 B、称取NaCl
B、称取NaCl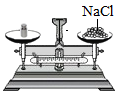 C、量取H2O
C、量取H2O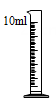 D、溶解NaCl
D、溶解NaCl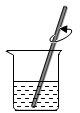 19. 下列实验操作不能达到实验目的的是( )
19. 下列实验操作不能达到实验目的的是( )实验目的
实验操作
A
将硬水转化为软水
煮沸
B
除去CO2中混有的少量CO
通入氧气,点燃混合气体
C
比较铜片和黄铜片(铜锌合金)的硬度
铜片和黄铜片相互刻画
D
除去N2中少量的O2
将混合气体通过灼热的铜网
A、A B、B C、C D、D20. 利用MnFe2O4热化学循环制氢的反应流程如图所示,下列说法正确的是( )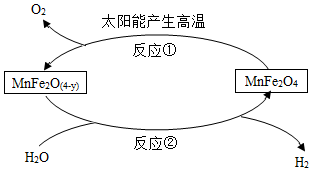 A、反应②属于置换反应 B、该反应过程中,需要不断添加MnFe2O4 C、理论上,每生成1.0gO2 , 就能得到2.0gH2 D、MnFe2O(4-y)中Fe元素的质量分数比MnFe2O4中Fe元素的质量分数大
A、反应②属于置换反应 B、该反应过程中,需要不断添加MnFe2O4 C、理论上,每生成1.0gO2 , 就能得到2.0gH2 D、MnFe2O(4-y)中Fe元素的质量分数比MnFe2O4中Fe元素的质量分数大二、综合题
-
21. 燃料在使用过程中的碳循环如下图:
 (1)、煤属于化石燃料,在使用前需将煤粉碎,这样做的目的是。(2)、空气是重要的资源。从液态空气中分离出N2是利用氮气和氧气的(填“密度”或“沸点”)不同:枣林湾生态园被誉为“天然氧吧”,园内空气中负氧离子()含量极高,写出负氧离子与钠离子结合形成的物质化学式:。(3)、绿色植物通过作用吸收CO2 , 空气中CO2含量增多会导致效应加剧。(4)、利用海水进行碳储存,可以缓解空气中CO2过多的问题。向海水中通入足量的CO2 , 大约有1%的CO2会和水反应,请写出涉及到的化学反应方程式:。CO2溶于水中可制成汽水,喝了冰镇汽水以后,常常会打嗝,这种现象说明气体的溶解度可能与有关。(5)、科学家采取“组合转化”技术,可将CO2转化为化工原料X,其反应的化学方程式: , 则X的化学式为。(6)、科学家利用CO2与水分解产生的H2在一定条件下合成甲醇(CH3OH)。
(1)、煤属于化石燃料,在使用前需将煤粉碎,这样做的目的是。(2)、空气是重要的资源。从液态空气中分离出N2是利用氮气和氧气的(填“密度”或“沸点”)不同:枣林湾生态园被誉为“天然氧吧”,园内空气中负氧离子()含量极高,写出负氧离子与钠离子结合形成的物质化学式:。(3)、绿色植物通过作用吸收CO2 , 空气中CO2含量增多会导致效应加剧。(4)、利用海水进行碳储存,可以缓解空气中CO2过多的问题。向海水中通入足量的CO2 , 大约有1%的CO2会和水反应,请写出涉及到的化学反应方程式:。CO2溶于水中可制成汽水,喝了冰镇汽水以后,常常会打嗝,这种现象说明气体的溶解度可能与有关。(5)、科学家采取“组合转化”技术,可将CO2转化为化工原料X,其反应的化学方程式: , 则X的化学式为。(6)、科学家利用CO2与水分解产生的H2在一定条件下合成甲醇(CH3OH)。
①科学家在常温下利用Pt等催化剂在光照下使水分解产生氢气,三种催化剂的催化效果如图1所示。催化效果最好的是(填序号)。
a、Pt催化剂 b、Ni催化剂 c、La催化剂
②CuO和ZnO的混合物可作为合成甲醇的催化剂,催化效果如图2所示。根据图2判断,混合催化剂中CuO的质量分数为%,催化效果最好。在其他条件不变的前提下,催化剂不单独选择CuO或ZnO的原因是。
三、综合题
-
22. “嫦娥五号”月球采样返回,“天问一号”成功抵达火星,“神舟十三号”成功发射标志着我国航天事业取得突破性进展。(1)、月壤含大量的SO2以及可作为核聚变燃料的氦-3等物质。
①SiO2中,硅元素的化合价为。
②下图为氦在元素周期表中的部分信息。

氦-3原子的质子数与中子数之和为3,则其中子数为、核外电子数为。氦-3原子和氦-4原子属于同一种元素,理由是。
(2)、火星低层大气的主要成分如下表。气体成分
CO2
N2
Ar
O2
其他
体积分数%
95.32
2.7
1.6
0.13
0.25
①相同条件下,火星大气密度(填“>”、“=”或“<”)空气密度。
②为鉴别一瓶模拟“火星低层大气”组成的气体和一瓶空气,可用来检验。
③若为满足人类未来在火星上生活,下列研究设想合理的是(填序号)。
a、将火星上的N2与O2反应生成水 b、寻找水的存在和开发水循环技术
(3)、长期驻留空间实验室会对航天员身体造成影响,航天饮食中必须含有足够的钙、铁等元素。缺钙会导致(填“贫血症”或“骨骼疏松”),铁元素属于人体必须的(填“常量元素”或“微量元素”)。宇航服中的废气处理系统保障着航天员的生命,让呼吸产生的废气进入装有活性炭的装置,这是利用了活性炭的性。23. 阅读下面科普短文,回答问题。古人认为,水是一种元素,不可再分。
1766年,英国科学家卡文迪许发现将金属锌加入到硫酸中,会产生一种无色的可燃性气体,他将这种气体叫做“可燃空气”。
同一时期,英国科学家普利斯特里,也在研究这种“可燃空气”,他发现这种气体密度只有空气的1/11,这种气体在玻璃容器燃烧,容器内壁会产生水雾。
1775年,法国科学家拉瓦锡通过实验验证空气是一种混合物,其中氧气约占1/5。
1781年,卡文迪许改进了原来的实验方案,他用纯净的氧气代替空气,发现“可燃空气”在纯氧中可以安静燃烧,生成物只有水,没有别的物质。
1782年,拉瓦锡将水蒸气通过高温金属铁管,获得了“可燃空气”和一种黑色固体由此他认为水不是一种元素,而是由“可燃空气”和氧结合形成的化合物。
1787年,拉瓦锡命名这种“可燃空气”为“氢气”,正式提出“氢”是一种元素。
1800年,英国科学家尼克尔森和卡里斯特尔用“伏打电池”在常温下进行了水的电解实验,获得成功,进一步证明了拉瓦锡的结论。
依据文章内容回答下列问题。
(1)、“可燃空气”的物理性质有(填写一种即可)。(2)、“可燃空气”属于(填“单质”或“化合物”)。(3)、1782年拉瓦锡实验产生的黑色固体是Fe3O4。该反应的化学反应方程式。(4)、1800年,在尼克尔森和卡里斯特尔电解水实验中,电源负极产生的气体是。实验室进行电解水实验,水中常加入稀硫酸的目的是 , 若配制10%的稀硫酸100g,需要98%的浓硫酸(密度为1.84g/mL)体积为mL(答案保留一位小数),量取浓硫酸时仰视读数,则所配得的稀硫酸溶质质量分数10%(填“>”、“=”或“<”)。(5)、根据已有知识分析上述史实,你认为可以证明水的组成的实验有(填序号)。a、普利斯特里气体燃烧实验 b、1781年卡文迪许实验
c、1782年拉瓦锡实验 d、1800年尼克尔森和卡里斯特尔实验
24. 下图是实验室常用气体制备或收集装置,请回答下列问题。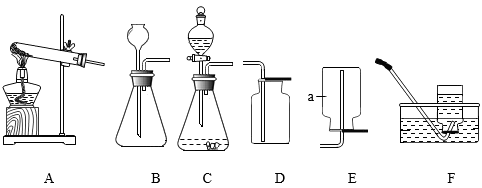 (1)、图中仪器a的名称是。(2)、实验室用过氧化氢溶液制氧气的化学反应方程式为 , 若要收集较纯净的氧气,装置可选用(填字母)。(3)、充分加热氯酸钾和1.5g二氧化锰制氧气,发生装置应选用(填字母)。将残留固体冷却至室温(20℃,该温度下,氯化钾的溶解度34g),称得其质量为4.6g,欲将其中的氯化钾全部溶解,至少应加入蒸馏水的体积约(填序号)。
(1)、图中仪器a的名称是。(2)、实验室用过氧化氢溶液制氧气的化学反应方程式为 , 若要收集较纯净的氧气,装置可选用(填字母)。(3)、充分加热氯酸钾和1.5g二氧化锰制氧气,发生装置应选用(填字母)。将残留固体冷却至室温(20℃,该温度下,氯化钾的溶解度34g),称得其质量为4.6g,欲将其中的氯化钾全部溶解,至少应加入蒸馏水的体积约(填序号)。a、10mL b、20mL c、30mL d、40mL
(4)、实验室制取CO2的化学反应方程式为 , 选用装置B时,长颈漏斗下管口应伸入液面以下,原因是:装置C与装置B相比,装置C的优点是。(5)、氨气是一种无色有刺激性气味的气体,密度小于空气,极易溶于水。实验室常用加热碱石灰与氯化铵混合物的方法制取氨气,发生装置可以选用 , 若选用G装置收集,应该从(填“m”或“n”)通入,还需在装置G后接装置H,H装置中倒置漏斗作用是。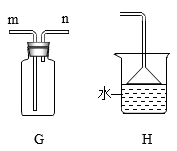 25. 草酸亚铁晶体(FeC2O4·nH2O)是一种浅黄色固体,难溶于水。某兴趣小组利用铁锈制备草酸亚铁晶体并测定其组成。(1)、(一)制备草酸亚铁晶体
25. 草酸亚铁晶体(FeC2O4·nH2O)是一种浅黄色固体,难溶于水。某兴趣小组利用铁锈制备草酸亚铁晶体并测定其组成。(1)、(一)制备草酸亚铁晶体资料1:FeSO4的溶解度如下表:
温度℃
0
10
20
30
40
50
60
溶解度/g
15.6
20.5
26.5
32.9
40.2
48.6
59.8
资料2:FeSO4易被氧气氧化,转化为Fe2(SO4)3。
资料3:草酸(H2C2O4)溶液与FeSO4溶液发生反应:
【制备流程】

在实验室进行“过滤”操作时,用到的玻璃仪器有、和玻璃棒,玻璃棒的作用是。
(2)、已知步骤Ⅰ的反应之一 , 则溶液A中加入过量铁粉,发生的反应有:。步骤Ⅱ中趁热过滤的目的是。(3)、制备过程中,通入氮气的作用是。(4)、(二)测定草酸亚铁晶体的组成FeC2O4·nH2O加热至300℃完全失去结晶水,继续加热至400℃,剩余固体又变成黑色,同时生成气体。为确定分解产物及n的值,设计了下图所示实验。实验时先打开弹簧夹a、b,鼓入一段时间氮气,然后关闭a,加热热分解装置。
资料1:无水硫酸铜是白色固体,遇水变蓝;浓硫酸具有吸水性。
资料2:FeO是一种黑色固体,在空气中不稳定,易被氧化。
【实验设计】

【实验分析】
实验过程中观察到:A中白色固体变蓝,证明产物有:B中石灰水变浑浊,证明产物有CO2;D中(填实验现象),证明产物有CO。
(5)、上述实验装置不足之处是。(6)、为进一步探究加热至400℃时固体产物的成分,另取1.80gFeC2O4·nH2O重新实验,测得热分解装置中固体质量随温度变化如图所示。
①FeC2O4·nH2O中n的值为(写出计算过程)。
②若草酸亚铁晶体中混有杂质(杂质不参加反应),会导致测得的的值(填“偏大”、“不变”或“偏小”)。
③B点物质的化学式为。
④将B点物质在空气中继续加热至500℃得到C点物质,BC段发生反应的化学反应方程式为。
-