江苏省南京市玄武区2021-2022学年九年级上学期期末化学试题
试卷更新日期:2022-02-17 类型:期末考试
一、单选题
-
1. 下列变化属于化学变化的是( )A、石蜡熔化 B、金属锈蚀 C、轮胎爆炸 D、胆矾研磨2. 下列金属中导电性能最好的是( )A、铜 B、铝 C、铁 D、银3. 全硼富勒烯团簇(B40)的分子结构像中国红灯笼(如图)。B40属于( )
 A、单质 B、化合物 C、混合物 D、氧化物4. 下列实验操作正确且合理的是( )A、量取9.5毫升液体
A、单质 B、化合物 C、混合物 D、氧化物4. 下列实验操作正确且合理的是( )A、量取9.5毫升液体 B、过滤
B、过滤 C、氧气验满
C、氧气验满 D、倾倒液体
D、倾倒液体 5. 下列物质的用途主要与化学性质有关的是( )A、金刚石用来裁玻璃 B、乙醇用作燃料 C、活性炭用来吸附毒气 D、干冰用于人工降雨6. 下列有关水的说法正确的是( )A、冰水共存物属于混合物 B、农业上可采用喷灌、滴灌来节水 C、软水中一定不含可溶性钙镁化合物 D、电解水时,正极端玻璃管内产生的气体为氢气7. 下列各组中的两种物质混合,充分搅拌后,不能得到溶液的是( )A、碘和汽油 B、碘和酒精 C、高锰酸钾和汽油 D、高锰酸钾和水8. 如图为铁元素在周期表中的相关信息和铁原子的结构示意图,下列说法正确的是( )
5. 下列物质的用途主要与化学性质有关的是( )A、金刚石用来裁玻璃 B、乙醇用作燃料 C、活性炭用来吸附毒气 D、干冰用于人工降雨6. 下列有关水的说法正确的是( )A、冰水共存物属于混合物 B、农业上可采用喷灌、滴灌来节水 C、软水中一定不含可溶性钙镁化合物 D、电解水时,正极端玻璃管内产生的气体为氢气7. 下列各组中的两种物质混合,充分搅拌后,不能得到溶液的是( )A、碘和汽油 B、碘和酒精 C、高锰酸钾和汽油 D、高锰酸钾和水8. 如图为铁元素在周期表中的相关信息和铁原子的结构示意图,下列说法正确的是( )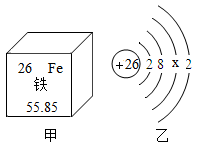 A、X的值为14 B、铁原子核内有26个中子 C、铁元素位于元素周期表的第二周期 D、铁元素的相对原子质量为55.85g9. 如图为粉尘爆炸实验。下列关于该实验的说法正确的是( )
A、X的值为14 B、铁原子核内有26个中子 C、铁元素位于元素周期表的第二周期 D、铁元素的相对原子质量为55.85g9. 如图为粉尘爆炸实验。下列关于该实验的说法正确的是( ) A、鼓空气的目的是为了增大罐内压强 B、点燃蜡烛是为了降低面粉的着火点 C、实验说明粉尘遇到空气就会发生爆炸 D、实验说明可燃物与氧气的接触面积越大,燃烧越剧烈10. 下列实验不能达到实验目的是( )
A、鼓空气的目的是为了增大罐内压强 B、点燃蜡烛是为了降低面粉的着火点 C、实验说明粉尘遇到空气就会发生爆炸 D、实验说明可燃物与氧气的接触面积越大,燃烧越剧烈10. 下列实验不能达到实验目的是( )选项
A
B
C
D
实验




目的
比较空气与呼出气体中二氧化碳的含量
探究温度高低对分子运动快慢的影响
探究铁、铜、银活动性强弱
比较铜与黄铜的硬度
A、A B、B C、C D、D11. 火箭使用的一种燃料是偏二甲肼(C2H8N2),其燃烧的化学方程式为。下列说法不正确的是( )A、常温常压下X为一种无色无毒的气体 B、C2H8N2由碳、氢、氮三种元素组成 C、C2H8N2中氮元素的质量分数为40% D、反应前后氮元素的化合价发生了变化12. 如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐膨胀。下表中液体X和固体Y的组合,正确的是( )①
②
③
④
X
双氧水
水
水
水
Y
二氧化锰
生石灰
氢氧化钠
硝酸铵
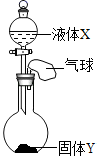 A、①④ B、②③ C、①③④ D、①②③13. 下列有关家庭小实验说法不正确的是( )A、将冷碟子放在蜡烛火焰的上方,可制得炭黑 B、向洗净的碎鸡蛋壳中加入白醋,可以制得二氧化碳 C、把缝衣钢针烧红后,立即放入冷水中,可使缝衣钢针更容易弯曲 D、把6B的铅笔芯、导线、电源、灯泡等相连,可验证石墨的导电性14. 除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案不可行的是( )A、Cu粉(Fe)——加入过量稀盐酸,过滤,洗涤,干燥 B、CO2气体(CO)——将气体缓缓通过足量的灼热的氧化铜 C、FeCl2溶液(CuCl2)——加入过量的Fe粉,过滤 D、NaCl固体(KNO3)——加水溶解,加热浓缩,降温结晶,过滤
A、①④ B、②③ C、①③④ D、①②③13. 下列有关家庭小实验说法不正确的是( )A、将冷碟子放在蜡烛火焰的上方,可制得炭黑 B、向洗净的碎鸡蛋壳中加入白醋,可以制得二氧化碳 C、把缝衣钢针烧红后,立即放入冷水中,可使缝衣钢针更容易弯曲 D、把6B的铅笔芯、导线、电源、灯泡等相连,可验证石墨的导电性14. 除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案不可行的是( )A、Cu粉(Fe)——加入过量稀盐酸,过滤,洗涤,干燥 B、CO2气体(CO)——将气体缓缓通过足量的灼热的氧化铜 C、FeCl2溶液(CuCl2)——加入过量的Fe粉,过滤 D、NaCl固体(KNO3)——加水溶解,加热浓缩,降温结晶,过滤二、多选题
-
15. 某兴趣小组同学取7.2g固体样品(由氧化铁和铁粉混合而成),用下图所示的装置进行实验,待完全反应后,得到固体的质量为6g,B中澄清石灰水变浑浊。下列说法正确的是( )
 A、一氧化碳在反应中体现了氧化性 B、该实验中共发生了3个化学反应 C、样品中铁元素与氧元素质量比为5:1 D、实验结束时先熄灭酒精灯,最后熄灭酒精喷灯
A、一氧化碳在反应中体现了氧化性 B、该实验中共发生了3个化学反应 C、样品中铁元素与氧元素质量比为5:1 D、实验结束时先熄灭酒精灯,最后熄灭酒精喷灯三、综合题
-
16. 某兴趣小组的同学对二氧化碳的制取和相关性质进行探究。

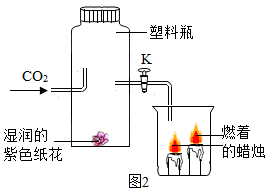 (1)、CO2的制取:A或B装置均可作制取CO2的发生装置,选用A装置的优点是 , 实验室制取二氧化碳的化学方程式为。利用C装置可以进行许多实验。下列实验能达到预期目的的是。(填序号)
(1)、CO2的制取:A或B装置均可作制取CO2的发生装置,选用A装置的优点是 , 实验室制取二氧化碳的化学方程式为。利用C装置可以进行许多实验。下列实验能达到预期目的的是。(填序号)A.收集CO2气体:将CO2气体从n端通入
B.检验CO2是否收满:将燃着的木条放在n端
C.检验所得到的气体是CO2:在瓶中盛少量澄清石灰水,将气体从m端通入
D.测定CO2气体的体积:在瓶中盛满水,m端连接量筒
(2)、CO2的性质:如图2所示进行实验(湿润的紫色纸花是用紫色石蕊溶液浸泡而成的)。打开K后,再缓缓通入二氧化碳气体,观察到的现象是。(3)、CO2的吸收:我国提出2060年前实现碳中和,“碳捕捉和封存”技术是实现碳中和的重要途径之一。常温下,采用加压水洗法可捕集CO2 , 原因是。(4)、CO2的转化:清华大学研究人员成功研制出一种纳米纤维催化剂,可将二氧化碳转化成液体燃料甲醇,其微观示意图如图所示。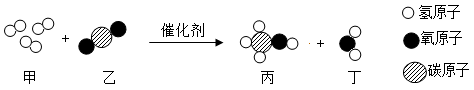
二氧化碳转化为甲醇的化学方程式为。
17. 资源、能源已成为人们日益关注的问题。(1)、目前,人类使用的燃料大多来自化石能源,如煤、石油、天然气,它们属于(填“可再生”或“不可再生”)能源。(2)、我国有着丰富的可燃冰资源,其顺利开采可有效降低我国能源的对外依赖程度。①可燃冰、天然气的主要成分都是甲烷。请写出甲烷在空气中完全燃烧的化学方程式。为方便贮存和运输,天然气可被压缩到容积很小的钢瓶中,而可燃冰却很难被压缩。试从微观的角度分析可燃冰难被压缩的原因。
②氢气也是一种重要的能源,请设计实验鉴别甲烷和氢气,并完成实验报告。
实验步骤
实验现象
实验结论
18. 水和溶液在日常生活、科学研究中具有广泛的用途。(1)、生活中为了降低水的硬度并杀菌消毒,常用的方法是。(2)、甲、乙两种物质(均不含结晶水)的溶解度曲线如图所示,请回答。
①t1℃时,在50g水中加入20g乙固体,充分搅拌后得到(填“饱和或不饱和”)溶液。
②t2℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体,须恒温蒸发掉较多水的是(填“甲”或“乙”)物质的饱和溶液。
③使甲物质的溶液状态发生如下改变,对应操作正确的是。
A.a点→c点:加水 B.b点→c点:恒温蒸发
C.a点→b点:升温 D.c点→a点:降温、过滤
(3)、生理盐水是医疗上常用的一种溶液,取出其中的任意一部分进行比较,发现它们的组成完全相同,说明溶液具有性。(4)、实验室常用过氧化氢溶液制取氧气,若要制取6.4g氧气,则同时产生水的质量是多少?(写出计算过程)19. 钛和钛合金被认为是21世纪的重要金属材料,广泛应用于航天、医疗等领域。用二氧化钛制备钛的过程如下:
根据流程图等信息,回答下列问题:
(1)、TiCl4中钛元素的化合价为。(2)、钛合金的熔点比金属钛。航天飞机常用到钛合金,是因为钛合金具备很多优良性能,如(请你写出一点)。(3)、步骤Ⅰ中发生反应的化学方程式是。(4)、步骤Ⅱ中发生反应的化学方程式是 , 该反应的基本反应类型是;该步骤需在氩气环境中进行,氩气的作用是。20. 图中A-J是初中化学常见的物质。C、E、F为单质,且C的状态与另两者不同,A是大理石的主要成分。D、G、H、J为氧化物,且D、G均为黑色固体,B由两元素组成,分子中原子的个数比为1:1。图中“一”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系,反应条件、部分反应物和生成物已略去。 (1)、请写出下列物质的化学式:AC。(2)、写出E→D的化学反应方程式:。写出I-J的化学反应方程式:。21. 铜是人类使用最早、应用广泛的金属材料。某兴趣小组对铜及其化合物的性质进行了探究。(1)、探究长期放置在空气中的铜表面生锈,生成“铜绿”(化学式:Cu2(OH)2CO3)的原因。
(1)、请写出下列物质的化学式:AC。(2)、写出E→D的化学反应方程式:。写出I-J的化学反应方程式:。21. 铜是人类使用最早、应用广泛的金属材料。某兴趣小组对铜及其化合物的性质进行了探究。(1)、探究长期放置在空气中的铜表面生锈,生成“铜绿”(化学式:Cu2(OH)2CO3)的原因。【查阅资料】碱石灰能吸收二氧化碳和水蒸气,氢氧化钠溶液能吸收二氧化碳。
【设计实验】
序号
a
b
c
d
实验装置




实验现象
铜片不生锈
铜片不生锈
铜片不生锈
铜片生锈
【得出结论】①说明铜生锈需要水的一组实验是(填实验序号);
②通过实验证明铜与H2O和反应产生“铜绿”。
③碱石灰的作用是。
(2)、探究CuO和氢气的反应产物【查阅资料】氧化亚铜为红色固体,溶于氨水得到蓝色溶液。
【进行实验】实验①,如图1所示实验装置,进行氢气还原氧化铜实验并检验固体产物。

实验②:称取若干份质量均为0.6000g的CuO,在相同条件下分别用氢气还原,其在不同时间(t)所得固体中Cu2O的质量(m)如图2所示。
【实验结论】取实验①反应后的红色固体于烧杯中,加入氨水并搅拌,观察到 , 证明固体产物有Cu2O。
(3)、【实验反思】兴趣小组认为,氢气还原氧化铜的反应过程主要为“经历 , 两个反应,且在同一条件下两个反应同时进行”。请结合实验结果和计算分析,说明“在同一条件下两个反应能同时进行”合理的依据:。(4)、探究硫酸铜溶液与铝反应的产物【进行实验】兴趣小组同学在试管中进行如图3所示的实验,实验中发生反应的化学方程式是:。

实验过程中,小组同学惊奇的发现试管中铝片表面有气泡生成,并收集了该气体。
【提出问题】生成的气体是什么呢?
【猜想与假设】猜想1:可能是SO2;猜想2:可能是H2;……
【实验探究】甲同学用手轻的在盛有该气体的试管口煸动,使极少量的气体飘进鼻孔,发现该气体无气味,认为猜想1不成立,其原因是。乙同学在甲同学实验的基础上,接着进一步实验,验证该气体为H2。
(5)、【解释和结论】铝片表面生成的少量气泡为H2 , 硫酸铜溶于水后,会发生如下变化:①CuSO4在水中解离出Cu2+和;
②。
铝片和H+会发生如下变化:
【拓展延伸】材料1:硫酸铝溶于水也会发生类似的变化。
材料2:在一定条件下,氢氧化铝具有吸附性,可吸附水里的悬浮杂质。
根据以上信息,请解释硫酸铝也可以用来净水的原因:。
-