福建省三明市2021-2022学年九年级上学期期末化学试题
试卷更新日期:2022-02-15 类型:期末考试
一、单选题
-
1. 碳单质的下列用途与化学性质有关的是( )A、金刚石用来切割玻璃 B、石墨作电极 C、活性炭作吸附剂 D、焦炭用于冶金2. 新冠肺炎疫情时期,可用酒精擦拭手和小物品消毒。关于酒精挥发的下列说法正确的是( )A、分子分解成了原子 B、分子体积变大 C、分子间的间隔变大 D、分子种类改变3. 钆是一种稀土元素,具有铁磁性,用于微波技术、彩色电视机的荧光粉、原子能工业及配制特种合金等。下列有关钆说法错误的是( )

 A、钆的相对原子质量为157.25g B、钆元素的原子序数为64 C、钆是第六周期的元素 D、金属钆能被磁铁吸引4. 在实验室制取二氧化碳的过程中,下列操作正确的是( )A、
A、钆的相对原子质量为157.25g B、钆元素的原子序数为64 C、钆是第六周期的元素 D、金属钆能被磁铁吸引4. 在实验室制取二氧化碳的过程中,下列操作正确的是( )A、 检查气密性
B、
检查气密性
B、 加入石灰石
C、
加入石灰石
C、 加入稀盐酸
D、
加入稀盐酸
D、 收集二氧化碳气体
5. 金刚石和石墨是碳家族中的两个重要成员。下列有关金刚石和石墨的说法错误的是( )A、金刚石和石墨都是由碳元素组成的单质 B、金刚石和石墨的相互转化属于物理变化 C、金刚石和石墨中的碳原子排列方式不同 D、金刚石和石墨的性质存在着明显差异6. 磷酸氯喹(C18H32ClN3O8P2)能用于治疗新冠肺炎。下列有关磷酸氯喹的说法正确的是( )A、磷酸氯喹属于混合物 B、磷酸氯喹由六种元素组成 C、磷酸氯喹由64个原子构成 D、磷酸氯喹中氢元素与氧元素的质量比为4:17. 下列事实能用质量守恒定律来解释的是( )A、水结冰体积变大,质量不变 B、化学反应有的放出热量,有的吸收热量 C、50mL水和50mL酒精混合后体积小于100mL D、16gS与16g的O2完全反应生成32g的SO28. 下列实验方案能达到目的的是( )
收集二氧化碳气体
5. 金刚石和石墨是碳家族中的两个重要成员。下列有关金刚石和石墨的说法错误的是( )A、金刚石和石墨都是由碳元素组成的单质 B、金刚石和石墨的相互转化属于物理变化 C、金刚石和石墨中的碳原子排列方式不同 D、金刚石和石墨的性质存在着明显差异6. 磷酸氯喹(C18H32ClN3O8P2)能用于治疗新冠肺炎。下列有关磷酸氯喹的说法正确的是( )A、磷酸氯喹属于混合物 B、磷酸氯喹由六种元素组成 C、磷酸氯喹由64个原子构成 D、磷酸氯喹中氢元素与氧元素的质量比为4:17. 下列事实能用质量守恒定律来解释的是( )A、水结冰体积变大,质量不变 B、化学反应有的放出热量,有的吸收热量 C、50mL水和50mL酒精混合后体积小于100mL D、16gS与16g的O2完全反应生成32g的SO28. 下列实验方案能达到目的的是( )实验目的
实验方案
A
降低水的硬度
沉淀、过滤
B
除去CuSO4溶液中的H2SO4
加足量铜粉后过滤
C
检验某气体是二氧化碳
将燃着的木条伸入集气瓶中
D
区别碳酸钙粉末与生石灰
各取少量粉末,分别加入试管中,再加适量的水
A、A B、B C、C D、D9. 对下列事实的解释或者结论,正确的是( )A、氧气和臭氧的化学性质不同—由不同的分子构成 B、二氧化锰和氯酸钾中都含有氧元素—都属于氧化物 C、清末的铝制佛像至今保存完好—铝的化学性质不活泼 D、蜡烛燃烧生成水和二氧化碳—蜡烛中一定含有碳、氢、氧元素10. 某兴趣小组用如图所示装置测定本地石灰石中碳酸钙的质量分数,下列说法错误的是( ) A、检查装置的气密性时,向上移动c管,观察b、c管中是否有稳定的液面差 B、读取b管中的气体体积时,要移动c管,使b、c管中的液面保持同一高度 C、a导管的作用是防止实验测定的结果偏小 D、b管中油的作用是防止实验测定的结果偏小
A、检查装置的气密性时,向上移动c管,观察b、c管中是否有稳定的液面差 B、读取b管中的气体体积时,要移动c管,使b、c管中的液面保持同一高度 C、a导管的作用是防止实验测定的结果偏小 D、b管中油的作用是防止实验测定的结果偏小二、填空题
-
11. 水是生存之本、文明之源。(1)、自来水厂常利用明矾净水。
①明矾的化学名称为十二水合硫酸铝钾,化学式为(填标号)。
A.KAlSO4•12H2O B.KAl(SO4)2•12H2O C.(SO4)2AlK•12H2O D.KAlS2•12H2O
②明矾溶于水后生成胶状氢氧化铝,该变化属于变化。
(2)、生活中常将水煮沸再喝,煮沸的作用是(写一点)。(3)、电解水的化学方程式为 , 水的生成和分解实验,得到的实验结论是 , 得出该结论的理论依据是。(4)、写出你在生活中节约用水的一种做法。12. 化学与“碳达峰”、“碳中和”。(1)、“碳达峰”与“碳中和”中的“碳”所指的物质是。(2)、工业上在“Ni基催化剂”作用下,用天然气“捕获”二氧化碳,反应的微观示意图如图所示。
①方框内的微粒是一种单质分子,其化学式为。
②从微观角度看,变化过程中的种类没有改变,生成的两种分子个数比为。
(3)、大量使用煤和石油等化石燃料,会增加碳的排放,还产生SO2形成酸雨,形成原理为:2SO2+O2+2X=2H2SO4 , X的化学式为;该反应中,硫元素的化合价(填“升高”、“降低”或“不变”)。助力实现“碳达峰”、“碳中和”,必须大力开发利用其他能源,如(举一例)。13. 化学实验是科学探究的基础。 (1)、实验A,观察到的现象是。(2)、实验B,目的是探究铁生锈与有关。(3)、实验C,反应结束后,观察到天平的指针(填“不变”、”偏左”或”偏右”),原因是(用化学方程式表示)。(4)、实验D,用酒精灯在中间位置加热一段时间。
(1)、实验A,观察到的现象是。(2)、实验B,目的是探究铁生锈与有关。(3)、实验C,反应结束后,观察到天平的指针(填“不变”、”偏左”或”偏右”),原因是(用化学方程式表示)。(4)、实验D,用酒精灯在中间位置加热一段时间。①白磷先燃烧,a处红磷后燃烧,原因是。
②b处红磷拨开细沙后才燃烧,证明了燃烧的一个条件为。
③磷燃烧的化学方程式为。
三、综合题
-
14. 我国是钢铁大国,经济的发展离不开钢铁。(1)、认识钢铁:
①钢和生铁的区别是不同。
②验证Mg、Fe、Cu三种金属的活动性顺序,可以将打磨好的铁丝分别放入少量的(填化学式,下同)溶液和溶液中,然后根据实验现象进行判断。
(2)、冶炼钢铁:竖炉冶铁是一种重要的炼铁方法,其工艺流程如图所示。
①从物质分类看,赤铁矿属于。
②还原反应室中发生置换反应的化学方程式为。
③燃烧室中甲烷的作用是。
④与传统的冶铁工艺相比,该工艺的优点有(写一个)。
15. “绿色奥运”—2022年北京冬奥会使用氢氧燃料电池为动力的汽车。 (1)、利用铁酸锌(ZnFe2O4)循环制氢气的过程如图所示。
(1)、利用铁酸锌(ZnFe2O4)循环制氢气的过程如图所示。①该循环制氢中不断被消耗的物质是 , 铁酸锌在该反应中起作用。
②循环制氢气过程中产生氢气的化学方程式为。
(2)、氢氧燃料电池的工作原理如图所示。
①该变化过程中,氢原子在电极A处(填“得到”或“失去”)电子后变成了氢离子,电极A上有多余的电子而带电,氢离子通过质子交换膜,在电极B处与氧共同作用生成水。
②氢氧燃料电池是将化学能转化为能。
(3)、某氢氧燃料电池车在5分钟内一次加5.6kg氢气,行走了1000km,理论上同时生成水的质量为?(化学方程式为 , 写出计算过程)16. 氧气的制取和性质。 (1)、用装置甲制取氧气,反应物为(填化学式);如果用注射器代替长颈漏斗,优点是(写一点)。(2)、用装置乙制取氧气,反应的化学方程式为;采用该收集方法的依据是。(3)、装置丙为铁丝在氧气中燃烧。
(1)、用装置甲制取氧气,反应物为(填化学式);如果用注射器代替长颈漏斗,优点是(写一点)。(2)、用装置乙制取氧气,反应的化学方程式为;采用该收集方法的依据是。(3)、装置丙为铁丝在氧气中燃烧。①能说明铁丝在氧气中燃烧属于化学变化的现象是。
②根据铁丝能在氧气中燃烧,而不能在空气中燃烧的事实,你对燃烧条件的新认识是。
17. 某化学兴趣小组利用所学知识制作美丽的“喷泉”。(1)、(实验1)如图所示,将胶头滴管中的氢氧化钠溶液挤入装满二氧化碳的烧瓶中,轻轻摇动烧瓶,一段时间后打开止水夹,烧杯中的氢氧化钠溶液被倒吸入烧瓶中,形成美丽的“喷泉”。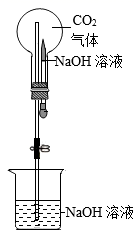
烧杯中的氢氧化钠溶液被倒吸入烧瓶中的原因是:CO2减少,造成。
(2)、(实验2)将针筒内的水和氢氧化钠溶液同时注入装满二氧化碳的烧瓶中,振荡。测得两烧瓶内气压随时间变化的趋势如图所示。(资料:氢氧化钠与氢氧化钙的化学性质相似)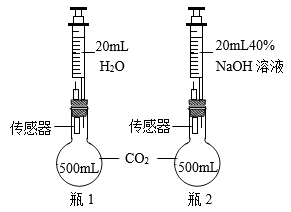
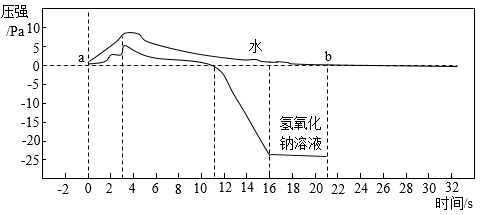
3s内,烧瓶中的压强变大的原因是 , 振荡,烧瓶中的压强迅速降低,振荡能加快分别与水、氢氧化钠溶液起作用的原因是。
(3)、烧瓶1中的压强,在a点和b点时相同的原因是 , 如果将“实验1”中两处的氧化钠溶液换成水,(填“能”或“不能”)形成美丽的“喷泉”。(4)、对比图中的两条曲线,证明了“实验1”中CO2减少的原因是。(用化学方程式表示)(5)、(实验3)如图所示,往试管中加入足量的某液体,塞紧试管 塞,打开止水夹,右边试管中的红色溶液从导管口喷出,形成红色“喷泉”。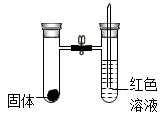
写出能完成该实验的一组药品。
(6)、该实验能形成“喷泉”的原因是。