北京市海淀区2021-2022学年九年级上学期期末化学试题
试卷更新日期:2022-02-15 类型:期末考试
一、单选题
-
1. 下列物质中,属于纯净物的是( )A、碳酸饮料 B、自来水 C、海水 D、蒸馏水2. 空气中体积分数约占78%的气体是( )A、二氧化碳 B、氮气 C、氧气 D、稀有气体3. 下列物质在氧气中燃烧,火星四射、生成黑色固体的是( )A、木炭 B、镁条 C、硫粉 D、铁丝4. 下列图标中,表示“禁止吸烟”的是( )A、
 B、
B、 C、
C、 D、
D、 5. “善存”片富含维生素、钾和镁等,这里的“钾”和“镁”指的是( )A、分子 B、原子 C、元素 D、单质6. 下列物质不含金属元素的是( )A、Ca(OH)2 B、HCl C、MgO D、Fe3O47. 下列物质的用途中,主要利用其物理性质的是( )A、氧气用于气焊 B、氮气用作保护气 C、干冰用于人工降雨 D、白磷用作烟雾弹8. 下列物质不属于可燃物的是( )A、氢气 B、甲烷 C、酒精 D、氧气9. 下列操作错误的是( )A、
5. “善存”片富含维生素、钾和镁等,这里的“钾”和“镁”指的是( )A、分子 B、原子 C、元素 D、单质6. 下列物质不含金属元素的是( )A、Ca(OH)2 B、HCl C、MgO D、Fe3O47. 下列物质的用途中,主要利用其物理性质的是( )A、氧气用于气焊 B、氮气用作保护气 C、干冰用于人工降雨 D、白磷用作烟雾弹8. 下列物质不属于可燃物的是( )A、氢气 B、甲烷 C、酒精 D、氧气9. 下列操作错误的是( )A、 读出液体体积
B、
读出液体体积
B、 闻气体气味
C、
闻气体气味
C、 取固体粉末
D、
取固体粉末
D、 检查装置的气密性
10. 气体能压缩在钢瓶中保存,主要体现了( )A、分子的质量很小 B、分子间有间隔 C、分子在不断运动 D、分子由原子构成11. 下列方法不能区分氧气和二氧化碳的是( )A、观察颜色 B、滴加紫色石蕊溶液 C、滴加澄清石灰水 D、伸入燃着的木条12. 下列符号表示2个氧原子的是( )A、2O2 B、O2 C、H2O2 D、2O13. 下列试剂瓶标签中的化学式错误的是( )A、
检查装置的气密性
10. 气体能压缩在钢瓶中保存,主要体现了( )A、分子的质量很小 B、分子间有间隔 C、分子在不断运动 D、分子由原子构成11. 下列方法不能区分氧气和二氧化碳的是( )A、观察颜色 B、滴加紫色石蕊溶液 C、滴加澄清石灰水 D、伸入燃着的木条12. 下列符号表示2个氧原子的是( )A、2O2 B、O2 C、H2O2 D、2O13. 下列试剂瓶标签中的化学式错误的是( )A、 B、
B、 C、
C、 D、
D、 14. 下列化学方程式书写正确的是( )A、3Fe + 2O2Fe3O4 B、H2O2O2↑+H2↑ C、2CuO + C=2Cu + CO2↑ D、Na2CO3 + HCl=NaCl + H2O + CO2↑15. 下列有关镍元素的说法错误的是( )
14. 下列化学方程式书写正确的是( )A、3Fe + 2O2Fe3O4 B、H2O2O2↑+H2↑ C、2CuO + C=2Cu + CO2↑ D、Na2CO3 + HCl=NaCl + H2O + CO2↑15. 下列有关镍元素的说法错误的是( ) A、原子序数是28 B、原子核内质子数为30 C、元素符号是Ni D、相对原子质量为58.6916. 下列灭火方法错误的是( )A、用锅盖盖灭着火的油锅 B、电器着火时用自来水扑灭 C、野炊完毕后用沙子将火焰盖灭 D、关闭燃气灶阀门熄灭燃气火苗17. NH4ClO4(高氯酸铵)可用作火箭推进剂,当它发生分解反应时,不能生成的物质是()A、CO2 B、Cl2 C、O2 D、N218. 生活中下列做法错误的是( )A、用肥皂水区分硬水和软水 B、将金属易拉罐放入厨余垃圾桶 C、洗手涂肥皂时关闭水龙头 D、净水时用活性炭吸附色素和异味19. 利用下图所示实验验证空气中的氧气含量。下列叙述错误的是( )
A、原子序数是28 B、原子核内质子数为30 C、元素符号是Ni D、相对原子质量为58.6916. 下列灭火方法错误的是( )A、用锅盖盖灭着火的油锅 B、电器着火时用自来水扑灭 C、野炊完毕后用沙子将火焰盖灭 D、关闭燃气灶阀门熄灭燃气火苗17. NH4ClO4(高氯酸铵)可用作火箭推进剂,当它发生分解反应时,不能生成的物质是()A、CO2 B、Cl2 C、O2 D、N218. 生活中下列做法错误的是( )A、用肥皂水区分硬水和软水 B、将金属易拉罐放入厨余垃圾桶 C、洗手涂肥皂时关闭水龙头 D、净水时用活性炭吸附色素和异味19. 利用下图所示实验验证空气中的氧气含量。下列叙述错误的是( ) A、实验前需检查装置气密性 B、红磷的作用是消耗瓶中的氧气 C、红磷熄灭后立即打开止水夹并读数 D、进入集气瓶中水的体积约占瓶内原空气体积的五分之一20. 已知H2S燃烧的化学方程式为:2H2S + 3O22SO2 + 2H2O。下列说法正确的是( )A、该反应体现H2S的可燃性 B、H2S中硫元素的化合价是+2 C、生成的SO2可以直接排入空气 D、该反应为化合反应21. 乙烯(C2H4)是一种重要的有机化工原料。用乙烯可制备乙醇,反应的微观示意图如下。下列说法错误的是( )
A、实验前需检查装置气密性 B、红磷的作用是消耗瓶中的氧气 C、红磷熄灭后立即打开止水夹并读数 D、进入集气瓶中水的体积约占瓶内原空气体积的五分之一20. 已知H2S燃烧的化学方程式为:2H2S + 3O22SO2 + 2H2O。下列说法正确的是( )A、该反应体现H2S的可燃性 B、H2S中硫元素的化合价是+2 C、生成的SO2可以直接排入空气 D、该反应为化合反应21. 乙烯(C2H4)是一种重要的有机化工原料。用乙烯可制备乙醇,反应的微观示意图如下。下列说法错误的是( ) A、乙烯分子中碳原子、氢原子个数比为1:2 B、乙醇由碳元素、氢元素和氧元素组成 C、反应过程中分子种类发生了改变 D、28 g乙烯能与36 g水反应生成64 g乙醇22. 二氧化氯(ClO2)是是有刺激性气味的气体,易溶于水,浓度高时易爆炸,常用作灭菌消毒剂。实验室可用氯酸钾(KClO3)固体和浓硫酸反应制备ClO2 , 反应原理为:3KClO3+3H2SO4=2ClO2↑+HClO4+H2O+3KHSO4。下列说法正确的是( )A、“刺激性气味”属于化学性质 B、可用排水法收集产生的ClO2气体 C、KClO3中的氯元素全部转化到ClO2中 D、制取ClO2时需要防止浓度过高引起爆炸23. 下图所示实验操作及现象可以得到相应结论的是( )
A、乙烯分子中碳原子、氢原子个数比为1:2 B、乙醇由碳元素、氢元素和氧元素组成 C、反应过程中分子种类发生了改变 D、28 g乙烯能与36 g水反应生成64 g乙醇22. 二氧化氯(ClO2)是是有刺激性气味的气体,易溶于水,浓度高时易爆炸,常用作灭菌消毒剂。实验室可用氯酸钾(KClO3)固体和浓硫酸反应制备ClO2 , 反应原理为:3KClO3+3H2SO4=2ClO2↑+HClO4+H2O+3KHSO4。下列说法正确的是( )A、“刺激性气味”属于化学性质 B、可用排水法收集产生的ClO2气体 C、KClO3中的氯元素全部转化到ClO2中 D、制取ClO2时需要防止浓度过高引起爆炸23. 下图所示实验操作及现象可以得到相应结论的是( )A
B
C
D
实验操作及现象

甲中气体被点燃,火焰呈淡蓝色;乙中气体使木条燃烧更旺

甲中木条无明显变化,乙中木条熄灭

甲中有极少量气泡;乙中有大量气泡
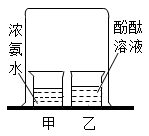
甲中溶液无明显现象;乙中溶液变为红色
结论
甲中气体是氧气;乙中气体是氢气
乙中氧气的含量比甲中的低
硫酸铜在过氧化氢分解中起催化作用
酚酞分子运动到浓氨水中
A、A B、B C、C D、D24. 已知盐酸与镁可发生反应:2HCl+Mg=H2↑+MgCl2 , 反应放热显著。进行右图所示实验,将盐酸滴到镁条上,观察实验现象。下列说法错误的是( ) A、有气泡产生 B、气球变鼓与生成氢气和反应放热有关 C、反应结束冷却至室温,气球体积恢复至反应前大小 D、若最终得到澄清液体,则生成的氯化镁可能溶解于水中25. 用图1装置探究物质燃烧。点燃蜡烛后立即塞紧橡胶塞,待蜡烛熄灭后,在t1时,将滴管中的水全部滴入集气瓶,铝盒中的白磷燃烧。图2是集气瓶内O2浓度随时间变化的图像。
A、有气泡产生 B、气球变鼓与生成氢气和反应放热有关 C、反应结束冷却至室温,气球体积恢复至反应前大小 D、若最终得到澄清液体,则生成的氯化镁可能溶解于水中25. 用图1装置探究物质燃烧。点燃蜡烛后立即塞紧橡胶塞,待蜡烛熄灭后,在t1时,将滴管中的水全部滴入集气瓶,铝盒中的白磷燃烧。图2是集气瓶内O2浓度随时间变化的图像。
下列说法错误的是( )
A、0-t1内,O2浓度下降与蜡烛燃烧有关 B、生石灰的作用是与水反应放热,引燃白磷 C、该实验证明白磷和蜡烛燃烧需要的最低O2浓度相同 D、滴入水后,CO2浓度可能下降二、填空题
-
26. 从A或B两题中任选一个作答,若两题均作答,按A计分。
A.化石燃料包括煤、和天然气,其燃烧是温室气体产生的重要来源
B.风能、潮汐能和等是可用于代替化石燃料的新能源
27. 煤干馏是煤综合利用的主要工艺,煤干馏的产物之一是焦炭(主要成分为C)。(1)、焦炭充分燃烧时发生反应的化学方程式为。(2)、在高温条件下,焦炭与水蒸气反应生成一氧化碳和氢气,此过程被称为煤的气化,反应的化学方程式为。28. 我国科学家以二氧化碳、氢气为原料,通过十步反应制得淀粉[化学式为(C6H10O5)n],实现了二氧化碳到淀粉的人工合成。(1)、二氧化碳、氢气、淀粉三种物质中,属于单质的是。(2)、关于二氧化碳合成淀粉的意义,下列说法正确的是(填序号)。a.能够消耗二氧化碳,将有助于减少温室效应
b.能够合成淀粉,将有利于解决粮食短缺问题
29. 金属制品在日常生活中应用广泛。下列物品中,利用了铜的导电性的是(填序号)。 30. 铁制的自来水管件比铜制的容易生锈,由此反映出(填“铁”或“铜”)的化学性质更加活泼。将Fe放置于CuSO4溶液中,反应生成Cu,反应的化学方程式为。31. 硝酸(HNO3)在工业上可用于制化肥、农药、炸药、染料等,制备的部分流程如图。
30. 铁制的自来水管件比铜制的容易生锈,由此反映出(填“铁”或“铜”)的化学性质更加活泼。将Fe放置于CuSO4溶液中,反应生成Cu,反应的化学方程式为。31. 硝酸(HNO3)在工业上可用于制化肥、农药、炸药、染料等,制备的部分流程如图。 (1)、氧化炉中发生的主要反应为:4NH3 + 5O24NO + 6H2O,其中氧元素的化合价(填“升高”“降低”或“不变”)。(2)、NO在常温下迅速转化为NO2 , 反应的微观示意图如下,在方框中补全反应物的微粒图示。
(1)、氧化炉中发生的主要反应为:4NH3 + 5O24NO + 6H2O,其中氧元素的化合价(填“升高”“降低”或“不变”)。(2)、NO在常温下迅速转化为NO2 , 反应的微观示意图如下,在方框中补全反应物的微粒图示。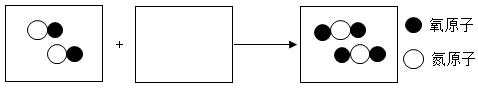 (3)、吸收塔中最终生成HNO3 , 其中的氢元素可能来源于原料中的NH3和。32. 用下图装置进行实验验证质量守恒定律。
(3)、吸收塔中最终生成HNO3 , 其中的氢元素可能来源于原料中的NH3和。32. 用下图装置进行实验验证质量守恒定律。 (1)、A中,红磷燃烧的化学方程式为 , 能够验证质量守恒定律的现象是。(2)、B中,观察到现象时说明反应发生,可以再次观察天平是否平衡。(3)、C中,将盐酸加入碳酸钙中,反应的化学方程式为。反应后测得总质量减少,其原因是。
(1)、A中,红磷燃烧的化学方程式为 , 能够验证质量守恒定律的现象是。(2)、B中,观察到现象时说明反应发生,可以再次观察天平是否平衡。(3)、C中,将盐酸加入碳酸钙中,反应的化学方程式为。反应后测得总质量减少,其原因是。三、科普阅读题
-
33. 阅读下面的科普短文。
第24届冬季奥运会将在北京举办,新建的国家速滑馆(“冰丝带”)是北京主赛区的标志性场馆。
制冰技术是速滑馆建设的关键,中国建设团队采用了冬奥场馆历史上第一次使用的新技术——二氧化碳跨临界直冷制冰技术。该技术碳排放趋近于零,且对大气臭氧层没有影响,是目前世界上最环保的制冰技术。该技术可控制冰面温差在 0.5 ℃以内,制冰更加均匀,这在以 0.001 秒计时的高水平竞技中尤为关键。

研究发现,制冰机的二氧化碳蒸发温度和转桶材料对制冰量都有影响,图 1 所示为其他条件相同时,制冰量随二氧化碳蒸发温度和转桶材料的变化。
冰面下是混凝土冰板层,施工中需使用专用抗冻混凝土以保证冰面质量。混凝土的主要材料是水泥,水泥是以石灰石(主要成分为CaCO3)、粘土(主要成分为SiO2、Al2O3等)等为原料,在高温条件下发生一系列反应制得的硅酸盐材料。科学家通过调整混凝土的材料配方增强其抗冻性,图2是掺有陶粒的陶粒混凝土和普通混凝土的抗冻性对比实验结果(强度损失率越高,抗冻性越差)。


独具“中国范”的冬奥场馆赛后将常年举办各种冰上赛事,成为北京市民参与体育冰上运动的多功能场馆。
(原文作者赵莹莹等,有删改)
(1)、采用二氧化碳跨临界直冷制冰技术的优点有(写出一条即可)。(2)、石灰石和粘土的主要成分中,属于氧化物的有。(3)、由图1可知,相同条件下,转桶材料为(填“不锈钢”或“铝”)时制冰量较 大。(4)、根据图2可推断“陶粒混凝土的抗冻性优于普通混凝土”,依据是。(5)、判断下列说法是否正确(填“对”或“错”)。①水泥是一种硅酸盐材料。
②“冰丝带”场馆建设应用了新的科学技术。
③制冰技术和冰下混凝土工艺都会影响冰面质量。
四、综合题
-
34. 以电石渣[主要成分为Ca(OH)2]为原料制备氯酸钾(KClO3)的工艺流程如下图。
 (1)、将电石渣粉碎的目的是。(2)、反应釜1中的总反应为6Ca(OH)2+6X=Ca(ClO3)2+5CaCl2+6H2O,物质X是一种单质,其化学式为。(3)、反应釜2中发生的是(填“物理”或“化学”)变化。35. 用下图装置制取气体。
(1)、将电石渣粉碎的目的是。(2)、反应釜1中的总反应为6Ca(OH)2+6X=Ca(ClO3)2+5CaCl2+6H2O,物质X是一种单质,其化学式为。(3)、反应釜2中发生的是(填“物理”或“化学”)变化。35. 用下图装置制取气体。 (1)、用高锰酸钾制取O2的化学方程式为 , 收集装置可选择或(填序号,下同)。(2)、实验室制取CO2时选择的发生装置是。(3)、用d装置收集CO2时,检验气体是否集满的实验操作为。36. 用如图所示实验研究CO2遇水的变化。
(1)、用高锰酸钾制取O2的化学方程式为 , 收集装置可选择或(填序号,下同)。(2)、实验室制取CO2时选择的发生装置是。(3)、用d装置收集CO2时,检验气体是否集满的实验操作为。36. 用如图所示实验研究CO2遇水的变化。 (1)、由瓶子变瘪得到的结论是。(2)、继续通过以下实验证明二氧化碳和水发生反应生成酸性物质。
(1)、由瓶子变瘪得到的结论是。(2)、继续通过以下实验证明二氧化碳和水发生反应生成酸性物质。已知:酸性物质可以使紫色石蕊变红。
序号
实验操作
实验现象
a
将瓶中液体滴在干燥的紫色石蕊试纸上
试纸变红
b
将干燥的紫色石蕊试纸放入CO2中
试纸不变色
c
试纸不变色
①b的实验目的为。
②c的实验操作为。
37. 用如图实验验证CO2的性质。 (1)、可以说明“CO2的密度大于空气”的现象是。(2)、实验结束后,向瓶中加入少量澄清石灰水,石灰水变浑浊,反应的化学方程式为。38. 用下图所示实验探究可燃物燃烧的条件。
(1)、可以说明“CO2的密度大于空气”的现象是。(2)、实验结束后,向瓶中加入少量澄清石灰水,石灰水变浑浊,反应的化学方程式为。38. 用下图所示实验探究可燃物燃烧的条件。
已知:白磷的着火点是40 ℃,红磷的着火点是240 ℃。
(1)、将红磷和白磷所在部位浸泡入80℃热水中,观察到白磷燃烧而红磷不燃烧,由此可知可燃物燃烧的条件之一是。(2)、为了证明可燃物燃烧需要氧气,同学们继续如下操作:将注射器中的液体X缓缓推入装置中与固体Y反应,则液体X和固体Y是(填序号),观察到的现象是。序号
液体X
固体Y
a
稀盐酸
碳酸钙
b
双氧水
二氧化锰
39. 实验小组对密闭集气瓶内蜡烛燃烧时间的影响因素进行探究,装置如图。
(进行实验)
实验1:6个集气瓶中盛有不同配比的氧气、氮气的混合气体,分别用6支相同的蜡烛点然后测定其燃烧时间。
氧气体积分数
10%
20%
40%
60%
80%
100%
燃烧时间/s
0
12
26
35
30
25
现象
立即熄灭
安静燃烧
剧烈燃烧,烛芯长度变大,蜡烛高度变小
同学们对比氧气体积分数60%~100 %的现象,发现氧气体积分数越大蜡烛燃烧越剧烈,烛芯长度变大和蜡烛高度变小越显著。猜测烛芯长度或蜡烛高度可能会影响燃烧时间,继续进行实验。
实验2-1:将集气瓶中充满空气,测定相同蜡烛高度、不同烛芯长度的蜡烛在集气瓶中燃烧的时间。
烛芯长度/cm
0.3
0.5
0.7
0.9
燃烧时间/s
16
13
11
8
实验2-2:将集气瓶中充满空气,测定____的蜡烛在集气瓶中的燃烧时间。
蜡烛高度/cm
1
3
5
7
燃烧时间/s
17
10
9
8
(分析与结论)
(1)、实验1的目的是探究对蜡烛在集气瓶中燃烧时间的影响。(2)、实验2-1的结论是。(3)、补全实验2-2的操作:。(4)、(反思与评价)甲同学认为实验2蜡烛熄灭的原因是氧气完全消耗。乙同学依据实验1判断甲同学的说法不严谨,支持乙同学判断的证据是。
(5)、实验1中,氧气体积分数大于60%之后,氧气体积分数增大,蜡烛燃烧时间变短。结合实验2分析其原因是。五、计算题
-
40. 钢铁产业是工业发展的基础。工业上主要利用一氧化碳还原赤铁矿(主要成分为Fe2O3)冶炼金属铁,其反应原理为Fe2O3+3CO2Fe + 3CO2。(1)、Fe2O3中铁元素的质量分数为。(2)、参加反应的CO和生成的CO2的分子个数比为。(3)、要冶炼制得112tFe,计算理论上需要的CO的质量。
-