山东省枣庄市市中区2021-2022学年九年级上学期期末化学试题
试卷更新日期:2022-02-13 类型:期末考试
一、单选题
-
1. 下列图示为“循环利用”标志的是( )A、
 B、
B、 C、
C、 D、
D、 2. 日常生活中的下列做法,一定含有化学变化的是( )A、用胶带粘合破损书画 B、用白醋泡制软皮鸡蛋 C、用钢丝球擦除灶具污渍 D、用汽油清洗衣服油污3. 下列实验现象描述正确的是( )A、镁条在空气中燃烧,发出白光,生成黑色固体 B、细铁丝在氧气中燃烧,火星四射,生成了四氧化三铁 C、铁锈与稀盐酸反应后溶液颜色由无色变成了黄色 D、将紫色石蕊试液滴入到稀氢氧化钠溶液中变红4. 从安全的角度考虑,下列做法不合理的是( )A、浓硫酸不慎沾到皮肤上,应立即用大量的水冲洗,再涂上氢氧化钠溶液 B、霉变的大米经洗净、高温蒸煮后也不能食用 C、冬天生炉子取暖时要注意通风,避免一氧化碳中毒 D、遇到火灾时,用湿毛巾捂住口鼻,蹲下靠近地面,迅速离开现场5. 空气是一种宝贵的自然资源。下列有关空气的说法错误的是( )A、氮气的化学性质不活泼,可用于食品的防腐 B、燃烧法测定空气中氧气的含量,不能用硫代替红磷 C、空气的成分按质量计算,氧气大约占21% D、禁止燃放烟花爆竹,可以减少空气污染6. “绿水青山就是金山银山”。下列物质的大量排放不违背该理念的是( )A、氮气 B、二氧化硫 C、固体粉尘 D、工业废水7. 纳米铁粉在空气中能自燃并生成一种红色氧化物。对比铁丝在空气中不能燃烧,而在氧气中能剧烈燃烧的事实,某同学得出的下列结论错误的是( )A、纳米铁粉在空气中自燃的产物不是四氧化三铁 B、相同的反应物在不同条件下生成物可能不同 C、有些物质燃烧时温度不需要达到着火点 D、反应物间的接触面积大小是反应能否发生的因素之一8. 分类是学习化学的重要方法。下列物质属于氧化物的是( )A、O2 B、H2O2 C、KCl D、H2SO49. 对下列事实的微观解释正确的是( )
2. 日常生活中的下列做法,一定含有化学变化的是( )A、用胶带粘合破损书画 B、用白醋泡制软皮鸡蛋 C、用钢丝球擦除灶具污渍 D、用汽油清洗衣服油污3. 下列实验现象描述正确的是( )A、镁条在空气中燃烧,发出白光,生成黑色固体 B、细铁丝在氧气中燃烧,火星四射,生成了四氧化三铁 C、铁锈与稀盐酸反应后溶液颜色由无色变成了黄色 D、将紫色石蕊试液滴入到稀氢氧化钠溶液中变红4. 从安全的角度考虑,下列做法不合理的是( )A、浓硫酸不慎沾到皮肤上,应立即用大量的水冲洗,再涂上氢氧化钠溶液 B、霉变的大米经洗净、高温蒸煮后也不能食用 C、冬天生炉子取暖时要注意通风,避免一氧化碳中毒 D、遇到火灾时,用湿毛巾捂住口鼻,蹲下靠近地面,迅速离开现场5. 空气是一种宝贵的自然资源。下列有关空气的说法错误的是( )A、氮气的化学性质不活泼,可用于食品的防腐 B、燃烧法测定空气中氧气的含量,不能用硫代替红磷 C、空气的成分按质量计算,氧气大约占21% D、禁止燃放烟花爆竹,可以减少空气污染6. “绿水青山就是金山银山”。下列物质的大量排放不违背该理念的是( )A、氮气 B、二氧化硫 C、固体粉尘 D、工业废水7. 纳米铁粉在空气中能自燃并生成一种红色氧化物。对比铁丝在空气中不能燃烧,而在氧气中能剧烈燃烧的事实,某同学得出的下列结论错误的是( )A、纳米铁粉在空气中自燃的产物不是四氧化三铁 B、相同的反应物在不同条件下生成物可能不同 C、有些物质燃烧时温度不需要达到着火点 D、反应物间的接触面积大小是反应能否发生的因素之一8. 分类是学习化学的重要方法。下列物质属于氧化物的是( )A、O2 B、H2O2 C、KCl D、H2SO49. 对下列事实的微观解释正确的是( )选项
事实
解释
A
金刚石的硬度远大于石墨
碳原子结构不同
B
蔗糖溶液不能导电
溶液中没有自由移动的粒子
C
6000L氧气在加压的情况下可装入容积为40L钢瓶中
氧分子变小了
D
稀盐酸、稀硫酸均显酸性
溶液中都含有氢离子
A、A B、B C、C D、D10. 如图是五种粒子的结构示意图,下列说法正确的是( ) A、①②属于同种元素 B、③⑤化学性质相似 C、②③④均表示离子 D、②④形成的化合物是MgCl11. 民间常用川乌、草乌泡制药酒。川乌、草乌含有少量有毒物质乌头碱(化学式为C34H47NO11),药酒使用不当会造成中毒。下列关于乌头碱的说法错误的是( )A、乌头碱由四种元素组成 B、乌头碱分子中C、H原子个数比为34:47 C、每个乌头碱分子由93个原子构成 D、乌头碱在空气中充分燃烧只生成CO2和H2O12. 豆腐是营养丰富的食物,每100 g豆腐中平均含磷119 mg。这里的“磷”指的是( )A、磷元素 B、磷单质 C、P2O5 D、磷的化合物13. 硼是作物生长必需的微量营养元素,硼元素的相关信息如图所示。下列有关硼的说法正确的是( )
A、①②属于同种元素 B、③⑤化学性质相似 C、②③④均表示离子 D、②④形成的化合物是MgCl11. 民间常用川乌、草乌泡制药酒。川乌、草乌含有少量有毒物质乌头碱(化学式为C34H47NO11),药酒使用不当会造成中毒。下列关于乌头碱的说法错误的是( )A、乌头碱由四种元素组成 B、乌头碱分子中C、H原子个数比为34:47 C、每个乌头碱分子由93个原子构成 D、乌头碱在空气中充分燃烧只生成CO2和H2O12. 豆腐是营养丰富的食物,每100 g豆腐中平均含磷119 mg。这里的“磷”指的是( )A、磷元素 B、磷单质 C、P2O5 D、磷的化合物13. 硼是作物生长必需的微量营养元素,硼元素的相关信息如图所示。下列有关硼的说法正确的是( )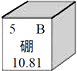 A、相对原子质量为10.81g B、属于金属元素 C、原子的核电荷数为5 D、原子核外有6个电子14. 生活饮用水的水质必须达到国家规定的相应指标。下列指标可通过过滤达到的是( )A、澄清 B、无异色 C、无异味 D、无细菌和病毒15. 某物质在9.6g氧气中恰好完全燃烧,只生成8.8gCO2和5.4gH2O,下列说法正确的是( )A、该物质一定含有碳、氢、氧三种元素 B、该物质只含碳、氢两种元素 C、该物质一定含有碳、氢元素,可能含有氧元素 D、无法确定16. 在密闭容器内,有甲、乙,丙、丁四种物质,在一定条件下充分混合反应,测得反应前后各物质的质量分数如图所示,下列说法错误的是( )
A、相对原子质量为10.81g B、属于金属元素 C、原子的核电荷数为5 D、原子核外有6个电子14. 生活饮用水的水质必须达到国家规定的相应指标。下列指标可通过过滤达到的是( )A、澄清 B、无异色 C、无异味 D、无细菌和病毒15. 某物质在9.6g氧气中恰好完全燃烧,只生成8.8gCO2和5.4gH2O,下列说法正确的是( )A、该物质一定含有碳、氢、氧三种元素 B、该物质只含碳、氢两种元素 C、该物质一定含有碳、氢元素,可能含有氧元素 D、无法确定16. 在密闭容器内,有甲、乙,丙、丁四种物质,在一定条件下充分混合反应,测得反应前后各物质的质量分数如图所示,下列说法错误的是( )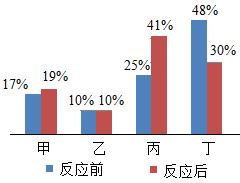 A、参加反应的丁的质量一定是生成甲和丙的质量之和 B、丁一定是化合物 C、生成的甲,丙两物质的质量比为8:1 D、乙可能是该反应的催化剂17. 三氧化二碳(化学式C2O3)通常情况下是一种无色无味气体,可溶于水,与水反应生成草酸,且常温下不稳定,其他的化学性质与一氧化碳相似。下列有关三氧化二碳说法错误的是( )A、在空气中完全燃烧的产物为二氧化碳 B、三氧化二碳化学式量为72 C、与氢氧化钠溶液反应可生成盐 D、C2O3中碳元素化合价为+4价18. 人们常在可燃物建筑材料中添加阻燃剂以防止火灾。Mg(OH) 2是一种常见的阻燃剂,在380℃时分解成水蒸气和耐高温的MgO,并吸收大量的热。下列说法错误的是( )A、Mg(OH)2分解吸热能降低可燃物的着火点 B、Mg(OH)2分解吸热能降低可燃物的温度 C、Mg(OH)2分解的产物能使可燃物与氧气隔绝 D、MgCO3比CaCO3易分解,也可作阻燃剂19. 食醋里通常含有3-5%的醋酸( CH3COOH),食醋与鸡蛋壳反应产生能使澄清石灰水变浑浊的气体。下列说法错误的是( )A、产生的气体是二氧化碳 B、加水稀释食醋,溶液pH变小 C、醋酸在水溶液里能解离出H+ D、不宜用铝制容器盛装食醋20. 某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,测得烧杯中溶液 pH 的变化如图所示。下列说法正确的是( )
A、参加反应的丁的质量一定是生成甲和丙的质量之和 B、丁一定是化合物 C、生成的甲,丙两物质的质量比为8:1 D、乙可能是该反应的催化剂17. 三氧化二碳(化学式C2O3)通常情况下是一种无色无味气体,可溶于水,与水反应生成草酸,且常温下不稳定,其他的化学性质与一氧化碳相似。下列有关三氧化二碳说法错误的是( )A、在空气中完全燃烧的产物为二氧化碳 B、三氧化二碳化学式量为72 C、与氢氧化钠溶液反应可生成盐 D、C2O3中碳元素化合价为+4价18. 人们常在可燃物建筑材料中添加阻燃剂以防止火灾。Mg(OH) 2是一种常见的阻燃剂,在380℃时分解成水蒸气和耐高温的MgO,并吸收大量的热。下列说法错误的是( )A、Mg(OH)2分解吸热能降低可燃物的着火点 B、Mg(OH)2分解吸热能降低可燃物的温度 C、Mg(OH)2分解的产物能使可燃物与氧气隔绝 D、MgCO3比CaCO3易分解,也可作阻燃剂19. 食醋里通常含有3-5%的醋酸( CH3COOH),食醋与鸡蛋壳反应产生能使澄清石灰水变浑浊的气体。下列说法错误的是( )A、产生的气体是二氧化碳 B、加水稀释食醋,溶液pH变小 C、醋酸在水溶液里能解离出H+ D、不宜用铝制容器盛装食醋20. 某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,测得烧杯中溶液 pH 的变化如图所示。下列说法正确的是( )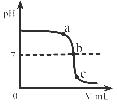 A、a 点所示溶液呈酸性 B、向 b 点所示溶液中滴加石蕊溶液,溶液呈紫色 C、该实验是将 NaOH 溶液逐滴滴入稀硫酸中 D、c 点所示溶液中,含有的溶质是 Na2SO4和 NaOH
A、a 点所示溶液呈酸性 B、向 b 点所示溶液中滴加石蕊溶液,溶液呈紫色 C、该实验是将 NaOH 溶液逐滴滴入稀硫酸中 D、c 点所示溶液中,含有的溶质是 Na2SO4和 NaOH二、填空题
-
21. 建立宏观与微观之间联系,是化学学科特有的思维方式。请回答相关问题:(1)、下图是元素周期表的一部分,图
 表示图中处元素的原子结构示意图(填序号),在化学反应中该原子易电子(填“得到”或“失去”)。下图①、②、④三处元素中,与③处元素属于同一周期的是(填序号)。
表示图中处元素的原子结构示意图(填序号),在化学反应中该原子易电子(填“得到”或“失去”)。下图①、②、④三处元素中,与③处元素属于同一周期的是(填序号)。 (2)、工业上常将煤洗选加工后用于制备水煤气,其主要反应的微观示意图如下:
(2)、工业上常将煤洗选加工后用于制备水煤气,其主要反应的微观示意图如下:
①写出该反应的化学方程式。
②在该反应中,化合价升高的元素是(填元素符号,下同),化合价降低的元素是。
22. 味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式是 C5H8NO4Na,易溶于水,与AgNO3不反应),另外还含有NaCl,其它成分不考虑。请回答下列问题:(1)、味精中至少含有(填数字)种元素。(2)、称取5.0g味精配制成50g溶液,量取蒸馏水的量筒规格是____(填字母)。A、5mL B、10 mL C、50 mL D、100 mL(3)、下图是配制过程,正确的操作顺序为____(填字母)。 A、①②③④ B、②①④③ C、②④①③(4)、为测定NaCl在味精中的质量分数,进行如下实验:
A、①②③④ B、②①④③ C、②④①③(4)、为测定NaCl在味精中的质量分数,进行如下实验:①查阅资料知:
②向所配制的50g溶液中加入AgNO3溶液充分反应,检验沉淀是否完全的方法是:静置后,在上层清液中继续加入溶液,观察是否有沉淀生成。
③精确测定AgCl沉淀质量为2.87g,则该味精中NaCl的质量分数为。
23. 将足量的碳酸钙加入到盛有40mL稀盐酸的烧杯中,立即将烧杯放在天平上称量。在以后的8min内,每一分钟读一次数。结果如下:时间/min
0
1
2
3
4
5
6
7
8
质量/g
92.0
91.0
90.5
90.2
90.1
90.4
90.1
90.1
90.1
(1)、盛有反应物的烧杯质量减少的原因是。(2)、表中有一个结果是不合理的,该结果的测得时间是第分钟。三、综合题
-
24. 结合下图所示实验,回答下列问题:
 (1)、在实验一中,水能够吸收有毒的;(2)、由实验二可知,CO2具有的物理性质是;(3)、在实验三中,铜片上的白磷燃烧,红磷不燃烧,由此能够得出燃烧的条件之一是。25. 现有石灰石、稀盐酸、火柴、药匙、升降台、木条、棉花、镊子及以下仪器:
(1)、在实验一中,水能够吸收有毒的;(2)、由实验二可知,CO2具有的物理性质是;(3)、在实验三中,铜片上的白磷燃烧,红磷不燃烧,由此能够得出燃烧的条件之一是。25. 现有石灰石、稀盐酸、火柴、药匙、升降台、木条、棉花、镊子及以下仪器: (1)、制取和收集二氧化碳,选择的仪器有①和(填序号),还需补充的仪器是(填名称)。(2)、用上述药品制取二氧化碳的反应化学方程式为。(3)、将生成的气体通入澄清石灰水中,始终未见浑浊。为了弄清原因,他设计以下方案,进行探究、验证,请你帮他补充完整以下内容。
(1)、制取和收集二氧化碳,选择的仪器有①和(填序号),还需补充的仪器是(填名称)。(2)、用上述药品制取二氧化碳的反应化学方程式为。(3)、将生成的气体通入澄清石灰水中,始终未见浑浊。为了弄清原因,他设计以下方案,进行探究、验证,请你帮他补充完整以下内容。问题猜想
实验步骤
实验现象
实验结论
原因一:石灰水已完全变质
取少量未通入CO2的澄清石灰水于试管中,向试管中滴加溶液。
(填“有”或“没有”)沉淀生成
猜想的原因二正确
原因二:产生的CO2中带有HCl气体
将盐酸与石灰石反应生成的气体通入溶液中、
(填“有’或“没有”)沉淀生成
26. 请利用氧气的相关知识回答下列问题: (1)、实验室用如图所示的装置制取少量氧气。
(1)、实验室用如图所示的装置制取少量氧气。①仪器a、仪器b的名称分别是。
②锥形瓶内发生反应的化学方程式是。
(2)、工业上有多种制取氧气的方法,如:方法一:在低温、加压条件下,将空气液化。然后将温度升高至-196℃—-183℃之间,使液态氮气先蒸发,剩余液态氧气储存于钢瓶里。
方法二:利用电解水的方法制取氧气,将得到的氧气干燥。在低温、加压条件下,使之转化为液态,储存于钢瓶里。
①从构成物质的微粒视角分析,在方法一空气液化过程中,主要改变的是。
②某工厂用方法二制取氧气,发现氧气的产量略小于理论值,且所得氧气中有淡淡的鱼腥气味。从元素守恒角度分析,该鱼腥气味的气体是。
(3)、氢气和氧气在Pd基催化剂表面可反应生成H2O2 , 其微观示意图如图所示:
“解离”时,结构被破坏的分子是(填化学式)。
(4)、为探究氯化物对双氧水分解的影响,进行以下实验:反应条件:6.0mL30%双氧水,0.1g氯化物,室温:实验时间:1.5h。实验数据如表所示。由表可知,双氧水保存时应绝对避免引入的离子是(写离子符号)。
氯化物
NaCl
MgCl2
CuCl2
放出氧气的体积/mL
2.0
4.0
420.0
双氧水的分解率/%
0.30
0.60
63.18
四、计算题
-
27. 某化工厂排放的污水中HCl的质量分数为0.003%,用成本较低的石灰水中和处理。现有1.0×106kg污水,至少需要Ca(OH)2kg(结果保留1位小数)能将HCl完全中和。(污水中其他物质均不与Ca(OH)2反应)28. 为测定某石灰石样品中碳酸钙的质量分数,取2.0g石灰石样品于烧杯中,将20g稀盐酸分4次加入样品中,充分反应后经过滤、干燥、称重,得实验数据如下:
第一次
第二次
第三次
第四次
稀盐酸的用量/g
5.0
5.0
5.0
5.0
剩余固体的质量/g
1.5
1.0
0.5
0.3
(1)、样品中碳酸钙的质量分数为;(2)、求所加稀盐酸的溶质质量分数(写出计算过程)。