山东省东营市广饶县2021-2022学年九年级上学期期末化学试题
试卷更新日期:2022-02-13 类型:期末考试
一、单选题
-
1. 东营市“小蓝桶”助力垃圾分类进校园项目正在推广。下列垃圾不能投放到可回收物垃圾桶内的是( )A、废口罩 B、塑料矿泉水瓶 C、废纸 D、铝制饮料罐2. “关爱生命、注意安全、拥抱健康”是永恒的主题。下列叙述正确的是( )A、人体缺钙易引起甲状腺肿大 B、可用灼烧的方法鉴别蛋白粉与淀粉 C、用pH试纸测得血液的pH为7.35-7.45,则说明此人身体健康 D、被蚊虫叮咬后,可以涂抹一些含有碱性的物质的溶液,如氢氧化钠溶液3. 中国高铁在短短的几十年从“跟跑”到“领跑”,成为我国科学技术自主创新的一面旗帜,“有一种骄傲叫做中国高铁”,在骄傲的同时看看你对其中蕴含的化学知识了解多少!下列说法错误的是( )
 A、高铁的普及拉近了城市的距离,带动了沿途经济的发展 B、铺设高铁的轨道,常常用到韧性好、硬度大的不锈钢 C、高铁的建造使用了大量的合金,合金属于金属材料 D、高铁列车车体材料使用了含镍不锈钢,工业上火法炼镍的原理是:该反应属于置换反应。4. 下列说法正确的是( )A、均一、稳定的液体都是溶液 B、溶质均以离子形式分散到溶剂中 C、同一温度下,硝酸钾的饱和溶液比不饱和溶液溶质质量分数大 D、饱和溶液析出晶体后溶质质量分数一定变小5. 把质量分数相同的稀硫酸分别滴加到装有甲、乙、丙三种金属的试管中,只有乙表面产生气泡;再把甲和丙的金属丝分别插入硫酸铜溶液中,甲表面有红色物质析出,丙表面无明显现象。三种金属的活动性顺序为( )A、甲>乙>丙 B、丙>甲>乙 C、丙>乙>甲 D、乙>甲>丙6. 某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像,如图所示。下列说正确的是( )
A、高铁的普及拉近了城市的距离,带动了沿途经济的发展 B、铺设高铁的轨道,常常用到韧性好、硬度大的不锈钢 C、高铁的建造使用了大量的合金,合金属于金属材料 D、高铁列车车体材料使用了含镍不锈钢,工业上火法炼镍的原理是:该反应属于置换反应。4. 下列说法正确的是( )A、均一、稳定的液体都是溶液 B、溶质均以离子形式分散到溶剂中 C、同一温度下,硝酸钾的饱和溶液比不饱和溶液溶质质量分数大 D、饱和溶液析出晶体后溶质质量分数一定变小5. 把质量分数相同的稀硫酸分别滴加到装有甲、乙、丙三种金属的试管中,只有乙表面产生气泡;再把甲和丙的金属丝分别插入硫酸铜溶液中,甲表面有红色物质析出,丙表面无明显现象。三种金属的活动性顺序为( )A、甲>乙>丙 B、丙>甲>乙 C、丙>乙>甲 D、乙>甲>丙6. 某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像,如图所示。下列说正确的是( )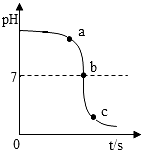 A、由a点到c点溶液温度下降 B、图中a点所示溶液中,含有的溶质是Na2SO4和NaOH C、该实验是将氢氧化钠溶液逐滴滴入到盛有硫酸的烧杯中 D、c点对应溶液中硫酸钠的质量大于b点7. 逻辑推理是化学学习中常用的一种思维方法。现有以下推理,其中正确的是( )A、碱溶液呈碱性,碱性溶液一定是碱溶液 B、活泼金属能与稀硫酸反应放出气体,则能与稀硫酸反应放出气体的物质一定是活泼金属 C、酸溶液能使石蕊溶液变红,所以能使石蕊变红的溶液一定显酸性 D、用洗洁精洗油污是乳化作用,用汽油洗油污也是乳化作用8. 某实验小组进行“配制117g10%的氯化钠溶液”实验活动时出现了以下错误操作,其中不影响所配溶液溶质质量分数的是( )
A、由a点到c点溶液温度下降 B、图中a点所示溶液中,含有的溶质是Na2SO4和NaOH C、该实验是将氢氧化钠溶液逐滴滴入到盛有硫酸的烧杯中 D、c点对应溶液中硫酸钠的质量大于b点7. 逻辑推理是化学学习中常用的一种思维方法。现有以下推理,其中正确的是( )A、碱溶液呈碱性,碱性溶液一定是碱溶液 B、活泼金属能与稀硫酸反应放出气体,则能与稀硫酸反应放出气体的物质一定是活泼金属 C、酸溶液能使石蕊溶液变红,所以能使石蕊变红的溶液一定显酸性 D、用洗洁精洗油污是乳化作用,用汽油洗油污也是乳化作用8. 某实验小组进行“配制117g10%的氯化钠溶液”实验活动时出现了以下错误操作,其中不影响所配溶液溶质质量分数的是( )
A、 氯化钠放在右盘
B、
氯化钠放在右盘
B、 氯化钠洒出
C、
氯化钠洒出
C、 俯视读数
D、
俯视读数
D、 配好溶液装瓶时溅出
9. 如图所示装置,将X滴加到Y中,U形管中的液面变得左高低右,则X、Y对应的试剂组可行的是( )
配好溶液装瓶时溅出
9. 如图所示装置,将X滴加到Y中,U形管中的液面变得左高低右,则X、Y对应的试剂组可行的是( )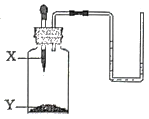
选项试剂
A
B
C
D
X
H2O
H2O
H2O
盐酸
Y
NaOH
NH4NO3
生石灰
Na2CO3
A、A B、B C、C D、D10. 一定质量的Zn加入到含有Fe(NO3)2和AgNO3两种物质的混合溶液中,充分反应后过滤液仍为浅绿色,下列叙述正确的是( )①滤液中一定有Zn2+、Fe2+
②滤液中可能有Ag+
③滤渣中一定有Ag,可能有Fe
A、①② B、①③ C、②③ D、①②③11. 除去下列物质中混有的少量杂质(括号内为杂质),所选用的操作方法正确的是( )A、炭粉(铁粉)-------- 将固体粉末在空气中灼烧 B、CaO (CaCO3) -----------加水,过滤 C、CO2 (CO) ---------------将气体点燃 D、HNO3 [Ba (NO3) 2]----------------加入适量的 H2SO4溶液12. 如图中所有物质的类别均不同,连线两端的物质常温下均能反应。下列说法正确的是( ) A、X、Y、Z分别属于碱、盐、酸 B、X和Z可以是Al2O3和CaCl2 C、Y和Z可以是Na2CO3和Ca(OH)2 D、X和Y可以是NaCl和NaOH
A、X、Y、Z分别属于碱、盐、酸 B、X和Z可以是Al2O3和CaCl2 C、Y和Z可以是Na2CO3和Ca(OH)2 D、X和Y可以是NaCl和NaOH二、填空题
-
13. 化学在健康、能源、材料、资源等领域发挥着不可替代的作用。(1)、新冠肺炎疫情期间,全民变大厨。小明制作了一份早餐,有烤面包、炒鸡蛋、鲜牛奶,从营养均衡的角度分析,还应该补充的食物是(答一点即可)。(2)、我国已经开发推广使用一种车用乙醇汽油,这种乙醇汽油燃烧产生的废气对环境污染较小。写出乙醇充分燃烧的化学方程式:。(3)、2020年6月11日,我国在太原卫星发射中心用长征二号丙运载火箭,成功将海洋一号D卫星送入预定轨道。制造火箭的某些机器零件使用了硬铝,硬铝是铝、铜、镁和硅的合金。硬铝属于(填字母序号)。
A 复合材料
B 有机合成材料
C 金属材料
(4)、铁生锈是铁与等发生化学反应的过程,每年因此浪费掉的金属材料数量惊人。防止金属腐蚀是保护金属资源的有效途径,请再写出与另一种途径:。14. 人类对材料的发现和使用经历了从石器、青铜器,铁器到铝的大规模使用等漫长的征程。请回答:(1)、人类获得铜、铁,铝的先后顺序与密切相关。(2)、大部分金属可以压成薄片,抽成细丝,说明金属具有性。(3)、金属腐蚀造成的损失巨大,下列对金属的防护措施合理的是。(填序号)a齿轮表面涂油 b将钢材深埋保存 c将钢刀浸泡在盐水中 d车圈镀铬
(4)、我国是最早采用湿法冶铜的国家。文献记载“胆铜法”:用铁与“胆水”(含CuSO4)反应获得铜,该反应的化学方程式为。15. 图1是三种常见物质的溶解度曲线。请回答以下问题。
 (1)、由图1可知,同质量的三种物质的饱和溶液由50℃降温到10℃时,析出晶体质量最多的物质是(填名称)。(2)、图1所示三种物质中溶解度随温度升高而减小的物质(填名称)。(3)、若硝酸钾固体中混有少量氯化钠、提纯硝酸钾的方法是(选填“降温结晶”“蒸发结晶”)。(4)、现有40℃时等质量的硝酸钾、氯化钠的饱和溶液,加热蒸发等质量的水后恢复至40℃,剩余溶液的质量关系大小为硝酸钾的氯化钠的(选填“>”、“=”或“<”)。(5)、若a、b、c分別代表上述三种物质,图2是在室温下,烧杯中a物质的溶液、试管①中b物质的溶液和试管②中c物质的溶液的状态。当从室温升至60℃时,发现烧杯中a物质没有明显变化,试管①中b物质全部溶解,试管②中有c物质析出,写出a、b、c三种物质的化学式:a , b , c。(6)、20℃时,欲测定Ca(OH)2溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则所测溶液的pH(填“偏大”、“偏小”或“不受影响”)。16. 归纳是学习的重要方法,小芳在复习盐酸的性质时,归纳出盐酸的五条化学性质(如图1所示,连线表示相互反应);小明为表示反应实质绘制图2、图3.请根据图示和要求回答问题:
(1)、由图1可知,同质量的三种物质的饱和溶液由50℃降温到10℃时,析出晶体质量最多的物质是(填名称)。(2)、图1所示三种物质中溶解度随温度升高而减小的物质(填名称)。(3)、若硝酸钾固体中混有少量氯化钠、提纯硝酸钾的方法是(选填“降温结晶”“蒸发结晶”)。(4)、现有40℃时等质量的硝酸钾、氯化钠的饱和溶液,加热蒸发等质量的水后恢复至40℃,剩余溶液的质量关系大小为硝酸钾的氯化钠的(选填“>”、“=”或“<”)。(5)、若a、b、c分別代表上述三种物质,图2是在室温下,烧杯中a物质的溶液、试管①中b物质的溶液和试管②中c物质的溶液的状态。当从室温升至60℃时,发现烧杯中a物质没有明显变化,试管①中b物质全部溶解,试管②中有c物质析出,写出a、b、c三种物质的化学式:a , b , c。(6)、20℃时,欲测定Ca(OH)2溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则所测溶液的pH(填“偏大”、“偏小”或“不受影响”)。16. 归纳是学习的重要方法,小芳在复习盐酸的性质时,归纳出盐酸的五条化学性质(如图1所示,连线表示相互反应);小明为表示反应实质绘制图2、图3.请根据图示和要求回答问题: (1)、图1中为了验证性质①,小红将紫色石蕊试液滴加到盐酸溶液中,溶液变色。(2)、图1中A所表示的物质类别是。(3)、图1中盐酸的性质③决定了盐酸可用于清除铁锈,该反应的化学方程式是。(4)、图2描述了氢氧化钠溶液与盐酸反应的微观实质,该反应的基本反应类型为 , 图中A、B、C处应填入的化学式或离子符号依次为、、。(5)、图3镁与稀盐酸反应过程的微观示意图,从微观角度看,该反应有效相互作用的微粒是(写微粒符号,下同),产生的新微粒是。(6)、不同酸具有相似的性质,但性质也存在差异。稀盐酸不能与氯化钡溶液反应,而稀硫酸却能与其反应,从物质组成的角度分析,原因是。
(1)、图1中为了验证性质①,小红将紫色石蕊试液滴加到盐酸溶液中,溶液变色。(2)、图1中A所表示的物质类别是。(3)、图1中盐酸的性质③决定了盐酸可用于清除铁锈,该反应的化学方程式是。(4)、图2描述了氢氧化钠溶液与盐酸反应的微观实质,该反应的基本反应类型为 , 图中A、B、C处应填入的化学式或离子符号依次为、、。(5)、图3镁与稀盐酸反应过程的微观示意图,从微观角度看,该反应有效相互作用的微粒是(写微粒符号,下同),产生的新微粒是。(6)、不同酸具有相似的性质,但性质也存在差异。稀盐酸不能与氯化钡溶液反应,而稀硫酸却能与其反应,从物质组成的角度分析,原因是。三、综合题
-
17. 二十一世纪是海洋开发与利用的世纪,我市实施黄蓝两大国家战略形成新的发展格局,海洋化学资源的综合利用体现了人类利用和改造自然的智慧,请根据流程图(如下图)回答问题:
 (1)、海水晒盐:将海水引入蒸发池,经日晒蒸发到一定程度时,导入结晶池,继续日晒,海水就会成为食盐的饱和溶液,再晒就会逐渐析出粗盐,剩余的液体称为母液(也称卤水)。
(1)、海水晒盐:将海水引入蒸发池,经日晒蒸发到一定程度时,导入结晶池,继续日晒,海水就会成为食盐的饱和溶液,再晒就会逐渐析出粗盐,剩余的液体称为母液(也称卤水)。I、海水晒盐的原理为
Ⅱ、除去粗盐中难溶性杂质,要经过溶解、、等三部操作。
(2)、海水制镁:海水晒盐后,以其母液(卤水)和贝壳(主要成分是)为原料制镁;a、步骤III所加的碱应该是(选填“氢氧化钠”或“石灰乳”),
b、步骤IV反应的化学方程式是。
c、若要验证镁、铁、铜的活动性顺序,选择铁丝后,还要选择、两种溶液。
(3)、关于海水“制碱"中得到的“碱”的成分,甲同学认为是氢氧化钠,乙同学认为是碳酸钠,为确定这个“碱”是氢氧化钠还是碳酸钠,甲、乙同学各做了以下两个实验:①甲同学向“碱”溶液中加入酚酞,观察到酚酞变红,于是认为“碱”是氢氧化钠。
②乙同学向“碱”溶液中加入硝酸钙溶液,产生白色沉淀,于是认为“碱”是碳酸钠。你同意(填“甲”或“乙”)同学的观点,请指出另一个同学实验的不合理之处。写出步骤V反应的化学方程式;
18. 某小组利用下图装置探究碳的氧化物的性质(固定装置略)。
(资料)
二氧化碳()能与氢氧化钠(NaOH)溶液发生化学反应;无水硫酸铜)能吸收水)。
(1)、装置A中加热仪器的名称为 , B处发生反应的化学方程式为;实验时先点燃处(填“A”或“D”)加热仪器。(2)、装置D玻璃管中发生反应的化学方程式为;若D装置中发生完全反应,反应前后装置总质量减少了2.4g,则参加化学反应的质量为g。(3)、装置E的作用是。(4)、从保护环境的角度分析,本实验的不足是。四、计算题
-
19. 在一烧杯中盛有11.4 g Na2CO3和 NaCl 组成的固体混合物,向其中逐渐滴加溶质质分数为10%的稀盐酸。放出气体的总质量与所滴入稀盐酸的质量关系曲线如下图所示,请根据题意回答问题:
 (1)、当滴加稀盐酸至图中 B 点时,烧杯中溶液的 pH7(填>、=、<)。此刻,溶液中的溶质是。(2)、当滴加稀盐酸至图中A点时,烧杯中为不饱和溶液(常温),通过计算求出原混合物中碳酸钠的质量分数。(计算结果保留 0.1%)
(1)、当滴加稀盐酸至图中 B 点时,烧杯中溶液的 pH7(填>、=、<)。此刻,溶液中的溶质是。(2)、当滴加稀盐酸至图中A点时,烧杯中为不饱和溶液(常温),通过计算求出原混合物中碳酸钠的质量分数。(计算结果保留 0.1%)