高中化学人教版(2019)必修第二册第六章 化学反应与能量 单元测试
试卷更新日期:2022-02-07 类型:单元试卷
一、单选题
-
1. 下列反应中既属于氧化还原反应又属于放热反应的是( )A、氢氧化钾与硫酸的反应 B、碳酸钠与盐酸反应放出气体 C、镁条在空气中燃烧 D、Ba(OH)2•8H2O与NH4Cl反应2. 下列关于化学反应与能量变化的说法正确的是( )A、有能量的变化一定发生了化学反应 B、化学反应中一定有新共价键的形成 C、吸热反应都需要加热才能发生 D、化学反应的能量变化取决于反应物总能量与生成物总能量的相对大小3. 根据反应:M+H2SO4=MSO4+H2↑,可设计成如图所示的原电池,则电极材料M可选用( )
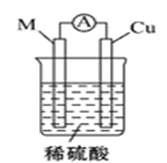 A、Zn B、Cu C、Ag D、石墨4. 下列因素不可能影响化学平衡移动的是( )A、温度 B、催化剂 C、反应物的浓度 D、压强5. 已知反应:为吸热反应,对该反应的下列说法中正确的是( )A、A的能量一定高于C B、B的能量一定低于D C、A和B的总能量一定低于C和D的总能量 D、因为该反应为吸热反应,故必须加热反应才可以发生6. 某化学反应的能量变化如图所示,下列说法错误的是( )
A、Zn B、Cu C、Ag D、石墨4. 下列因素不可能影响化学平衡移动的是( )A、温度 B、催化剂 C、反应物的浓度 D、压强5. 已知反应:为吸热反应,对该反应的下列说法中正确的是( )A、A的能量一定高于C B、B的能量一定低于D C、A和B的总能量一定低于C和D的总能量 D、因为该反应为吸热反应,故必须加热反应才可以发生6. 某化学反应的能量变化如图所示,下列说法错误的是( )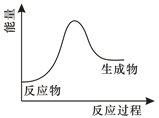 A、该反应可能不需要加热就能够发生 B、该反应断键吸收的总能量大于成键释放的总能量 C、该反应可能是化合反应,也可能是分解反应 D、该反应的化学方程式可能为 2Al+Fe2O3 Al2O3+2Fe7. 已知化学反应的能量变化曲线如图所示。
A、该反应可能不需要加热就能够发生 B、该反应断键吸收的总能量大于成键释放的总能量 C、该反应可能是化合反应,也可能是分解反应 D、该反应的化学方程式可能为 2Al+Fe2O3 Al2O3+2Fe7. 已知化学反应的能量变化曲线如图所示。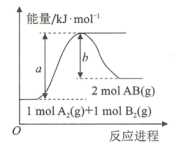
下列叙述错误的是能量( )
A、反应物的总能量低于生成物的总能量 B、生成1molAB需吸收(a-b)kJ的热量 C、 D、加入催化剂不会改变该反应的反应热8. 由Fe和Pt构成的原电池装置如图所示,下列叙述正确的是( )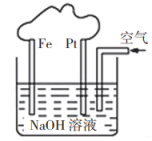 A、该装置中Pt为正极,电极反应为 B、该装置中Fe为负极,电极反应为 C、溶液中向Fe极移动 D、该原电池装置的最终产物是9. 下列有关装置的说法正确的是( )
A、该装置中Pt为正极,电极反应为 B、该装置中Fe为负极,电极反应为 C、溶液中向Fe极移动 D、该原电池装置的最终产物是9. 下列有关装置的说法正确的是( )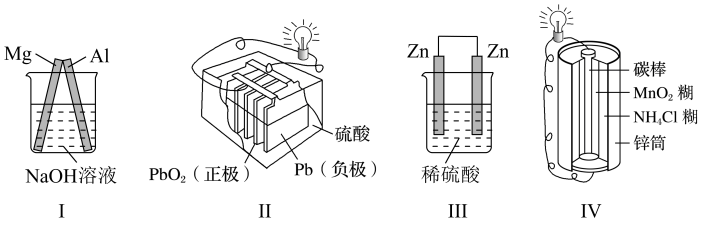 A、装置Ⅰ中为原电池的负极 B、装置Ⅱ为一次电池 C、装置Ⅲ可构成原电池 D、装置Ⅳ工作时,电子由锌通过导线流向碳棒10. 低温脱氮技术可用于处理废弃中的氮氧化物。发生的化学反应为:4NH3(g)+6NO(g)5N2(g)+6H2O(g)+Q。在恒容密闭容器中,下列说法正确的是( )A、该反应是放热反应,降低温度将缩短反应达到平衡的时间 B、其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 C、4mol氨气与足量的NO充分反应,放出的热量为Q D、增大压强,正逆反应速率都增大,平衡逆向移动11. 某反应的反应物A的浓度在3 min内由9 mol·L-1变成6 mol·L-1 , 则以A物质表示该反应在这段时间内的反应速率是( )A、1.2 mol·L-1·min-1 B、2 mol·L-1·min-1 C、0.8 mol·L-1·min-1 D、1 mol·L-1·min-112. 在带有活塞的密闭容器中发生反应∶。采取下列措施不能改变反应速率的是( )A、增加氧化铁的用量 B、恒温恒容时,向容器中通入氢气 C、适当提高反应温度 D、将块状氧化铁粉碎成粉末13. 下列有关化学反应速率说法正确的是( )A、在一恒温恒容的密闭容器中,发生 的催化氧化反应,充入He,压强增大,反应速率不变 B、0.1mol/L的 溶液与0.3mol/L的KSCN溶液等体积混合,加入适量的氯化钠溶液,不影响化学反应速率 C、合成 的反应是一个分子总数减小反应,增大压强,正反应速率加快,逆反应速率减慢,平衡正向移动 D、用铁片和稀硫酸反应制取氢气时,增大硫酸的浓度一定可以加快产生氢气的速率
A、装置Ⅰ中为原电池的负极 B、装置Ⅱ为一次电池 C、装置Ⅲ可构成原电池 D、装置Ⅳ工作时,电子由锌通过导线流向碳棒10. 低温脱氮技术可用于处理废弃中的氮氧化物。发生的化学反应为:4NH3(g)+6NO(g)5N2(g)+6H2O(g)+Q。在恒容密闭容器中,下列说法正确的是( )A、该反应是放热反应,降低温度将缩短反应达到平衡的时间 B、其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 C、4mol氨气与足量的NO充分反应,放出的热量为Q D、增大压强,正逆反应速率都增大,平衡逆向移动11. 某反应的反应物A的浓度在3 min内由9 mol·L-1变成6 mol·L-1 , 则以A物质表示该反应在这段时间内的反应速率是( )A、1.2 mol·L-1·min-1 B、2 mol·L-1·min-1 C、0.8 mol·L-1·min-1 D、1 mol·L-1·min-112. 在带有活塞的密闭容器中发生反应∶。采取下列措施不能改变反应速率的是( )A、增加氧化铁的用量 B、恒温恒容时,向容器中通入氢气 C、适当提高反应温度 D、将块状氧化铁粉碎成粉末13. 下列有关化学反应速率说法正确的是( )A、在一恒温恒容的密闭容器中,发生 的催化氧化反应,充入He,压强增大,反应速率不变 B、0.1mol/L的 溶液与0.3mol/L的KSCN溶液等体积混合,加入适量的氯化钠溶液,不影响化学反应速率 C、合成 的反应是一个分子总数减小反应,增大压强,正反应速率加快,逆反应速率减慢,平衡正向移动 D、用铁片和稀硫酸反应制取氢气时,增大硫酸的浓度一定可以加快产生氢气的速率二、综合题
-
14. 下图是 反应过程中的能量变化图。
 (1)、由图可知, 和 的总能量(填“>”、“<”或者“=”) 2 mol HCl(g)的能量。(2)、该反应是(填“吸”或者 “放”)热反应.15. 依据化学能与热能的相关知识回答下列问题:
(1)、由图可知, 和 的总能量(填“>”、“<”或者“=”) 2 mol HCl(g)的能量。(2)、该反应是(填“吸”或者 “放”)热反应.15. 依据化学能与热能的相关知识回答下列问题:Ⅰ.共价键的键能是指形成1mol某种共价键的过程中所放出的能量或断裂1mol某种共价键的过程中所吸收的能量。显然共价键的键能越大,该共价键越牢固,含有该共价键的分子越稳定。如H—H键的键能是436kJ·mol-1 , 是指使1molH2分子变成2molH原子需要吸收436kJ能量。
(1)、已知H—O键的键能为463kJ·mol-1 , 下列叙述正确的是__(填标号,下同)。A、每形成1molH—O键吸收463kJ能量 B、每形成1molH—O键放出463kJ能量 C、每断裂1molH—O键吸收463kJ能量 D、每断裂1molH—O键放出463kJ能量(2)、已知键能:H—H键为436kJ·mol-1;H—F键为565kJ·mol-1;H—Cl键为431kJ·mol-1;H—Br键为366kJ·mol-1 , 则下列分子受热时最稳定的是__。A、HF B、HCl C、HBr D、H2(3)、Ⅱ.已知化学反应N2H4(g)+O2(g)=N2(g)+2H2O(g)的能量变化如图所示,回答下列问题: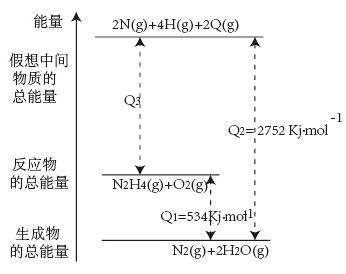
1molN2H4(g)和1molO2(g)生成2molN原子、4molH原子、2molO原子的过程中(填“吸收”或“放出”)kJ能量。
(4)、1molN2H4(g)和1molO2(g)生成1molN2(g)和2molH2O(g)的反应中(填“吸收”或“放出”)kJ能量。(5)、Ⅲ.已知A、B、C、D均为气体,其能量变化如图: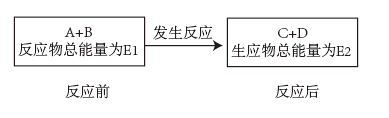
若E1>E2 , 则该反应为(填“放热反应”或“吸热反应”)。
(6)、下列有关反应A+B=C+D的说法正确的是 (填标号)。A、反应前后原子的种类和数目一定不变 B、该反应若有热量变化,则一定是氧化还原反应 C、若该反应为放热反应,则不需要加热该反应就一定能进行 D、反应物的总质量、总能量与生成物的总质量、总能量均相等16.(1)、利用原电池装置可以验证Fe3+与Cu2+氧化性相对强弱,如图所示。写出该氧化还原反应的离子方程式:。该装置中的负极材料是(填化学式),正极反应式是。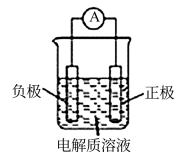 (2)、某研究性学习小组为证明为可逆反应,设计如下两种方案(已知:酸性溶液中Fe2+易被空气氧化为Fe3+)。
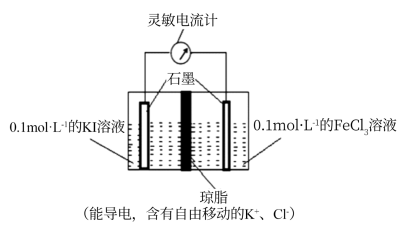
(2)、某研究性学习小组为证明为可逆反应,设计如下两种方案(已知:酸性溶液中Fe2+易被空气氧化为Fe3+)。方案一:取5mL0.1mol/LKI溶液,滴加2mL0.1mol/L的FeCl3济液,滴入5滴稀盐酸,再继续加入2mLCCl4 , 充分振荡、静置、分层,取上层清液,滴加KSCN溶液,现象是 , 即可证明该反应为可逆反应。你认为此方案(“不严密”或“严密”),理由是(用离子方程式表示)。
方案二:设计如图原电池装置,接通灵敏电流计,指针向右偏转,随着反应时间进行;电流计读数逐渐变小,最后读数变为零。当指针读数变零后,在右边的池了中加入1mol/L FeCl2溶液,灵敏电流计指针向左偏转,即可证明该反应为可逆反应。你认为灵敏电流计“读数变为零”的原因是。
 17. 近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。现在实验室中模拟甲醇合成反应,在2 L密闭容器内,400℃时发生反应:CO(g)+2H2(g) CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:
17. 近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。现在实验室中模拟甲醇合成反应,在2 L密闭容器内,400℃时发生反应:CO(g)+2H2(g) CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:时间(s)
0
1
2
3
5
n(CH3OH)(mol)
0
0.009
0.012
0.013
0.013
(1)、图中表示CH3OH的浓度变化的曲线是(填字母)。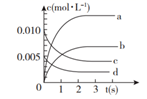 (2)、用H2表示从0~2s内该反应的平均速率v(H2)=。随着反应的进行,该反应的速率逐渐减慢的原因是。(3)、该反应是一个放热反应,说明该反应中破坏1 mol CO和2 mol H2的化学键吸收的能量形成1mol CH3OH释放的能量(填“<”、“=”或“>”)。(4)、已知在400℃时,反应CO(g)+2H2(g) CH3OH(g)生成1 mol CH3OH(g),放出的热量为116 kJ。计算上述反应达到平衡时放出的热量Q=kJ。(5)、甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。电池的总反应式为:2CH3OH+3O2+4OH-=2 +6H2O
(2)、用H2表示从0~2s内该反应的平均速率v(H2)=。随着反应的进行,该反应的速率逐渐减慢的原因是。(3)、该反应是一个放热反应,说明该反应中破坏1 mol CO和2 mol H2的化学键吸收的能量形成1mol CH3OH释放的能量(填“<”、“=”或“>”)。(4)、已知在400℃时,反应CO(g)+2H2(g) CH3OH(g)生成1 mol CH3OH(g),放出的热量为116 kJ。计算上述反应达到平衡时放出的热量Q=kJ。(5)、甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。电池的总反应式为:2CH3OH+3O2+4OH-=2 +6H2O则电池放电时通入空气的电极为(“正”或“负”)极;从电极反应来看,每消耗1 mol CH3OH转移mol电子。
18. 某化学科研小组研究在其他条件不变时,改变某一反应条件对反应[可用aA(g)+bB(g) cC(g)表示]化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,φ表示体积分数):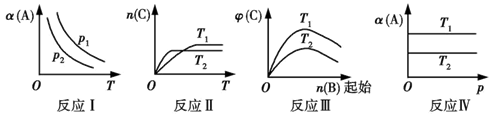 (1)、在反应Ⅰ中,若p1>p2 , 则此正反应为(填“吸热”或“放热”)反应,也是一个气体分子数(填“减小”或“增大”)的反应。由此判断,此反应自发进行必须满足的条件是。(2)、在反应Ⅱ中,T1T2(填“>”、“<”或“=”),该正反应为(填“吸热”或“放热”)反应。(3)、在反应Ⅲ中,若T2>T1 , 则此正反应为(填“吸热”或“放热”)反应。(4)、反应Ⅳ中,若T1>T2 , 则该反应能否自发进行?。19. I.化学反应速率和化学平衡影响因素较多,经常采用控制变量思想分析问题。某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”,进行了如表中的实验:
(1)、在反应Ⅰ中,若p1>p2 , 则此正反应为(填“吸热”或“放热”)反应,也是一个气体分子数(填“减小”或“增大”)的反应。由此判断,此反应自发进行必须满足的条件是。(2)、在反应Ⅱ中,T1T2(填“>”、“<”或“=”),该正反应为(填“吸热”或“放热”)反应。(3)、在反应Ⅲ中,若T2>T1 , 则此正反应为(填“吸热”或“放热”)反应。(4)、反应Ⅳ中,若T1>T2 , 则该反应能否自发进行?。19. I.化学反应速率和化学平衡影响因素较多,经常采用控制变量思想分析问题。某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”,进行了如表中的实验:实验
编号
室温下,试管中所加试剂及其用量/mL
室温下溶液颜色褪至无色所需时间/min
0.6mol·L-1H2C2O4溶液
H2O
0.2mol·L-1KMnO4溶液
3mol·L-1稀硫酸
1
3.0
4.0
1.0
2.0
6.4
2
3.0
3.0
2.0
2.0
5.2
3
3.0
2.0
3.0
2.0
4.0
请回答:
(1)、已知KMnO4酸性溶液与H2C2O4溶液反应有CO2生成,用化学方程式表示该实验的实验原理:。(2)、根据表中的实验数据,可以得到的结论是。(3)、利用实验3中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=。(4)、II.研究CO2的综合利用对促进“低碳经济”的发展有重要意义。工业上以CO2、NH3为原料生产尿素[CO(NH2)2],2NH3(g)+CO2(g) H2O(l)+CO(NH2)2(s)ΔH=-178kJ∙mol-1 , T1℃时,在1L的密闭容器中充入CO2和NH3模拟工业生产,n(NH3)/n(CO2)=x,图中是CO2平衡转化率(α)与x的关系。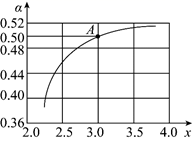
一定能判断该反应达到化学平衡状态的是_______。
A、2v(NH3)正=v(CO2)逆 B、氨气的体积分数不再变化 C、气体的密度不再变化 D、气体的平均摩尔质量不再变化 E、氨气的物质的量浓度不再变化(5)、图中A点NH3的平衡转化率α=%。(6)、当x=1.0时,若起始的压强为p0 kPa,水为液态,平衡时压强变为起始的1/2。则该反应的平衡常数Kp=(kPa)-3(Kp为以分压表示的平衡常数,分压=总压×体积分数)。20. T℃、2L密闭容器中某一反应不同时刻各物质的量如图(E为固体,其余为气体).回答下列问题: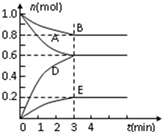 (1)、写出该反应的化学方程式 .(2)、反应开始至3min时,用D表示的平均反应速率为mol/(L•min).(3)、若升高温度,则v(正) , v(逆)(填“加快”或“减慢”)。(4)、若反应在甲、乙两个相同容器内同时进行,分别测得甲中v(A)=0.3 mol·L-1·min-1 , 乙中v(B)=0.2 mol·L-1·min-1 , 则容器中反应更快。21. 为了研究碳酸钙与盐酸反应的反应速率,某同学通过如图实验装置测定反应中生成的CO2气体体积,并绘制出如图所示的曲线。请分析讨论以下问题。
(1)、写出该反应的化学方程式 .(2)、反应开始至3min时,用D表示的平均反应速率为mol/(L•min).(3)、若升高温度,则v(正) , v(逆)(填“加快”或“减慢”)。(4)、若反应在甲、乙两个相同容器内同时进行,分别测得甲中v(A)=0.3 mol·L-1·min-1 , 乙中v(B)=0.2 mol·L-1·min-1 , 则容器中反应更快。21. 为了研究碳酸钙与盐酸反应的反应速率,某同学通过如图实验装置测定反应中生成的CO2气体体积,并绘制出如图所示的曲线。请分析讨论以下问题。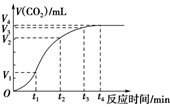 (1)、化学反应速率最快的时间段是 , 原因是
(1)、化学反应速率最快的时间段是 , 原因是A.0~t1 B.t1~t2 C.t2~t3 D.t3~t4
(2)、为了减缓上述反应速率,欲向盐酸溶液中加入下列物质,你认为可行的是________;A、通入HCl B、NaCl固体 C、NaCl溶液 D、蒸馏水(3)、若盐酸溶液的体积是20 mL,图中CO2的体积是标准状况下的体积,则t1~t2 , 时间段平均反应速率v(HCl)= mol·L-1·min-1。