高中化学人教版(2019)必修第二册第六章 第二节 化学反应的速率与限度
试卷更新日期:2022-02-07 类型:同步测试
一、单选题
-
1. 下列反应不属于可逆反应的是( )A、NO与氧气反应 B、H2与N2反应合成NH3 C、NH3溶于水 D、Cl2溶于水2. 在某一化学反应中,反应物A的浓度在10s内从0.8 mol·L-1变为0.2 mol·L-1 , 则在这10s内A的化学反应速率为( )A、0.06 mol·L-1·s-1 B、0.02 mol·L-1·s-1 C、0.02 mol·L-1 D、0.08 mol·L-1·s-13. 把下列四种X溶液,分别加入到盛有10mL2mol.L-1盐酸的烧杯中,均加水稀释到50mL,此时X和盐酸缓慢进行反应,其中反应速率最大的是( )A、30mL2mol.L-1的X溶液 B、20mL1mol.L-1的X溶液 C、10mL4mol.L-1的X溶液 D、10mL3mol.L-1的X溶液4. 下列有关化学反应的说法正确的是( )A、把食物放入冰箱内,可减缓食物腐败的速率 B、铝粉与需要在高温下反应,所以该反应是吸热反应 C、蜡烛燃烧过程中,只有化学能转化为热能的能量变化 D、品红溶液中通入褪色,加热后又恢复红色属于可逆反应5. 下列有关化学反应速率和限度的说法中错误的是( )A、实验室通过分解制备 , 加入后,反应速率明显加快 B、已知工业合成氨是一个放热的可逆反应,所以升高温度,正反应速率减小 C、在反应中,不能100%转化为 D、实验室用碳酸钙和盐酸反应制取时,用碳酸钙粉末比块状碳酸钙反应要快6. 100mL浓度为2mol/L的硫酸跟过量的锌片反应,为加快反应速率,又不影响生成的氢气的总量,可采用的方法是( )A、加入适量的6mol/L的硫酸 B、适当加热 C、加入适量蒸馏水 D、加入适量的稀硝酸7. 一定条件下,对于可逆反应 , 若X、Y、Z的起始浓度分别为、、(均不为零),达到平衡时,X、Y、Z的浓度分别为、、 , 则下列判断正确的是( )A、 B、X的浓度为时,Z的浓度为 C、X、Y的转化率不相等 D、的取值范围为8. 相同质量的与足量稀硫酸分别在下列条件下发生反应,其中化学反应速率最大的一组是( )
温度/
锌的状态
A
0.1
20
颗粒
B
0.1
35
颗粒
C
0.1
20
粉末
D
1.0
35
粉末
A、A B、B C、C D、D9. 在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH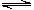 CH3COO-+H+对于该平衡,下列叙述正确的是( ) A、加入水时,平衡向逆反应方向移动 B、通入少量HCl气体,溶液中pH值增大 C、 加入少量NaOH固体,平衡向正反应方向移动,CH3COO-浓度增大 D、加入少量CH3COONa固体,平衡向逆反应方向移动,CH3COO-浓度减小10. H2O2分解速率受多种因素影响。实验测得70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是( )
CH3COO-+H+对于该平衡,下列叙述正确的是( ) A、加入水时,平衡向逆反应方向移动 B、通入少量HCl气体,溶液中pH值增大 C、 加入少量NaOH固体,平衡向正反应方向移动,CH3COO-浓度增大 D、加入少量CH3COONa固体,平衡向逆反应方向移动,CH3COO-浓度减小10. H2O2分解速率受多种因素影响。实验测得70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是( )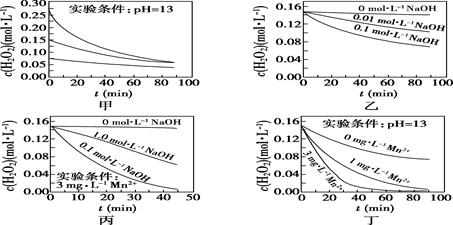 A、图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快 B、图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快 C、图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快 D、图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大11. 一定温度下,在 物质 的溶液中,发生反应: ,测算出物质 的浓度随时间变化关系如图所示。
A、图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快 B、图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快 C、图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快 D、图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大11. 一定温度下,在 物质 的溶液中,发生反应: ,测算出物质 的浓度随时间变化关系如图所示。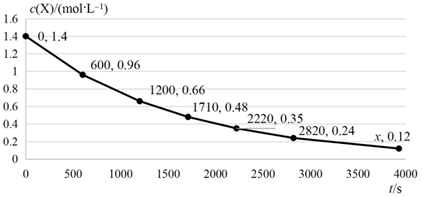
下列说法正确的是( )
A、 , 的平均速率为 B、反应至 时, C、反应过程中, D、可推测出图中x为393012. 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,下列说法正确的是( ) A、t1min时,正、逆反应速率的大小关系为v正=v逆 B、4min内,CO2的转化率为71.4% C、CO的反应速率v(CO)=0.125mol·L-1·s-1 D、保持容器压强不变,充入He,化学反应速率不变13. NO催化O3分解的反应机理如下:
A、t1min时,正、逆反应速率的大小关系为v正=v逆 B、4min内,CO2的转化率为71.4% C、CO的反应速率v(CO)=0.125mol·L-1·s-1 D、保持容器压强不变,充入He,化学反应速率不变13. NO催化O3分解的反应机理如下:第一步:
第二步:
第三步:___________
总反应:
其能量与反应历程的关系如图所示。下列叙述的错误的是( )
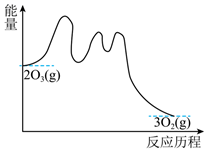 A、第一步基元反应是该反应的决速步骤 B、第二步反应断裂的化学键只有共价键 C、第三反应的反应机理为: D、催化剂NO改变了总反应的反应历程和焓变14. 某温度下,在恒容密闭容器中SO2、O2、SO3三种气态物质建立化学平衡:2SO2(g)+O2(g) 2SO3(g) ΔH<0,改变条件对反应正、逆反应速率的影响如图所示,关于改变的条件下列说法错误的是( )
A、第一步基元反应是该反应的决速步骤 B、第二步反应断裂的化学键只有共价键 C、第三反应的反应机理为: D、催化剂NO改变了总反应的反应历程和焓变14. 某温度下,在恒容密闭容器中SO2、O2、SO3三种气态物质建立化学平衡:2SO2(g)+O2(g) 2SO3(g) ΔH<0,改变条件对反应正、逆反应速率的影响如图所示,关于改变的条件下列说法错误的是( )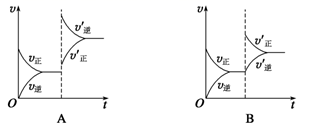
 A、压缩容器体积 B、通入O2 C、通入稀有气体He D、减低温度15. 把下列四种 溶液分别加入到四个盛有 盐酸的烧杯中,均加水稀释至溶液体积为 ,此时 和盐酸缓慢地进行反应,其中反应最快的是( )A、 的 溶液 B、 的 溶液 C、 的 溶液 D、 的 溶液16. 密闭的真空容器中放入一定量 固体,发生反应 .达到平衡后,保持温度不变,缩小容器体积为原来的一半,重新达到平衡.下列叙述正确的是( )A、缩小容器体积,平衡正向移动 B、达到新平衡后,容器内压强增大 C、达到新平衡后,气体的密度不变 D、达到新平衡后,固体总质量不变
A、压缩容器体积 B、通入O2 C、通入稀有气体He D、减低温度15. 把下列四种 溶液分别加入到四个盛有 盐酸的烧杯中,均加水稀释至溶液体积为 ,此时 和盐酸缓慢地进行反应,其中反应最快的是( )A、 的 溶液 B、 的 溶液 C、 的 溶液 D、 的 溶液16. 密闭的真空容器中放入一定量 固体,发生反应 .达到平衡后,保持温度不变,缩小容器体积为原来的一半,重新达到平衡.下列叙述正确的是( )A、缩小容器体积,平衡正向移动 B、达到新平衡后,容器内压强增大 C、达到新平衡后,气体的密度不变 D、达到新平衡后,固体总质量不变二、综合题
-
17. 在密闭容器里,通入xmolH2(g)和ymolI2(g),改变下列条件,反应速率将如何变化?(填“增大、减小、或无影响”)(1)、若升高温度,速率;(2)、若加入催化剂,速率;(3)、若充入更多的H2 , 速率;(4)、若扩大容器的体积,速率;(5)、若容器容积不变,通入氖气,速率。18. 在 密闭容器中,800℃时,反应 体系中, 随时间的变化如表所示.
时间/s
0
1
2
3
4
5
0.020
0.010
0.008
0.007
0.007
0.007
(1)、图中,A点处 (填“大于”小于”或“等于”)。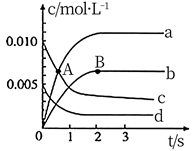 (2)、图中表示 变化的曲线是。用 表示从 内该反应的平均速率 。(3)、下列能使该反应的反应速率增大的是。
(2)、图中表示 变化的曲线是。用 表示从 内该反应的平均速率 。(3)、下列能使该反应的反应速率增大的是。a.及时分离出 气体 b.适当升高温度
c.适当扩大容器的容积 d.选择高效的催化剂
19. 某温度时,在2 L密闭容器中充入NO与O2 , 反应过程中各物质的物质的量随时间的变化关系如图所示。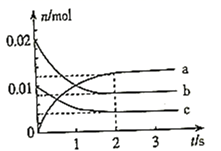 (1)、NO与O2反应的化学方程式是 , 反应现象是。(2)、上图中表示NO的曲线是(填序号),在 内用NO表示的平均反应速率是。(3)、为加快该反应的速率,可采取的一种措施是。(4)、已知该反应为放热反应,下图中能正确表示该反应中能量变化的是(填序号)。
(1)、NO与O2反应的化学方程式是 , 反应现象是。(2)、上图中表示NO的曲线是(填序号),在 内用NO表示的平均反应速率是。(3)、为加快该反应的速率,可采取的一种措施是。(4)、已知该反应为放热反应,下图中能正确表示该反应中能量变化的是(填序号)。A.
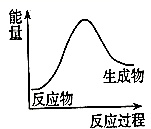 B.
B. 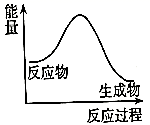 C.
C. 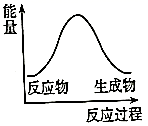 20. 化学反应中的能量和速率变化对生产生活有着重要意义。某研究学习小组同学进行下列探究活动。(1)、甲同学探究反应Fe+H2SO4(稀)=FeSO4+H2↑中的能量变化。向装有铁片的试管中加入1 mol/L的H2SO4 , 观察到试管内有气泡产生,触摸试管外壁,温度升高。
20. 化学反应中的能量和速率变化对生产生活有着重要意义。某研究学习小组同学进行下列探究活动。(1)、甲同学探究反应Fe+H2SO4(稀)=FeSO4+H2↑中的能量变化。向装有铁片的试管中加入1 mol/L的H2SO4 , 观察到试管内有气泡产生,触摸试管外壁,温度升高。①该反应为(填“放热”或“吸热”)反应。
②下列措施中,能加快氢气生成速率的是(填字母)。
a.将铁片改成铁粉 b.将稀H2SO4改成浓硫酸 c.加硫酸钠溶液
(2)、乙同学认为原电池原理也可加快化学反应速率,他设计如图1所示实验装置。实验过程中可观察到的现象是。铁片上的电极反应式为。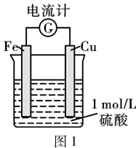 (3)、丙同学根据 反应的发生条件,在老师的指导下,按如图2流程探究不同催化剂对NH3还原NO反应的催化性能。控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通入一定体积滴有酚酞的稀硫酸中(溶液的体积、浓度均相同)。
(3)、丙同学根据 反应的发生条件,在老师的指导下,按如图2流程探究不同催化剂对NH3还原NO反应的催化性能。控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通入一定体积滴有酚酞的稀硫酸中(溶液的体积、浓度均相同)。
①写出实验室用加热固体混合物的方法制备NH3的化学反应方程式。
②为比较不同催化剂的催化性能,需要测量并记录的数据是。
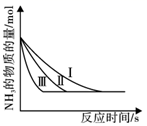
③在不同催化剂时测得混合气体中NH3的物质的量与时间的关系如图所示,则曲线(填序号)使用的催化剂催化性能最好,理由是。
 21. 碘及碘的化合物在人类活动中占有重要的地位。已知反应H2(g)+I2(g) 2HI(g)ΔH=-14.9kJ·mol-1。(1)、根据下图判断1molH2(g)分子中化学键断裂时需要吸收的能量为kJ。
21. 碘及碘的化合物在人类活动中占有重要的地位。已知反应H2(g)+I2(g) 2HI(g)ΔH=-14.9kJ·mol-1。(1)、根据下图判断1molH2(g)分子中化学键断裂时需要吸收的能量为kJ。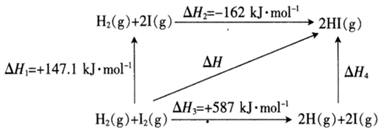 (2)、氢气和碘蒸气能直接反应生成碘化氢,T℃时,向1L的恒容密闭容器中充入0.2mol H2(g)和0.2mol I2(g),5min时反应达到平衡,H2(g)、I2(g)和HI(g)的物质的量浓度(c)随时间(t)变化的曲线如图所示:
(2)、氢气和碘蒸气能直接反应生成碘化氢,T℃时,向1L的恒容密闭容器中充入0.2mol H2(g)和0.2mol I2(g),5min时反应达到平衡,H2(g)、I2(g)和HI(g)的物质的量浓度(c)随时间(t)变化的曲线如图所示: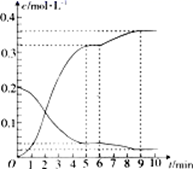
0~5min内,用H2(g)表示的该反应速率v(H2)=。6min时,改变的外界条件为。
(3)、反应H2(g)+I2(g) 2HI(g)的反应机理如下:第一步:I2 2I(快速平衡);
第二步:I+H2 H2I(快速平衡);
第三步:H2I+I→2HI(慢反应)。
则该反应的反应速率由步决定。
(4)、将等物质的量的I2和H2置于预先抽真空的特制1L恒容密闭容器中,加热到1500K,起始总压强为416kPa;体系达到平衡时,总压强为456kPa。若体系中只考虑如下反应关系:①I2(g) 2I(g)Kpl=200ΔH1
②I2(g)+H2(g) 2HI(g)Kp2ΔH2
KP为以分压表示的平衡常数。1500K时,平衡体系中I(g)的分压为kPa,Kp2=(写表达式)。
(5)、某实验兴趣小组将氧化还原反应2Cu2++5I- 2CuI↓++ 设计成如图所示的原电池装置: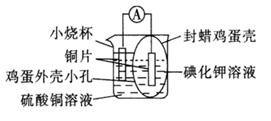
带孔的封蜡鸡蛋壳为半透膜,鸡蛋壳内的电极为(填“正极”或“负极”);该电极反应式为。
22. 具有十八面体结构的Ag3PO4晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。(1)、Ⅰ.配位-沉淀法制备 高效光催化剂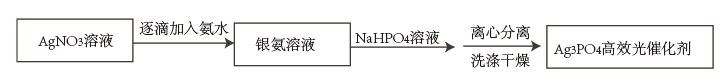
已知:i.Ag3PO4难溶于水,可溶于硝酸;
ii.Ag3PO4沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能;
iii.银氨溶液中存在:
配制银氨溶液时的反应现象是。
(2)、加入 溶液时,发生以下反应,请将离子方程式补充完整:□ +□+□=□NH3+□+□
(3)、 和 在溶液中反应也可制得Ag3PO4固体,但制得的Ag3PO4固体光催化性能极差。从速率角度解释其原因:。(4)、Ⅱ.Ag3PO4光催化剂的使用和再生已知:Ag3PO4晶体在光照条件下发挥催化作用时,首先引发反应。a.
Ag3PO4光催化CO2制备甲醇可实现“碳中和”,a的后续反应: , ,则由CO2制备甲醇的总反应的化学方程式为。
(5)、Ag3PO4光催化降解RhB(代表有机污染物),RhB被氧化成CO2和H2O。a的后续反应注:Ag3PO4在该催化过程中可能发生光腐蚀,生成单质银,影响其光催化性能。
用Ag3PO4依次降解三份相同的废水,测得3次降解过程中RhB的残留率( :即时浓度与起始浓度之比)随时间变化的曲线如图。
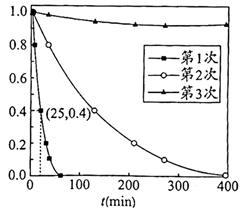
①下列说法正确的是(填字母序号)。
a. 和 是降解RhB的重要氧化剂
b.第1次使用后Ag3PO4的光催化性能降低
c.该实验条件下,Ag3PO4使用两次即基本失效
②第1次光降解时, 内的反应速率为 (废水中RhB初始浓度 为 ,RhB的摩尔质量为 )