高中化学人教版(2019)必修第二册第六章 第一节 化学反应与能量变化
试卷更新日期:2022-02-07 类型:同步测试
一、单选题
-
1. 从如图所示的某气体反应的能量变化分析,以下判断错误的是( )
 A、这是一个放热反应 B、该反应开始时可能需要加热 C、生成物具有的总能量高于反应物具有的总能量 D、生成物从气态变成液态时会放出热量2. 如图为铜锌原电池示意图,下列说法中不正确的是( )
A、这是一个放热反应 B、该反应开始时可能需要加热 C、生成物具有的总能量高于反应物具有的总能量 D、生成物从气态变成液态时会放出热量2. 如图为铜锌原电池示意图,下列说法中不正确的是( ) A、锌为阴极,铜为阳极 B、电子由锌片通过导线流向铜片 C、锌片质量逐渐减少,溶液的质量逐渐增加 D、该装置能把化学能转化为电能3. 下列变化过程,属于放热反应的是( )
A、锌为阴极,铜为阳极 B、电子由锌片通过导线流向铜片 C、锌片质量逐渐减少,溶液的质量逐渐增加 D、该装置能把化学能转化为电能3. 下列变化过程,属于放热反应的是( )①金属钠与水
②NH4Cl晶体与Ba(OH)2·8H2O混合搅拌
③H2在Cl2中燃烧
④碳与水蒸气生成一氧化碳和氢气
⑤浓H2SO4的稀释
⑥酸碱中和反应
A、①③⑤⑥ B、①③④ C、①③⑤ D、①③⑥4. 一种微生物燃料电池如图所示,下列关于该电池说法正确的是( ) A、a电极为正极,发生还原反应 B、H+由右室通过质子交换膜进入左室 C、当b电极上产生1molN2时,溶液中将有10mole-通过 D、b电极反应式为:2NO+10e—+12H+=N2↑+6H2O5. 新型的乙醇电池结构如图所示,它用碘酸类质子溶剂,在200℃左右时供电,其效率比甲醇电池高出32倍,且更安全.已知电池总反应式为C2H5OH+3O2═2CO2+3H2O.下列说法错误的是( )
A、a电极为正极,发生还原反应 B、H+由右室通过质子交换膜进入左室 C、当b电极上产生1molN2时,溶液中将有10mole-通过 D、b电极反应式为:2NO+10e—+12H+=N2↑+6H2O5. 新型的乙醇电池结构如图所示,它用碘酸类质子溶剂,在200℃左右时供电,其效率比甲醇电池高出32倍,且更安全.已知电池总反应式为C2H5OH+3O2═2CO2+3H2O.下列说法错误的是( ) A、a极为电池的负极,该电极发生氧化反应 B、电池工作时电子由a极流出沿导线经灯泡到b极 C、电池正极的电极反应式为 O2+2H2O+4e﹣═4OH﹣ D、电池工作时,1mol乙醇被氧化转移12mol电子6. 如图所示是和形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下。则卡片上的描述合理的是( )
A、a极为电池的负极,该电极发生氧化反应 B、电池工作时电子由a极流出沿导线经灯泡到b极 C、电池正极的电极反应式为 O2+2H2O+4e﹣═4OH﹣ D、电池工作时,1mol乙醇被氧化转移12mol电子6. 如图所示是和形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下。则卡片上的描述合理的是( )

2021.6.18,实验后的记录:①为正极,为负极
②极上有气泡产生,发生还原反应
③向极移动
④若有0.5电子流经导线,则可产生0.25气体
⑤电子的流向是:
⑥正极反应式: , 发生氧化反应
A、①②④ B、②④ C、②③④ D、③④⑤7. 微型银-锌电池的电极分别是Ag/Ag2O和Zn,KOH溶液作电解质溶液,电池总反应为Ag2O+Zn+H2O =2Ag+Zn(OH)2 。对电池工作过程中的下列叙述错误的是( )A、电流由Ag/Ag2O电极流出 B、电解液中OH-向负极迁移 C、负极反应为Zn-2e-+2OH-=Zn(OH)2 D、正极反应为Ag2O+2H++2e- =2Ag+H2O8. 某同学根据离子反应方程式来设计原电池。下列设计方案中可行的是( )A、电极材料为铁和锌,电解质溶液为氯化铁溶液 B、电极材料为铁和铜,电解质溶液为硫酸铁溶液 C、电极材料为铁和石墨,电解质溶液为氯化亚铁溶液 D、电极材料为石墨,电解质溶液为氯化铁溶液9. 已知1g氢气完全燃烧生成水蒸气时放出热量121kJ。且氧气中1molO=O键完全断裂时吸收热量496kJ,水蒸气中1molH-O键形成时放出热量463kJ,则氢气中1molH-H键断裂时吸收热量为( )A、920kJ B、557kJ C、436kJ D、188kJ10. 将纯锌片和纯铜片按图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( ) A、两烧杯中溶液的pH均增大 B、甲中铜片是正极,乙中铜片是负极 C、两烧杯中铜片表面均无气泡产生 D、甲、乙溶液均变蓝色11. 化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( )
A、两烧杯中溶液的pH均增大 B、甲中铜片是正极,乙中铜片是负极 C、两烧杯中铜片表面均无气泡产生 D、甲、乙溶液均变蓝色11. 化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( ) A、该反应是吸热反应 B、断裂1 mol A-A键和1 mol B-B键能放出x kJ的能量 C、断裂2 mol A-B键需要吸收y kJ的能量 D、2 mol AB的总能量高于1 mol A2和1 mol B2的总能量12. 下列过程中能量变化与图像不相符的是( )
A、该反应是吸热反应 B、断裂1 mol A-A键和1 mol B-B键能放出x kJ的能量 C、断裂2 mol A-B键需要吸收y kJ的能量 D、2 mol AB的总能量高于1 mol A2和1 mol B2的总能量12. 下列过程中能量变化与图像不相符的是( )选项
A
B
C
D
反应
NaOH和盐酸反应
Ba(OH)2•8H2O和NH4Cl反应
Cl2和H2反应
Na和水反应
图像



 A、A B、B C、C D、D13. 图中装置能形成原电池的是( )A、
A、A B、B C、C D、D13. 图中装置能形成原电池的是( )A、 B、
B、 C、
C、 D、
D、 14. 关于化学反应与能量的说法正确的是( )A、任何化学反应都伴随有能量变化 B、ΔH>0表示放热反应,ΔH<0表示吸热反应 C、化学键的断裂会放出能量 D、反应物总能量比生成物总能量高的反应是吸热反应15. 石墨在一定条件下可转化为金刚石,已知12g石墨完全转化为金刚石时,要吸收QkJ的热量,下列说法正确的是( )A、石墨不如金刚石稳定 B、金刚石与石墨的结构是相同的 C、等物质的量的石墨与金刚石完全燃烧,金刚石放出的热量多 D、等物质的量的石墨与金刚石完全燃烧,石墨放出的热量多16. 下列图像能准确表示氢气燃烧的热量变化的是( )A、
14. 关于化学反应与能量的说法正确的是( )A、任何化学反应都伴随有能量变化 B、ΔH>0表示放热反应,ΔH<0表示吸热反应 C、化学键的断裂会放出能量 D、反应物总能量比生成物总能量高的反应是吸热反应15. 石墨在一定条件下可转化为金刚石,已知12g石墨完全转化为金刚石时,要吸收QkJ的热量,下列说法正确的是( )A、石墨不如金刚石稳定 B、金刚石与石墨的结构是相同的 C、等物质的量的石墨与金刚石完全燃烧,金刚石放出的热量多 D、等物质的量的石墨与金刚石完全燃烧,石墨放出的热量多16. 下列图像能准确表示氢气燃烧的热量变化的是( )A、 B、
B、 C、
C、 D、
D、 17. 和 在一定条件下能发生反应: ,已知:(a、b、c均大于零)下列说法错误的是( )
17. 和 在一定条件下能发生反应: ,已知:(a、b、c均大于零)下列说法错误的是( ) A、向密闭容器中加入2mol 和2mol ,充分反应后放出的热量等于2a kJ B、断开1mol H—H键和1mol I—I键所需能量小于断开2mol H—I键所需能量 C、断开2molH—I键所需能量约为(c+b+a)kJ D、反应物的总能量高于生成物的总能量
A、向密闭容器中加入2mol 和2mol ,充分反应后放出的热量等于2a kJ B、断开1mol H—H键和1mol I—I键所需能量小于断开2mol H—I键所需能量 C、断开2molH—I键所需能量约为(c+b+a)kJ D、反应物的总能量高于生成物的总能量二、综合题
-
18. 如图,请回答下列问题:
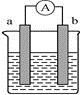 (1)、若在原电池中,a电极有气泡产生,b电极逐渐变细,则该原电池的正极是(填写字母“a”或“b”),外电路中电流流动的方向是(填写字母“a→b”或“b→a”),b电极发生的反应类型是(填“氧化反应”或“还原反应”)。(2)、当电极a为Zn、电极b为Ag、电解质溶液为CuSO4时,正极的电极反应式为。当a极溶解的质量为6.5g时,有mol电子通过导线。19. 某学生在家中设计水果电池时发现∶把片和片用导线连接后平行插入新鲜西红柿中,再在导线中接一个LED灯,此时LED灯能够发光,装置如图所示。根据题意请回答下列问题:
(1)、若在原电池中,a电极有气泡产生,b电极逐渐变细,则该原电池的正极是(填写字母“a”或“b”),外电路中电流流动的方向是(填写字母“a→b”或“b→a”),b电极发生的反应类型是(填“氧化反应”或“还原反应”)。(2)、当电极a为Zn、电极b为Ag、电解质溶液为CuSO4时,正极的电极反应式为。当a极溶解的质量为6.5g时,有mol电子通过导线。19. 某学生在家中设计水果电池时发现∶把片和片用导线连接后平行插入新鲜西红柿中,再在导线中接一个LED灯,此时LED灯能够发光,装置如图所示。根据题意请回答下列问题: (1)、西红柿电池中,正极发生(填"氧化反应"或"还原反应"),电子移动的路径为。(2)、负极为(填化学式)电极,该电极的电极反应式为。(3)、若将片换片Zn片,则此时负极为(填化学式)电极,该电极的电极反应式为。20. 任何化学反应都伴随着能量的变化,通过化学反应,化学能可转化为热能、光能、电能等不同形式的能量。(1)、用图甲、乙所示装置进行实验,请回答下列问题:
(1)、西红柿电池中,正极发生(填"氧化反应"或"还原反应"),电子移动的路径为。(2)、负极为(填化学式)电极,该电极的电极反应式为。(3)、若将片换片Zn片,则此时负极为(填化学式)电极,该电极的电极反应式为。20. 任何化学反应都伴随着能量的变化,通过化学反应,化学能可转化为热能、光能、电能等不同形式的能量。(1)、用图甲、乙所示装置进行实验,请回答下列问题:
①以下叙述中,正确的是。
a.甲中锌片是负极,乙中铜片是正极 b.两烧杯中铜片表面均有气泡产生
c.两烧杯中溶液的pH均增大 d.乙中电流由铜片经过导线流向锌片
②若反应过程中有0.4mol电子转移,乙装置中生成的氢气在标况下的体积为。
(2)、Mg,Al设计成如由图所示原电池装置:
①若溶液为盐酸,Mg为极;
②若溶液为氢氧化钠溶液,Mg电极发生的电极反应为。
(3)、CO与反应还可制备 , 可作为燃料使用,用和组合形成的质子交换膜燃料电池的结构示意图如下:
电池总反应为 , 则c电极的反应方程式为 , 若线路中转移2mol电子,则上述燃料电池,消耗的在标准状况下的体积为L。
21. 能量转化是化学变化的主要特征之一,按要求回答下列问题。(1)、页岩气是从页岩层中开采出来的天然气,成分以甲烷为主。下列有关页岩气的叙述错误的是____(填字母)。A、页岩气属于新能源 B、沼气、煤矿坑道气的主要成分与页岩气相同 C、甲烷中每个原子的最外层电子排布都达到8电子稳定结构 D、页岩气可以作燃料电池的负极燃料(2)、部分常见的电池装置如下:编号
a
b
c
d
电池装置

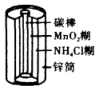


①上述四种电池中,属于二次电池的是(填字母,下同),属于干电池的是。
②a装置中,外电路中电子的流向是(填“从Zn流向Cu”或“从Cu流向Zn”)。
③c装置中,若将电解质改为碱性介质,则负极的电极反应式为。
(3)、氧化还原反应一般可以设计成原电池。若将反应设计成原电池,则:①该电池的电解质溶液可以是。
②当外电路中转移1mol电子时,电解质溶液的质量增加g。