高中化学人教版(2019)必修第二册第五章 化工生产中重要的非金属元素 单元测试卷
试卷更新日期:2022-02-07 类型:单元试卷
一、单选题
-
1. 二氧化硫与下列物质反应,能体现其漂白性的是( )A、溴水 B、酸性高锰酸钾溶液 C、品红溶液 D、溶有酚酞的氢氧化钠溶液2. 常温下,浓硫酸能使铁钝化是利用了浓硫酸的( )A、脱水性 B、吸水性 C、酸性 D、强氧化性3. 纳米材料是21世纪最有前途的新型材料之一,世界各国对这一新型材料给予了极大的关注。纳米粒子是指直径为1 ~ 100 nm的超细粒子(1 nm=10-9 m)。由于表面效应和体积效应,其常有奇特的光、电、磁、热等性质,可开发为新型功能材料,有关纳米粒子的叙述中错误的是( )A、因纳米粒子半径太小,故不能将其制成胶体 B、一定条件下,纳米粒子可催化水的分解 C、一定条件下,纳米TiO2陶瓷可任意弯曲,可塑性好 D、纳米粒子半径小,表面活性高4. 以下有关碳纳米管、富勒烯、石墨烯的说法错误的是( )A、它们的物理性质相同 B、它们都是新型无机非金属材料中的碳纳米材料 C、它们都是碳单质 D、它们分别完全燃烧后生成物相同5. 下列说法正确的是( )A、因为具有漂白性,所以它能使酸性高锰酸钾溶液褪色 B、气体通入溶液能产生白色沉淀 C、热稳定性: D、硫和氯气分别与铁反应后,铁元素的价态相同6. 含S元素的某钠盐a能发生如图转化。下列说法错误的是( )
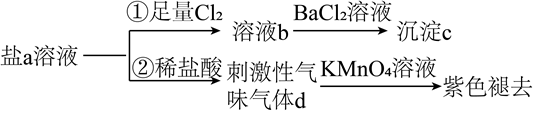 A、a可能为正盐,也可能为酸式盐 B、c为不溶于盐酸的白色沉淀 C、d为含极性键的非极性分子 D、反应②中还可能生成淡黄色沉淀7. 实验小组设计图所示装置,验证SO2性质,对实验现象分析错误的是( )
A、a可能为正盐,也可能为酸式盐 B、c为不溶于盐酸的白色沉淀 C、d为含极性键的非极性分子 D、反应②中还可能生成淡黄色沉淀7. 实验小组设计图所示装置,验证SO2性质,对实验现象分析错误的是( )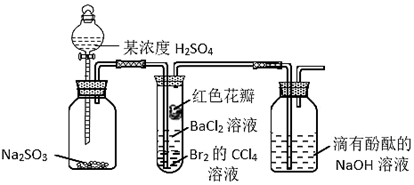 A、试管内Br2的CCl4溶液褪色,说明SO2具有还原性 B、一段时间后试管内有白色沉淀,说明SO2与BaCl2反应生成BaSO3 C、试管中的红色花瓣褪色,说明SO2具有漂白性 D、滴有酚酞的NaOH溶液红色变浅,说明SO2能与碱溶液反应8. 某同学设计如图实验检验木炭与浓硫酸反应放出的气体是否有SO2和CO2 , 下列说法错误的是( )
A、试管内Br2的CCl4溶液褪色,说明SO2具有还原性 B、一段时间后试管内有白色沉淀,说明SO2与BaCl2反应生成BaSO3 C、试管中的红色花瓣褪色,说明SO2具有漂白性 D、滴有酚酞的NaOH溶液红色变浅,说明SO2能与碱溶液反应8. 某同学设计如图实验检验木炭与浓硫酸反应放出的气体是否有SO2和CO2 , 下列说法错误的是( ) A、木炭与浓硫酸反应,浓硫酸中的S元素被还原 B、当该反应转移4mol电子时,生成标准状况下的气体共67.2L C、洗气瓶①②中溶液褪色,体现的二氧化硫的性质依次为漂白性、还原性 D、证明二氧化碳存在的现象为洗气瓶①中品红溶液不褪色,澄清石灰水变浑浊9. 下列实验报告记录的a、b、c、d四支试管中的实验现象正确的是( )
A、木炭与浓硫酸反应,浓硫酸中的S元素被还原 B、当该反应转移4mol电子时,生成标准状况下的气体共67.2L C、洗气瓶①②中溶液褪色,体现的二氧化硫的性质依次为漂白性、还原性 D、证明二氧化碳存在的现象为洗气瓶①中品红溶液不褪色,澄清石灰水变浑浊9. 下列实验报告记录的a、b、c、d四支试管中的实验现象正确的是( )实验
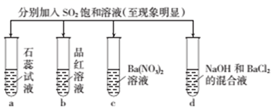
记录
A
蓝色
无色
白色沉淀
无色溶液
B
红色
无色
白色沉淀
白色沉淀
C
红色
无色
无色溶液
白色沉淀
D
无色
无色
无色溶液
无色溶液
A、A B、B C、C D、D10. 由粗 制备纯的 流程如图所示,下列说法错误的是( ) A、 属于酸性氧化物 B、二氧化硅是将太阳能转变为电能的常用材料 C、若在实验室中完成步骤Ⅲ,应该在坩埚中进行 D、步骤Ⅱ反应的离子方程式为
A、 属于酸性氧化物 B、二氧化硅是将太阳能转变为电能的常用材料 C、若在实验室中完成步骤Ⅲ,应该在坩埚中进行 D、步骤Ⅱ反应的离子方程式为二、综合题
-
11. 按要求回答下列问题:(1)、请写出碳化硅的化学式(2)、请写出铜与稀硝酸反应的离子方程式(3)、试管内壁附着的硫单质可用热的苛性钠溶液洗涤除去,生成的产物中有 和 。请写出对应的化学反应方程式12. 按要求填空(1)、浓硫酸具有如下的性质:A.酸性B.强氧化性C.吸水性D.脱水性,E难挥发性。下列事实主要表现浓硫酸的什么性质(填字母序号)。
①浓硫酸使蔗糖变黑
②碳投入热的浓硫酸中溶解
③浓硫酸与氧化铜反应
④浓硫酸干燥氢气
(2)、浓硝酸具有如下的性质:A.酸性B.强氧化性C.不稳定性,下列事实主要表现浓硝酸的什么性质(填字母序号)。①浓硝酸需避光保存
②常温下可用铝或者铁遇浓硝酸钝化
(3)、二氧化硫气体在下列反应中表现的性质填写在横线上。A.氧化性B.漂白性C.还原性D.酸性氧化物的性质
①SO2+2OH-= +H2O
②SO2+2H2S=3S↓+2H2O
③SO2+Ca(OH)2=CaSO3↓+H2O
④SO2+Cl2+2H2O=2HCl+H2SO4
13. 大气污染物SO2是一种无色刺激性气味气体。某学习小组利用下图所示装置探究SO2的相关性质: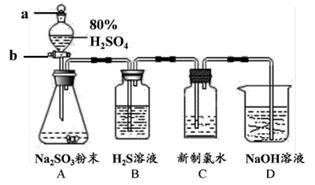
回答下列问题:
(1)、装置 A 用于制取SO2气体,其中发生反应的化学方程式为;(2)、实验开始时,先打开分液漏斗的(填“玻璃塞 a”或“活塞 b”,下同),再打开 , 逐滴加入80%的H2SO4;(3)、一段时间后,装置 B 中出现淡黄色(S)沉淀,可证明SO2具有(填“氧化性”或“还原性”);(4)、充分反应后取装置 C 中溶液,加入(填“AgNO3溶液”、“品红溶液”或“BaCl2溶液”),出现现象,可证明SO2具有还原性;(5)、装置 D 的作用是。14. 研究氮及其化合物的性质,可以有效改善人类的生存环境。氮元素化合价—物质类别关系图如下。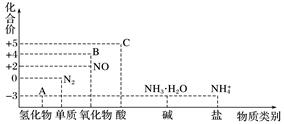
回答下列问题:
(1)、在催化剂和加热的条件下,物质A生成NO是工业制硝酸的重要反应,化学方程式是。(2)、在加热条件下,物质C的浓溶液与碳单质反应,写出反应的化学方程式:。(3)、实验室中,检验溶液中含有NH4+的操作方法是。(4)、物质B为红棕色气体,写出该物质与水反应的离子方程式: , 当反应消耗3.36L(标准状况)物质B时,转移电子的物质的量为mol。(5)、写出一种人工固氮的化学反应原理。(6)、Cu与一定浓度的硝酸溶液反应生成NO时的离子反应方程式为。15. 按要求填空(1)、已知Cu2O溶于稀硫酸,可得到CuSO4溶液,写出该反应的离子反应方程式;(2)、写出经过一步反应能得到Cu3(OH)4SO4的化学方程式(要求非氧化还原反应);(3)、8.4 g N2与9.6 g某单质Rx , 所含原子个数相同,且分子数之比为3:2,则R的相对原子质量是 , x值为。(4)、写出溶液中NH4+的检验方法及相应的离子方程式、16. 非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题。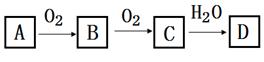 (1)、若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
(1)、若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。①D的化学式是;
②在工业生产中,B气体的大量排放被雨水吸收后形成了而污染了环境。
(2)、若A在常温下为气体,C是红棕色的气体。①A、C的化学式分别是:A;C 。
②请写出C→D的反应化学方程式 。该反应与中,氧化剂与还原剂的物质的量之比为。
17. 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量的铝铁合金与100mL很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4 mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题: (1)、结合OH-的能力最弱的是(填离子符号)(2)、B与A的差值为mol.(3)、原混合物中铝粉与铁粉的物质的量之比为 .(4)、B点对应的沉淀量为mol,C点对应的溶液体积为mL.(5)、硝酸溶液的物质的量浓度为mol·L-1(6)、写出铝与该浓度硝酸反应的离子方程式。18. 如图,通过工业联产可有效解决多晶硅(Si)生产中副产物SiCl4。所带来的环境问题。
(1)、结合OH-的能力最弱的是(填离子符号)(2)、B与A的差值为mol.(3)、原混合物中铝粉与铁粉的物质的量之比为 .(4)、B点对应的沉淀量为mol,C点对应的溶液体积为mL.(5)、硝酸溶液的物质的量浓度为mol·L-1(6)、写出铝与该浓度硝酸反应的离子方程式。18. 如图,通过工业联产可有效解决多晶硅(Si)生产中副产物SiCl4。所带来的环境问题。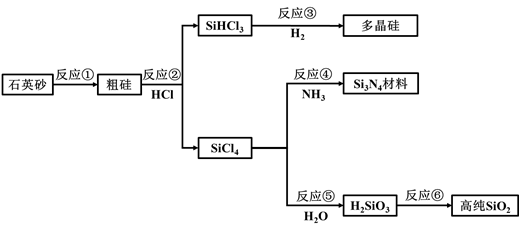 (1)、Si在元素周期表中的位置是。(2)、反应①的化学方程式为。(3)、流程中涉及的化学反应属于氧化还原反应的有(填反应序号)。(4)、高温下,反应④的化学方程式为。(5)、在多晶硅、Si3N4材料和高纯SiO2中,可用于制造光是纤维的是。(6)、Si和Ge属于同主族元素。下列预测合理的是(填选项序号)。
(1)、Si在元素周期表中的位置是。(2)、反应①的化学方程式为。(3)、流程中涉及的化学反应属于氧化还原反应的有(填反应序号)。(4)、高温下,反应④的化学方程式为。(5)、在多晶硅、Si3N4材料和高纯SiO2中,可用于制造光是纤维的是。(6)、Si和Ge属于同主族元素。下列预测合理的是(填选项序号)。a.Ge与H2化合难于Si
b.GeO2既有氧化性又有还原性
c.酸性H2GeO3>H2SiO3
d.Si和Ge都可做半导体材料
19. A 元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料一一光导纤维,C 与烧碱反应生成含A 元素的化合物D。(1)、写出C与氢氟酸发生反应的化学方程式是(2)、将C与纯碱混合高温熔融时反应生成D,同时还生成氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。①分别写出生成D和F的化学方程式:、。
②要将NaOH高温熔化,下列坩埚中可选用的是。
a.普通玻璃坩埚
b.石英玻璃坩埚
c.氧化铝坩埚
d.铁坩埚
(3)、碳还原SiO2制SiC,其粗产品中杂质为Si和SiO2。现将20.0g SiC粗产品加入到过量的NaOH溶液中充分反应,收集到0.1mol氢气,过滤得SiC固体11.4g,滤液稀释到1L。生成氢气的离子方程式为 , 硅酸盐的物质的量浓度为mol/L。(4)、下列叙述正确的有(填序号)。①Na还原CCl4的反应、Cl2与H2O的反应均是置换反应
②Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
③钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比均为1∶2
20. 陶瓷的发明是人类早期科学技术发展史上的一个重要的里程碑,现在,陶瓷已广泛应用于生活和生产中.(1)、陶瓷不具有的性质是 .A、可导电 B、耐酸碱 C、抗氧化 D、耐高温(2)、实验室中最常用的坩埚是 , 熔融烧碱样品作实验时一般选用坩埚.(3)、在搪瓷和陶瓷器具表面的釉质中含有极微量的Pb、Cd和Sb等有毒的金属盐类,为防止中毒,不能长期盛放下列物质中的 .A、食用植物油 B、酱油 C、食醋 D、酒(4)、工业上制备陶瓷的主要原料是 , 我国陶都的陶器和瓷都的瓷器在世界上享有盛名.