鲁教版初中化学九年级下册第九单元 金属 单元测试卷
试卷更新日期:2022-02-07 类型:单元试卷
一、单选题
-
1. 下列有关金属或合金的说法正确的是( )A、合金属于单质 B、铁在潮湿的空气中不易生锈 C、铜的导电性好,常用于电线电缆 D、铝的金属活动性强,在空气中易被腐蚀
-
2. 下列金属,常温下一般不能与稀盐酸发生置换反应的是( )A、镁 B、锌 C、铁 D、铜
-
3. 等质量的铁粉和锌粉与足量的同浓度的稀硫酸反应,下列图象正确的是( )A、
 B、
B、 C、
C、 D、
D、
-
4. 把含杂质(不与酸反应,也不溶于水)的锌粒样品7g,加入到100g稀硫酸中,恰好完全反应后,所得的溶液的质量是106.3g,则该样品中含锌的质量分数是( )A、80% B、92.9% C、54% D、缺少数据,无法确定
-
5. 现有质量相等的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中均显+2价)。则下列说法错误的是( )
 A、完全反应所需时间:丙>甲>乙 B、生成氢气的质量:甲>乙>丙 C、相对原子质量:乙>丙>甲 D、消耗硫酸的质量:甲>乙>丙
A、完全反应所需时间:丙>甲>乙 B、生成氢气的质量:甲>乙>丙 C、相对原子质量:乙>丙>甲 D、消耗硫酸的质量:甲>乙>丙 -
6. 学校是我们共同的家,下列关于学校的一些说法错误的是( )A、学校外面的铁制围栏喷漆的主要目的是防锈 B、学校的大厅采用大理石地面,大理石的主要成分是碳酸钙 C、学校卫生间的水龙头为了防止生锈表面镀了一层铬 D、学校的铁柜采用的是铁合金,钢板的含碳量在0.02%-3%之间。
-
7. 下图是探究铁制品锈蚀的条件时设计的实验。下列说法中错误的是( )
 A、一周后,只有丁实验铁钉生锈明显 B、甲和丁对比实验,探究的是水对铁生锈的影响 C、乙和丙对比实验,探究的是空气对铁生锈的影响 D、丙和丁对比实验,探究的是空气对铁生锈的影响
A、一周后,只有丁实验铁钉生锈明显 B、甲和丁对比实验,探究的是水对铁生锈的影响 C、乙和丙对比实验,探究的是空气对铁生锈的影响 D、丙和丁对比实验,探究的是空气对铁生锈的影响
二、综合题
-
8. 日常生活离不开金属,高科技新材料的开发和应用也需要金属。(1)、地壳中含量最高的金属元素是。(2)、根据下图的金属应用实例推断,金属具有的物理性质有。
 (3)、日常使用的金属材料多数属于合金。下表列出了一些常见合金的主要成分和性能。
(3)、日常使用的金属材料多数属于合金。下表列出了一些常见合金的主要成分和性能。合金
合金的主要性能
主要成分及纯金属的性能
焊锡
熔点183℃
锡:熔点232℃;铅:熔点327℃。
硬铝
强度和硬度好
铝、铜、镁等。硬度小,质软。
不锈钢
抗腐蚀性好
不锈钢的成分有铁、铬、镍等,纯铁抗锈蚀性能不如不锈钢。
由上表可以推断,与组成合金的纯金属相比,合金的优点一般有(填序号)。
①硬度更低 ②硬度更高 ③熔点更高 ④抗腐蚀性能更好
-
9. 钢铁工业是一个国家的支柱产业。(1)、现有:①赤铁矿(主要成分Fe2O3) ②磁铁矿(主要成分Fe3O4) ③黄铁矿(主要成分FeS2)三种铁矿石。请从经济效益和环境保护的角度分析三种矿石中不适合用于炼铁的是(填序号)。(2)、如图为实验室模拟工业炼铁的装置。

①硬质玻璃管中发生反应的化学方程式为。
②关于该实验的说法正确的是(填字母)。
A.实验时应先点燃酒精喷灯后通入CO
B.反应过程中可观察到a处固体由黑色逐渐变成红棕色
C.一氧化碳有毒,在c处将其点燃或用气囊收集以防止污染空气
D.硬质玻璃管中发生的化学反应属于置换反应
-
10. 认识金属铁,铁是目前世界上使用最多的金属。(1)、从宏观看,铁由组成:从微观看,铁由构成。(2)、硫酸铜溶液不能用铁制容器盛放的原因是(用化学方程式表示)。(3)、工业上用一氧化碳和赤铁矿(主要成分是Fe2O3)炼铁的化学方程式是 , 该反应利用了一氧化碳的哪种化学性质:。某钢铁厂每天需消耗4800t含Fe2O3 76%的赤铁矿石,该厂理论上可日产含Fe 96%的生铁的质量是t。(4)、实验室探究铁、铜的金属活动性顺序,除铁、铜外,还需要的一种试剂可以是____。A、稀盐酸 B、FeSO4溶液 C、CuSO4溶液 D、Al2(SO4)2溶液(5)、某化学兴趣小组进行铁锈蚀条件的探究实验。实验中通过对比(填序号)。试管中的现象,证明铁生锈需要氧气。为了防止钢铁锈蚀,通常采用的方法是在其表面涂刷矿物油或镀上其它金属形成覆盖保护膜,这些方法能防止锈蚀的原理是:。

-
11. 金属制品与我们的日常生活密不可分。(1)、通常在铁栏杆表面喷涂油漆,其防锈原理是。(2)、有镁、铝、铜三种金属,其中不能与稀硫酸发生反应的是。(3)、向Cu(NO3)2和AgNO3的混合溶液中,加入一定量的Zn粉,充分反应后过滤,向所得固体物质中加入盐酸没有气体产生,则固体中一定有。
-
12. 从含FeSO4和CuSO4的废液中回收Cu并制FeSO4•7H2O实验方案如下:
 (1)、金属X应选用(填序号)。
(1)、金属X应选用(填序号)。a.Zn b.Cu c.Fe
(2)、操作a、b中所用玻璃仪器有:烧杯、、玻璃棒。(3)、证明所加稀硫酸过量的方法是:取操作b所获固体,加入 , 无现象。(4)、用加热方法干燥固体,所得Cu不纯,原因是。上述所制产品中FeSO4质量(填“大于”、“小于”或“等于”)原废液中的FeSO4。 -
13. 氯化铁溶液能腐蚀铜,工业上常用此原理生产印刷线路板.以下是印刷线路板的生产及废液的处理过程:

请回答下列问题:
(1)、步骤②中发生了两个反应:2FeCl3+Fe═3FeCl2和;(2)、滤渣的成分有 , 步骤③中发生反应的化学方程式是;(3)、该流程中可以循环利用的物质是。(4)、向氧化铜和铁粉的混合物中,加入一定量的稀硫酸,反应停止后,过滤,除去不溶物.向滤液中加一铁片,未看到铁片有任何变化.则滤出的不溶物中一定含有 , 可能含有金属单质 , 滤液中一定含有 , 不可能含有。 -
14. 金属及金属材料在生产、生活中有广泛的应用。(1)、铁是年产量最高的金属,也是人体中不可缺少的微量元素,饮食中常用的调料——铁强化酱油,主要目的是为了预防。(2)、近年来,我省多地纷纷开展文明城市创建工作,垃圾分类回收是其中一项重要举措。
①垃圾桶使用铝合金做内筒的优点是(写出一点即可)。某品牌饮料的空易拉罐应收入(填“可回收”或“不可回收”)筒中。
②铁制品锈蚀的过程,实际上是铁跟空气中的发生化学反应的过程;写出稀盐酸除铁锈反应的化学方程式。
(3)、在金属活动性顺序中Al>Cu>Ag,将一定质量的铁粉加入到Al(NO3)3、Cu(NO3)2、AgNO3三种物质的混合溶液中,充分反应后过滤,得到滤液和滤渣。下列有关说法正确的是______(填字母)。A、若滤液为蓝色,则滤渣中一定有银,可能有铜 B、若滤渣中含有银、铜、铁,则滤液中一定含有Al3+、Fe3+、Cu2+、 C、若滤液为浅绿色,则滤渣中一定含银、铜、铝 D、若滤渣中加稀盐酸无气泡产生,则滤液中一定有Al3+、Fe2+、Cu2+ , 可能有Ag+(4)、现有Mg和Fe粉末混合物共8g,加入足量稀硫酸完全溶解后,经测定溶液质量仅增加了7.6g,则反应中生成的硫酸盐的质量总和为g。 -
15. “嫦娥飞天”“中国高铁”等“中国制造”,展现了“中国智慧”,增强了中华民族的自信心和自豪感。根据所学知识回答下列问题:
 (1)、“嫦娥四号”探测器悬梯等关键部件采用铝合金而不采用纯铝,原因是。(2)、“复兴号”动车高速运行离不开铁轨。建造铁轨需要大量钢铁,钢铁属于(填“金属材料”“复合材料”或“合成材料”)。(3)、建造铁轨所需要的钢铁通常用还原铁矿石制得,在一氧化碳还原氧化铁的实验装置中,a处看到的现象是 , 反应的化学方程式为。从环境保护角度考虑,装置中存在明显不足,改进的方法是。(4)、每年全世界钢铁的产量很高,但钢铁的锈蚀也给人类带来了巨大的损失。铁在空气中锈蚀,实际上是铁跟共同作用的结果;防止铁生锈的方法是(写一种)
(1)、“嫦娥四号”探测器悬梯等关键部件采用铝合金而不采用纯铝,原因是。(2)、“复兴号”动车高速运行离不开铁轨。建造铁轨需要大量钢铁,钢铁属于(填“金属材料”“复合材料”或“合成材料”)。(3)、建造铁轨所需要的钢铁通常用还原铁矿石制得,在一氧化碳还原氧化铁的实验装置中,a处看到的现象是 , 反应的化学方程式为。从环境保护角度考虑,装置中存在明显不足,改进的方法是。(4)、每年全世界钢铁的产量很高,但钢铁的锈蚀也给人类带来了巨大的损失。铁在空气中锈蚀,实际上是铁跟共同作用的结果;防止铁生锈的方法是(写一种)
三、实验探究题
-
16. 实验室用如图装置模拟工业炼铁。
 (1)、A装置玻璃管里可观察到的现象是。(2)、B装置的作用是。(3)、C装置酒精燃烧的化学方程式为。
(1)、A装置玻璃管里可观察到的现象是。(2)、B装置的作用是。(3)、C装置酒精燃烧的化学方程式为。 -
17.(1)、化学小组活动中,同学们在实验室将一定量铁丝加入含有Mg(NO3)2、Cu(NO3)2和AgNO3的溶液中,一定发生反应的发生化学方程式。(2)、充分反应后,过滤得到滤液A和滤渣B.小组同学对滤液A和固体B的成分进行探究。
(猜想与假设)滤渣B中含有哪些成分
甲同学的猜想:Ag、Cu
乙同学的猜想:Ag
丙同学猜想是
丁同学的猜想:Ag、Cu、Fe、Mg
(3)、(反思与评价)大家讨论认为丁同学的猜想是错误的,其理由为:。(4)、(实验探究)小亮将用砂纸打磨过洁净的铁丝伸入到滤液A中,无明显现象,由此推测滤液A的溶质为。(5)、(总结与归纳)经过讨论,同学们绘制出了加入铁丝时溶液中阳离子随时间的变化图象。其中③代表的离子 , (填符号)。 (6)、(归纳与总结)对于含有多种金属化合物的溶液与某一种金属反应时,溶液中活动性(填“强”或“弱”)的金属先被置换出来。
(6)、(归纳与总结)对于含有多种金属化合物的溶液与某一种金属反应时,溶液中活动性(填“强”或“弱”)的金属先被置换出来。 -
18. 结合下列有关铁的实验,回答下列问题:
 (1)、A实验,观察到铁片表面有气泡产生,溶液逐渐变成。(2)、B实验,通过明显现象,由此可判断铁的活动性比铜强;(3)、C实验
(1)、A实验,观察到铁片表面有气泡产生,溶液逐渐变成。(2)、B实验,通过明显现象,由此可判断铁的活动性比铜强;(3)、C实验(实验目的)。
(4)、(实验现象)试管c中铁钉表面生锈,试管a和试管b中铁钉表面。(5)、(实验结论)试管对比,说明铁生锈需要氧气;试管对比,说明铁生锈需要水。(6)、(问题交流)试管a中用植物油密封的目的是。 -
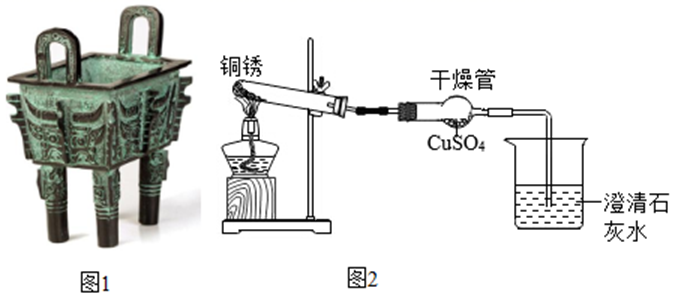
19. 古文献记载:距今5000~4000年我国古代人们已开始冶铸青铜器(如图1)。青铜器表面常会有一层铜锈,同学们对铜锈开展了以下探究活动。
查阅资料:
(1)、活动一:探究铜锈的组成用图2所示的实验装置隔绝空气加热铜锈,观察到澄清石灰水变浑浊,干燥管内白色粉末变为蓝色,试管中固体由绿色变为黑色。
(交流讨论)
由活动一推测,铜锈中含有的元素有;烧杯中发生反应的化学方程式为。
(2)、活动二:探究铜生锈的条件(做出猜想)在活动一的基础上,猜想铜生锈的条件是铜与H2O、CO2同时接触。
(进行实验)
序号
①
②
③
④
实验
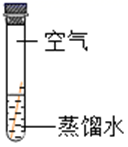

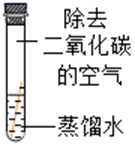
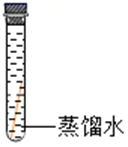
现象
铜片表面有绿色物质
无明显现象
无明显现象
无明显现象
(得出结论)铜生锈的条件是与H2O、CO2同时接触。
(反思评价)
小组同学做出“铜生锈的条件是铜与H2O、CO2同时接触”这一猜想的理由是。
(3)、对比实验①③得到的结论是。(4)、能说明铜生锈与H2O有关的实验是(填序号)(5)、经过反思,小刚同学对所得结论提出疑问:与氧气接触也可能是铜生锈的条件之一。小丽同学认为实验①、④对比即可说明铜生锈与氧气有关。请判断小丽的说法是否正确并说明理由:。(6)、通过实验证明,铜生锈的条件是铜与氧气、二氧化碳和水同时接触。由此,你对保存铜制品的建议是。
四、计算题
-
20. 现在的鞍钢集团是世界第三大钢铁公司,是涵盖矿石开采、钢铁炼制、钢铁加工全产业链的大型钢铁联合企业。重组本钢后,公司有望实现年产粗钢7000Wt(万吨),产铁精矿5000Wt的战略目标。假设粗钢中含铁98%,铁精矿中Fe2O3含量为90%(其他为不含铁的杂质)。请计算:(1)、Fe2O3中铁的质量分数为。(不书写计算过程,计算结果保留至1%)(2)、现今鞍钢集团铁矿石的自给率?(矿石自给率是指企业自产矿石占企业所需矿石总量的百分比。请依据化学方程式计算并书写计算过程,计算结果保留至1%)。
-
21. 已知锌、镁与稀硫酸反应的化学方程式为: , ,相同质量的锌和镁分别与足量的稀硫酸反应,产生的氢气的质量之比是多少?
