鲁教版初中化学九年级下册第九单元 第二节 金属的化学性质
试卷更新日期:2022-02-07 类型:同步测试
一、单选题
-
1. 科学精神与社会责任,是化学学科素养更高层面的价值追求。化学实践小组的同学欲探究镁、铁、铜三种金属的活动性顺序,下列实验方案可行的是( )A、Fe、Cu、MgSO4溶液 B、FeSO4溶液、Cu、MgSO4溶液 C、Fe、CuSO4溶液、MgSO4溶液 D、Fe、Mg、CuSO4溶液2. 归纳总结是学习化学的重要方法,下列归纳错误的是( )A、地壳中元素的含量 B、氮元素的化合价 C、常见气体的密度 D、金属的活动性顺序3. 已知金属锰在金属活动性顺序中位于铝和锌之间.下列化学反应不能发生的是( )A、Mn+2HCl=MnCl2+H2↑ B、Mg+MnSO4=MgSO4+Mn C、Fe+MnSO4=FeSO4+Mn D、Mn+CuSO4=MnSO4+Cu4. 取一定量的Mg放入到Cu(NO3)2溶液中充分反应后过滤,得到固体和滤液,下列说法错误的是( )A、固体中只有铜时,滤液可能呈蓝色 B、固体中一定有铜,滤液中一定有Cu(NO3)2 C、固体中有Mg和Cu时,滤液一定呈无色 D、固体中只有铜时,滤液中可能没有Cu(NO3)25. 为验证锌、铜、银三种金属的活动性顺序,设计了下列四种方案,其中不合理的是( )A、
 B、
B、 C、
C、 D、
D、 6. 下列图示,能表示铁粉投入足量稀盐酸后,生成的氢气质量和反应时间的关系的是( )A、
6. 下列图示,能表示铁粉投入足量稀盐酸后,生成的氢气质量和反应时间的关系的是( )A、 B、
B、 C、
C、 D、
D、 7. 镁和铝分别与足量的稀盐酸反应,若生成氢气的质量相等,则参加反应的镁和铝的质量之比为( )A、3:2 B、4:3 C、1:1 D、1:28. 在64.0g铁粉中先后加稀硫酸和CuSO4溶液,固体质量(g)与所加溶液质量的关系如图示。下列说法错误的是( )
7. 镁和铝分别与足量的稀盐酸反应,若生成氢气的质量相等,则参加反应的镁和铝的质量之比为( )A、3:2 B、4:3 C、1:1 D、1:28. 在64.0g铁粉中先后加稀硫酸和CuSO4溶液,固体质量(g)与所加溶液质量的关系如图示。下列说法错误的是( )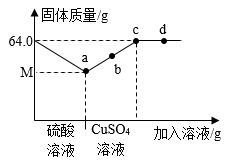 A、b点固体能完全溶于足量稀硫酸 B、d点对应溶液含两种溶质 C、M的值为56.0 D、a、c点对应溶液中FeSO4质量比为1∶89. 将足量X、Y、Z、M四种金属分别投入等质量、等质量分数的稀盐酸中(反应关系如图甲),把金属Y、Z分别投入硝酸银溶液中(反应关系如图乙),据此判断X、Y、Z、M的金属活动性顺序是( )
A、b点固体能完全溶于足量稀硫酸 B、d点对应溶液含两种溶质 C、M的值为56.0 D、a、c点对应溶液中FeSO4质量比为1∶89. 将足量X、Y、Z、M四种金属分别投入等质量、等质量分数的稀盐酸中(反应关系如图甲),把金属Y、Z分别投入硝酸银溶液中(反应关系如图乙),据此判断X、Y、Z、M的金属活动性顺序是( ) A、M>X>Y>Z B、M>X>Z>Y C、X>M>Z>Y D、X>M>Y>Z
A、M>X>Y>Z B、M>X>Z>Y C、X>M>Z>Y D、X>M>Y>Z二、多选题
-
10. 将一定量的铝粉投入到含溶质为Mg(NO3)2、Cu(NO3)2、AgNO3的溶液中,充分反应后过滤,滤液呈蓝色。下列说法错误的是( )A、滤渣中一定有Ag、Cu B、滤渣中一定有Ag,可能有Cu,没有Mg C、滤液中一定没有Cu(NO3)2、AgNO3 D、滤液中一定有Al(NO3)3、Mg(NO3)211. 现有锌和另一种金属组成的混合物,在6.5g该混合物中加入100g一定溶质质量分数的稀盐酸,两者恰好完全反应,产生氢气的质量为m。下列说法正确的是( )A、若混合物含有Fe,m一定大于0.2g B、若混合物含有Al,m可能是0.2g C、若混合物含有Al,则稀盐酸中溶质质量分数一定大于7.3% D、若混合物含有Fe,m等于0.2g,则该混合物中铁的质量分数为50%12. 向一定质量的 AgNO3 和 Zn(NO3)2 的混合溶液中加入过量铁粉,充分反应后过滤,得到一 定温度下的滤液(不饱和)和滤渣。下列有关说法中,合理的是( )A、滤液一定为浅绿色 B、滤渣质量一定大于加入铁粉的质量 C、滤液中一定有 Ag+、Fe2+和 Zn2+ D、滤渣中加入稀盐酸一定有大量气泡冒出
三、填空题
-
13. 设计从废水中回收硫酸亚铁固体和铜的实验方案如下:
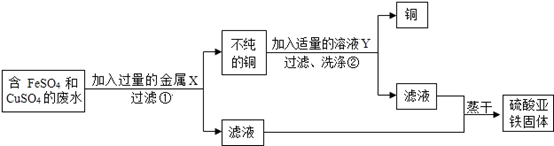
金属X是 , 写出上述实验方案中有关反应的化学方程式:①;②。
14. 为验证铁、铜、银的金属活动性顺序,某同学设计了以下四组实验。 (1)、实验①的化学方程式是。(2)、为了能验证金属活动性:Fe>Cu>Ag,实验④中X为 , Y为溶液。
(1)、实验①的化学方程式是。(2)、为了能验证金属活动性:Fe>Cu>Ag,实验④中X为 , Y为溶液。四、综合题
-
15. 利用锌渣(主要成分是Zn和FeSO4)制备氯化锌的主要工艺流程如下图所示:
 (1)、粉碎锌渣的目的是。(2)、反应器1中发生的主要反应有① ;② ;③(填一个即可)。(3)、反应器2中发生的主要反应的基本反应类型是。(4)、上述流程中,装置X的作用是。16. 金属在生产生活中有广泛应用。(1)、下列用途主要利用金属导电性的是______(填字母序号)。A、铁锅 B、铜导线 C、水龙头(2)、人类很早就开始使用金属,下列记载均与金属有关,请按要求填空。
(1)、粉碎锌渣的目的是。(2)、反应器1中发生的主要反应有① ;② ;③(填一个即可)。(3)、反应器2中发生的主要反应的基本反应类型是。(4)、上述流程中,装置X的作用是。16. 金属在生产生活中有广泛应用。(1)、下列用途主要利用金属导电性的是______(填字母序号)。A、铁锅 B、铜导线 C、水龙头(2)、人类很早就开始使用金属,下列记载均与金属有关,请按要求填空。①“金(即钢)柔锡柔,合两柔则刚。”
②何意百炼钢,化为绕指柔(“百炼钢”指生铁经过高温煅烧,反复锤炼成为钢)。
③东晋《抱朴子》中记载:“以曾青涂铁 , 铁赤色如铜”(“曾青”即硫酸铜溶液)。
④美人首饰侯王印,尽是沙中浪底来(“首饰”、“印”指金制品)。
①~④划线部分,发生置换反应的化学方程式为;①说明合金与组成它的纯金属相比,具有的优点是。
(3)、金属锂和钛均不在初中学到的金属活动性顺序表中,某小组想通过金属与稀盐酸的反应比较锂、铝的活动性,进行实验时应控制的变量除温度、金属颗粒形状大小外,还有。钛的活动性位于铜、铝之间,预测钛能与、(写出两种不同类别物质的化学式)等物质反应。(4)、化学小组对含有硫酸铜和硫酸锌的废液进行了如下图所示的处理:
滤液的成分中一定含有的溶质是(填化学式);滤液质量原混合溶液(填“>”、“<”或“=”)。
(5)、现有镁和另一种金属组成的混合物,取2.4g该混合物加入100g一定溶质质量分数的稀硫酸,两者恰好完全反应,产生氢气的质量为a.下列说法正确的是______。A、若混合物为Mg、Al,a可能是0.2g B、若混合物为Mg、Fe,a不可能是0.2g C、若混合物为Mg、Zn,a可能是0.1g,则该混合物中镁的质量分数为50% D、若混合物为Mg、Al,则稀硫酸中溶质质量分数一定不大于9.8%17. 金属及其制品是现代生活中常见的材料,请回答下列问题:(1)、铁和铝都可以制作炊具,主要利用了它们的(填“导电”或“导热”)性。(2)、依据金属活动性顺序,可知人类对铝的利用要比铜和铁(填“早”或“晚”)得多。(3)、有X、Y、Z三种不同的金属,分别与硫酸铜溶液、稀硫酸反应,实验记录如下表(表中“√”表示能反应,“一”表示不能反应)则X、Y、Z三种金属元素活动性由强到弱的顺序是。X
Y
Z
硫酸铜溶液
一
√
√
稀硫酸
一
√
一
(4)、向硫酸亚铁和硫酸铜的混合溶液中加入一些锌粉,充分反应后过滤。若向滤渣中滴加稀盐酸有气泡产生,则滤渣中一定含有的金属是 , 滤液中一定含有的溶质是。18. 金属材料在我们的生产、生活中有着广泛的应用。(1)、钢铁是目前使用最多的金属材料。生铁和钢是含碳量不同的两种铁合金,生铁的含碳量(填“高于”“等于”或“低于”)钢的含碳量。(2)、2021年初,我国成功研制出首台3.35米直径的铝锂合金运载火箭大型贮箱工程样机,有望显著提升火箭运力。铝锂合金的密度比钢铁要 , 硬度比纯铝要。(3)、为回收含Fe(NO3)2、Cu(NO3)2、AgNO3的废液中的Ag,制定实验流程如下。
①步骤I中反应的化学方程式是。
②除水、AgNO3外,滤液C中还有。(填化学式)
③若经过步骤Ⅳ后得到了43.2g的Ag,则a=。
④如果将步骤I中的Cu原子换成同样个数的Fe原子,则最后得到的Ag的质量(填“会”或“不会”)改变,因为。
19. 金属的回收利用是保护金属资源的有效途径。某学校化学兴趣小组打算从混有金属镁、铁、铜的废弃粉末中分离、提取出化工原料MgSO4和有关金属,实验过程如下: (1)、金属A为(填化学式)。(2)、操作a的名称是;在该过程中需要使用玻璃棒,其作用是。(3)、写出步骤②所涉及的化学方程式: , 进行该操作时,需要通风并远离火源,其原因是。(4)、步骤②中除了加入稀硫酸外,还可选用另一种试剂是(填化学式)溶液。(5)、根据图中数据,计算理论上蒸发可得到MgSO4固体的质量为g(不考虑实验过程中的损耗)。20. 下图中的A~I表示几种初中化学常见的物质,其中A、D、I是氧化物,I是一种有毒气体,B单质中的元素在地壳中的含量位居第三,C由三种元素组成,G为紫红色。图中“一”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系,部分反应物、生成物或反应条件已略去。
(1)、金属A为(填化学式)。(2)、操作a的名称是;在该过程中需要使用玻璃棒,其作用是。(3)、写出步骤②所涉及的化学方程式: , 进行该操作时,需要通风并远离火源,其原因是。(4)、步骤②中除了加入稀硫酸外,还可选用另一种试剂是(填化学式)溶液。(5)、根据图中数据,计算理论上蒸发可得到MgSO4固体的质量为g(不考虑实验过程中的损耗)。20. 下图中的A~I表示几种初中化学常见的物质,其中A、D、I是氧化物,I是一种有毒气体,B单质中的元素在地壳中的含量位居第三,C由三种元素组成,G为紫红色。图中“一”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系,部分反应物、生成物或反应条件已略去。 (1)、写出G的化学式:。(2)、写出B→A反应的化学方程式:。(3)、写出E→G反应的化学方程式:。(4)、写出H→I反应的化学方程式: , 此反应为。反应(填“吸热”或“放热”)。
(1)、写出G的化学式:。(2)、写出B→A反应的化学方程式:。(3)、写出E→G反应的化学方程式:。(4)、写出H→I反应的化学方程式: , 此反应为。反应(填“吸热”或“放热”)。五、实验探究题
-
21. 某化学兴趣小组的学生,发现金属R不在初中学到的金属活动性顺序表中,该小组为了了解R与常见金属铝、铜的金属活动性顺序,进行如下探究活动。(查阅资料得知:R是一种银白色的金属,RSO4溶液呈蓝色;硫酸铝、氯化铝、硝酸铝的溶液均为无色)(1)、作出猜想:他们对三种金属的活动性顺序作出如下猜想
猜想一:Al>Cu>R,猜想二: , 猜想三:R>Al>Cu。
(2)、实验探究:为了探究哪一种猜想成立,甲、乙、丙三位同学分别针对猜想一、猜想二、猜想三设计实验方案并展开实验探究。猜想
主要操作
主要现象
实验结论
一
打磨R丝,并将其插入到硫酸铜溶液中
R丝表面覆盖了一层红色的物质
猜想一
(“成立”或“不成立”)
二
打磨粗细相同的R丝、铝丝、铜丝,分别将它们插入到体积相同、溶质质量分数也相同的稀硫酸中
①R丝表面产生气泡缓慢,溶液由无色逐渐变成蓝色
②铝丝表面产生气泡较快
③铜丝表面没有气泡产生
猜想二成立
三
把铝丝插入RSO4溶液中
猜想三成立
(3)、交流反思:究竟哪种猜想成立?三位同学经讨论交流,发现丙同学在实验前没有打磨铝丝,这可能会导致实验结论不正确。于是他们先打磨铝丝,主要目的是 , 再将其插入到RSO4溶液中,一段时间后,溶液的颜色由变为;进而确认猜想三不成立,猜想二成立。写出Al与稀硫酸反应的化学方程式:。22. 小彬同学家新买了水龙头,从说明书上了解到该水龙头是铜质镀铬的。他想起在学习金属性质时用到的金属活动性顺序中没有铬,为了了解铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,进行了如下探究活动。(查阅资料)铬(Cr)是银白色有光泽的金属,铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液……铝是银白色有光泽的金属,能与稀硫酸反应,生成无色的硫酸铝溶液……
(预测)三种金属在金属活动性顺序中的相对位置关系:
①Cr Al Cu ②Al Cr Cu ③Al Cu Cr
(实验过程)取大小相同的三种金属薄片,用砂纸打磨光亮。
实验一
实验二
实验三
实验
方案



实验
现象
铬片表面产生气泡缓慢,溶液变蓝色。
铝片表面产生气泡较快。
结论
铬能和稀硫酸发生反应,产生氢气,但反应速率较慢。
铜不与稀硫酸反应
三种金属在金属活动性顺序中的相对位置关系是
(回答问题)
⑴完成上述表格中的空白。
⑵用砂纸打磨金属片的目的是。
⑶实验一所发生反应的化学方程式是。
六、计算题
-
23. 将13克的锌粒放入87.4克的稀盐酸中,当锌粒完全反应后:(1)、最多可以放出多少克的氢气?(2)、盐酸溶液中溶质的质量分数是多少?