鲁教版初中化学九年级下册第八单元 第二节 海水“晒盐”
试卷更新日期:2022-02-07 类型:同步测试
一、单选题
-
1. 《天工开物》中对“海水盐”有如下描述:“ 凡煎盐锅古谓之‘牢盆’,……其下列灶燃薪,多者十二三眼,少者七八眼,共煎此盘,……燃釜底,滚沸延及成盐。”文中没有涉及到的操作是( )A、加热 B、结晶 C、蒸发 D、过滤2. 下列利用海洋资源的做法不可取的是( )A、海水引入盐田进行晒盐 B、利用潮汐发电 C、合理开发利用海底矿物 D、工业废水直接排入海水中稀释3. 下列有关实验操作中正确的是( )A、
 滴加液体
B、
滴加液体
B、 过滤液体
C、
过滤液体
C、 读取液体
D、
读取液体
D、 加热液体
4. 下列关于“10%的硝酸钾溶液”含义的说法中,错误的是( )A、100 g水中溶解了10 g硝酸钾 B、100 g硝酸钾溶液中有10 g硝酸钾 C、将10 g硝酸钾溶于90 g水中所得的溶液 D、将硝酸钾与水按1∶9的质量比配制的溶液5. a、b、c三种固体物质的溶解度曲线如图所示。下列说法正确的是( )
加热液体
4. 下列关于“10%的硝酸钾溶液”含义的说法中,错误的是( )A、100 g水中溶解了10 g硝酸钾 B、100 g硝酸钾溶液中有10 g硝酸钾 C、将10 g硝酸钾溶于90 g水中所得的溶液 D、将硝酸钾与水按1∶9的质量比配制的溶液5. a、b、c三种固体物质的溶解度曲线如图所示。下列说法正确的是( )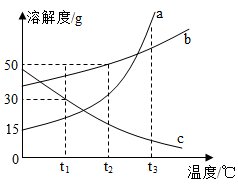 A、t1℃时,a物质的溶解度是30g B、t2℃时,b的饱和溶液中溶质的质量分数为50% C、t3℃时,各取15ga、b、c三种物质分别加入到50g水中充分溶解,能得到饱和溶液的是c D、t3℃时:a、b、c三种物质的饱和溶液均降温到t1℃,三种物质溶质质量分数大小关系为b>c>a6. 物质的溶解度随温度变化的曲线叫做溶解度曲线。利用溶解度曲线,可以获得许多有关物质溶解度的信息。甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )
A、t1℃时,a物质的溶解度是30g B、t2℃时,b的饱和溶液中溶质的质量分数为50% C、t3℃时,各取15ga、b、c三种物质分别加入到50g水中充分溶解,能得到饱和溶液的是c D、t3℃时:a、b、c三种物质的饱和溶液均降温到t1℃,三种物质溶质质量分数大小关系为b>c>a6. 物质的溶解度随温度变化的曲线叫做溶解度曲线。利用溶解度曲线,可以获得许多有关物质溶解度的信息。甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( ) A、K点表示在t℃时,甲、乙的溶解度不相等 B、35℃时,将20g甲物质加入50g水中,充分溶解后得到的甲物质溶液的质量是70g C、t℃时乙物质的饱和溶液,升温到35℃时仍是饱和溶液 D、甲物质的溶解度比乙物质大7. 下图是甲、乙、丙、丁四种物质的溶解度曲线,温度为t℃时,将等质量甲、乙、丙、丁四种物质分别加到100g水中,充分搅拌后只得到一种饱和溶液,该饱和溶液中的溶质是( )
A、K点表示在t℃时,甲、乙的溶解度不相等 B、35℃时,将20g甲物质加入50g水中,充分溶解后得到的甲物质溶液的质量是70g C、t℃时乙物质的饱和溶液,升温到35℃时仍是饱和溶液 D、甲物质的溶解度比乙物质大7. 下图是甲、乙、丙、丁四种物质的溶解度曲线,温度为t℃时,将等质量甲、乙、丙、丁四种物质分别加到100g水中,充分搅拌后只得到一种饱和溶液,该饱和溶液中的溶质是( ) A、甲 B、乙 C、丙 D、丁8. MgSO4的溶解度曲线如下图所示,欲使其60℃接近饱和的溶液变为饱和溶液,可采取的措施有( )
A、甲 B、乙 C、丙 D、丁8. MgSO4的溶解度曲线如下图所示,欲使其60℃接近饱和的溶液变为饱和溶液,可采取的措施有( )
①增加溶质②蒸发溶剂③升高温度④降低温度
A、①②③ B、①②④ C、①② D、①②③④9. 下列有关海水晒盐的几种说法,错误的是( )A、结晶池中析出盐后的母液没有用途,为防止污染须排入大海 B、盐场必须建在阳光充足、雨量少的地区 C、海水成为食盐的饱和溶液后才能析出晶体 D、盐场利用日晒、风吹晒盐,采取的是蒸发结晶的方法10. 晾晒海水获得的粗盐中含有可溶性杂质MgCl2、CaCl2等。现要除去粗盐溶液中的MgCl2和CaCl2 , 需先依次加入足量的a和b,过滤后再加c。则a、b、c分别是( )A、Na2CO3 稀盐酸NaOH B、K2CO3NaOH稀盐酸 C、NaOHNa2CO3稀盐酸 D、KOH稀盐酸Na2CO3二、综合题
-
11. 走进晒盐厂(1)、用海水晒盐:从海水中提取获得食盐氯化钠,通常采用的方法是。(2)、根据氯化钠和硝酸钾的溶解度表与溶解度曲线回答下列问题:

温度/℃
10
30
50
60
溶解度/g
氯化钠
35.8
36.3
37
37.3
硝酸钾
20.9
45.8
85.5
110
①30℃时,氯化钠的溶解度硝酸钾的溶解度(填“大于”、“小于”或“等于”)。
②图中表示硝酸钾溶解度曲线的是(填“A“或“B”)。
③30℃时,将50g硝酸钾放入100g水中,所得溶液是溶液(填“饱和”或“不饱和”),继续加热至60℃,下列各量一定变大的是(填字母序号)。
A.溶质质量 B.溶剂质量 C.溶解度 D.溶质的质量分数
12. 某同学通过下列实验步骤测定5克粗盐中精盐含量(假定只含不溶性杂质)。(1)、称量粗盐→溶解→→→冷却干燥→称量精盐称量粗盐:用(填一仪器名称,下同)称3g粗盐,称量时托盘上需垫上一张光洁干净的。称量时应在托盘上先后进行另一操作(填“按去皮键”或“放称量纸”)。
(2)、溶解:用量筒量取一定体积的蒸馏水,读数时,视线要与量筒内液体保持水平。下图是10mL量筒的片段,根据图示,所取的水的体积是mL。将称量好的粗盐和蒸馏水放入烧杯中溶解。 (3)、称量精盐:最后得到的精盐属于(填“纯净物”或“混合物”),若某同学在实验后得到的精盐产率偏低,则可能的原因是(填字母)。
(3)、称量精盐:最后得到的精盐属于(填“纯净物”或“混合物”),若某同学在实验后得到的精盐产率偏低,则可能的原因是(填字母)。A.过滤时滤纸有破损 B.蒸发时有固体溅出
C.溶解含有泥沙的粗食盐时,加入的水量不足 D.蒸发后所得的精盐很潮湿
13. 下列是MgSO4和KCl的溶解度表及溶解度曲线。温度/℃
20
30
40
50
60
70
80
90
溶解度/g
MgSO4
33.7
38.9
44.5
50.6
54.6
55.8
52.9
52.2
KCl
34.0
37.0
40.0
42.6
45.5
48.3
51.1
54.0
请分析后回答下列问题:
 (1)、代表KCl溶解度曲线的是(填“甲”或“乙”)。(2)、t3℃时,等质量的两种物质饱和溶液,均降温到t1℃,析出晶体质量关系甲乙(填“>”“<”或“无法确定”).(3)、t2℃的范围为____(填字母)。A、30-40 B、40-50 C、70-80 D、80-90(4)、t3℃时MgSO4的饱和溶液降温到t1℃,溶液中溶质的质量分数的变化情况是____(填字母)。A、始终不变 B、先增大后减小 C、先减小后增大 D、先不变后减小 E、先不变后增大14. 从海水中提取镁、晒盐、制“碱”,都体现了人类改造物质的智慧。结合下图(其中部分操作和条件已略去),请回答相关问题:
(1)、代表KCl溶解度曲线的是(填“甲”或“乙”)。(2)、t3℃时,等质量的两种物质饱和溶液,均降温到t1℃,析出晶体质量关系甲乙(填“>”“<”或“无法确定”).(3)、t2℃的范围为____(填字母)。A、30-40 B、40-50 C、70-80 D、80-90(4)、t3℃时MgSO4的饱和溶液降温到t1℃,溶液中溶质的质量分数的变化情况是____(填字母)。A、始终不变 B、先增大后减小 C、先减小后增大 D、先不变后减小 E、先不变后增大14. 从海水中提取镁、晒盐、制“碱”,都体现了人类改造物质的智慧。结合下图(其中部分操作和条件已略去),请回答相关问题:
 (1)、海水晒盐。盐田法晒盐通常分为蒸发池和结晶池两部分。下列说法正确的是______(填字母序号)。A、气候温和、光照充足的平坦海边滩涂适合盐田法晒盐 B、在结晶池中主要通过降温结晶使氯化钠析出 C、析出粗盐后,结晶池中的母液为氯化钠的饱和溶液(2)、粗盐中含有氯化镁、硫酸钠、氯化钙等可溶性杂质,通过步骤Ⅰ,再利用过滤操作进行除杂。步骤Ⅰ加入下列三种溶液的先后顺序为(一种即可,填字母序号);
(1)、海水晒盐。盐田法晒盐通常分为蒸发池和结晶池两部分。下列说法正确的是______(填字母序号)。A、气候温和、光照充足的平坦海边滩涂适合盐田法晒盐 B、在结晶池中主要通过降温结晶使氯化钠析出 C、析出粗盐后,结晶池中的母液为氯化钠的饱和溶液(2)、粗盐中含有氯化镁、硫酸钠、氯化钙等可溶性杂质,通过步骤Ⅰ,再利用过滤操作进行除杂。步骤Ⅰ加入下列三种溶液的先后顺序为(一种即可,填字母序号);a.稍过量的Na2CO3溶液 b.稍过量的BaCl2溶液 c.稍过量的NaOH溶液
(3)、母液中有MgCl2 , 却经历了步骤Ⅳ、Ⅴ的转化过程,其目的是;(4)、步骤Ⅱ中先向饱和食盐水中通入氨气制成饱和氨盐水,再通入二氧化碳的目的是。该反应的化学方程式为;(5)、步骤Ⅱ中反应中生成NaHCO3和NH4Cl的质量比为84:53.5,结合图2请分析NaHCO3结晶析出而NH4Cl没有结晶析出的原因是 , 步骤Ⅱ中控制反应温度不超过55℃的原因是。(6)、步骤Ⅱ的滤液中获得的氯化铵固体加入熟石灰研磨可用来检验氨态氮肥,反应的化学方程式为。15. 甲、乙两种固体物质的溶解度曲线如下图所示。 (1)、t1℃时,甲、乙饱和溶液中溶质的质量分数:甲乙(填“>”“<”或“=”)。(2)、t2℃时,将60g乙物质放入100g水中,所得溶液中,溶质与溶剂的质量比为(填最简整数比)。(3)、现有t2℃时,甲、乙两种物质的饱和溶液各100,将这两种溶液分别降温到t1℃,所得溶液中溶质的质量分数甲乙(填“>”、“<”或“=”)。(4)、小明同学进行了如下图所示的实验:
(1)、t1℃时,甲、乙饱和溶液中溶质的质量分数:甲乙(填“>”“<”或“=”)。(2)、t2℃时,将60g乙物质放入100g水中,所得溶液中,溶质与溶剂的质量比为(填最简整数比)。(3)、现有t2℃时,甲、乙两种物质的饱和溶液各100,将这两种溶液分别降温到t1℃,所得溶液中溶质的质量分数甲乙(填“>”、“<”或“=”)。(4)、小明同学进行了如下图所示的实验:
上述实验过程中所得的溶液,属于不饱和溶液的是(填序号),溶液中溶质的质量分数相同的是(填序号)。
(5)、喝了汽水以后,常常会打嗝。这说明随温度升高气体的溶解度。