鲁教版初中化学九年级下册第八单元 第一节 海洋化学资源
试卷更新日期:2022-02-07 类型:同步测试
一、单选题
-
1. 下列利用海洋资源的做法不可取的是( )A、海水引入盐田进行晒盐 B、利用潮汐发电 C、合理开发利用海底矿物 D、工业废水直接排入海水中稀释2. 浩瀚无际的海洋为人类提供了丰富的资源,下列有关海洋资源的叙述错误的是( )A、利用多级闪急蒸馏法可淡化海水 B、利用锰结核可获取多种金属 C、利用向海水中加入石灰乳的方法可以将海水中的Mg2+富集沉淀出来 D、利用海底蕴藏的大量”可燃冰”作燃料,不会加剧温室效应3. 如图是某化学兴趣小组设计的制取蒸馏水的简易装置,下列说法错误的是( )
 A、石棉网的作用是使烧瓶均匀受热 B、碎瓷片的作用是防止加热时发生爆炸 C、为了加快冷凝,可以在烧杯中加入冰块 D、制得的蒸馏水是软水4. 海洋是人类巨大的资源宝库,下列说法正确的是( )A、淡化海水常用的方法有蒸发结晶法和反渗透法 B、利用海底蕴藏的大量“可燃冰”作燃料,不会加剧温室效应 C、海水淡化只能得到淡水,剩余物质不再有利用价值 D、为检验蒸馏法得到的冷凝水样中是否含有氯化钠,可向试样中滴加几滴硝酸银溶液5. 实验室对氯酸钾和二氧化锰混合制取氧气后的剩余固体进行了如下实验:(每步均充分完成,氯酸钾、氯化钾均溶于水,二氧化锰不溶于水)
A、石棉网的作用是使烧瓶均匀受热 B、碎瓷片的作用是防止加热时发生爆炸 C、为了加快冷凝,可以在烧杯中加入冰块 D、制得的蒸馏水是软水4. 海洋是人类巨大的资源宝库,下列说法正确的是( )A、淡化海水常用的方法有蒸发结晶法和反渗透法 B、利用海底蕴藏的大量“可燃冰”作燃料,不会加剧温室效应 C、海水淡化只能得到淡水,剩余物质不再有利用价值 D、为检验蒸馏法得到的冷凝水样中是否含有氯化钠,可向试样中滴加几滴硝酸银溶液5. 实验室对氯酸钾和二氧化锰混合制取氧气后的剩余固体进行了如下实验:(每步均充分完成,氯酸钾、氯化钾均溶于水,二氧化锰不溶于水)
下列说法正确的是( )
A、操作I是溶解,为了使固体混合物充分溶解,水的量越多越好 B、蒸发时,需蒸发皿、石棉网、酒精灯、铁架台 C、实验中玻璃棒用了多次,但作用各不相同 D、操作Ⅳ称量所得的固体为1.49g,该固体是氯化钾6. 下列关于海洋开发利用的说法中正确的是( )A、海水“晒盐”获得是纯净物氯化钠 B、海底的可燃冰大量燃烧后,不会造成温室效应 C、海洋是个巨人的水资源库,如何获取廉价的淡水对缓解淡水危机意义重大 D、可以从海水中直接提取纯碱7. 实验室用如图所示的装置蒸馏海水,下列说法错误的是( ) A、蒸馏烧瓶中加入沸石的目的是防止暴沸 B、蒸馏后分子没有改变 C、连接好装置,使各连接部位严密不漏气 D、该装置不需要用石棉网8. 下列有关粗盐提纯实验中的相关装置和操作,正确的是( )A、溶解粗盐
A、蒸馏烧瓶中加入沸石的目的是防止暴沸 B、蒸馏后分子没有改变 C、连接好装置,使各连接部位严密不漏气 D、该装置不需要用石棉网8. 下列有关粗盐提纯实验中的相关装置和操作,正确的是( )A、溶解粗盐 
B、过滤食盐水
B、过滤食盐水 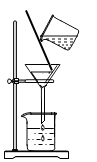
C、蒸发食盐水
C、蒸发食盐水 
D、冷却蒸发皿
D、冷却蒸发皿 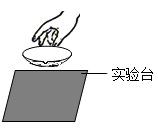
9. 已知所含元素化合价发生变化的反应是氧化还原反应,其中被还原的元素化合价降低,被氧化的元素化合价升高。海洋中有丰富的资源,如图所示利用海水可获得许多化工产品。
9. 已知所含元素化合价发生变化的反应是氧化还原反应,其中被还原的元素化合价降低,被氧化的元素化合价升高。海洋中有丰富的资源,如图所示利用海水可获得许多化工产品。
下列有关说法正确的是( )
A、第①步中除去粗盐中的SO42﹣、Ca2+、Mg2+等杂质,加入的试剂顺序为:NaOH溶液、Na2CO3溶液、BaCl2溶液,过滤后加盐酸 B、第②步中加入的试剂为BaCl2溶液 C、第③步中发生复分解反应 D、在第④步中溴元素被氧化二、综合题
-
10. 细节决定成败,规范的实验操作是决定实验成功的关键,请回答下列问题:(1)、液体药品通常盛放在里,倾倒液体药品时标签要朝向手心,防止。(2)、粗盐提纯实验的操作步骤包括、过滤、蒸发、计算产率。蒸发操作时,用玻璃棒搅拌的目的是。(3)、用6%的氯化钠溶液配制50g3%的氯化钠溶液,若量取6的氯化钠溶液时仰视读数,则所配制的氯化钠溶液的溶质质量分数(填“偏大”、“偏小”或“不受影响”)。11. 海洋中蕴含着丰富的资源,人们可以从海水中获取很多物质。
 (1)、海水淡化:膜分离技术可用于淡化海水(如右图所示),通过膜的主要微粒是。(2)、海水制镁:从海水或卤水中制备金属镁流程如下。
(1)、海水淡化:膜分离技术可用于淡化海水(如右图所示),通过膜的主要微粒是。(2)、海水制镁:从海水或卤水中制备金属镁流程如下。
①为了使海水中含量较低的镁元素富集,加入的试剂a为 , 该反应的化学方程式为 , 基本反应类型为反应,此过程富集镁元素的同时也达到了的目的。
②加入试剂b发生反应的化学方程式为。
③下列有关电解过程中能量转化的说法,正确的是(填序号)。
A.电能转化为化学能 B.化学能转化为电能 C.潮汐能转化为化学能
(3)、海水晒盐:海水中含有氯化钠、氯化钙等物质,下面是从海水中提取氯化钠的大致过程和氯化钠、氯化钙的溶解度表。
温度/℃
0
10
20
30
40
溶解度/g
氯化钠
35.7
35.8
36.0
36.3
36.6
氯化钙
59.5
65.0
74.5
100
116
①将粗盐从海水中结晶出来的方法是 , 将粗盐和母液分离的操作是。
②经长时间日晒氯化钙不易大量结晶析出的原因是。
③根据海水晒盐的原理,下列说法中错误的是(填序号)。
A.海水进入贮水池,海水的成分基本不变
B.在蒸发池里,海水中水的质量逐渐增加
C.析出晶体后的母液是氯化钠的不饱和溶液
12. 某课题小组模拟工业海水制镁的流程,在实验室制取生产镁的原料——氯化镁,设计方案如下: (1)、海水和苦卤都可以作为制取氯化镁的原料,甲同学提出选择苦卤更好,小组同学一致同意他的观点,理由是。(2)、在工业生产中为了降低成本,试剂X最好选择 , 发生反应的化学方程式是。(3)、该方案制取氯化镁时,要经历步骤Ⅰ和步骤Ⅱ两步转化,其主要目的是。(4)、小组同学按上述方案进行了实验,并制得19.0g干燥纯净的氯化镁固体。若步骤Ⅱ中溶质质量分数为10%的稀盐酸与氢氧化镁恰好完全反应,且步骤Ⅲ中氯化镁没有损失,则步骤Ⅱ中消耗稀盐酸的质量为g。13. 海洋是一个巨大的资源宝库。海水资源综合利用的部分途径如下图。
(1)、海水和苦卤都可以作为制取氯化镁的原料,甲同学提出选择苦卤更好,小组同学一致同意他的观点,理由是。(2)、在工业生产中为了降低成本,试剂X最好选择 , 发生反应的化学方程式是。(3)、该方案制取氯化镁时,要经历步骤Ⅰ和步骤Ⅱ两步转化,其主要目的是。(4)、小组同学按上述方案进行了实验,并制得19.0g干燥纯净的氯化镁固体。若步骤Ⅱ中溶质质量分数为10%的稀盐酸与氢氧化镁恰好完全反应,且步骤Ⅲ中氯化镁没有损失,则步骤Ⅱ中消耗稀盐酸的质量为g。13. 海洋是一个巨大的资源宝库。海水资源综合利用的部分途径如下图。
已知:粗盐中的杂质有泥沙、MgCl2、CaCl2 , 流程中部分操作及试剂已省略。
(1)、试剂X的作用是除去粗盐中的Ca2+ , 则试剂X为(填化学式)。(2)、“操作1”中玻璃棒的作用是 , “操作2”的名称为。(3)、滤渣中除泥沙外,还含有。(4)、实际生产中,步骤1常选用作为沉淀剂。(5)、步骤2需电解状态的MgCl2以获得金属镁。14. 我省海水资源丰富。如图是利用海水资源制取纯碱的流程。 (1)、步骤Ⅱ和Ⅲ发生反应的化学方程式为;(2)、氨碱法制纯碱的过程中要先通入氨气,再通入二氧化碳,这样做的目的是;(3)、氨盐水吸收二氧化碳后生成碳酸氢钠和氯化铵,析出碳酸氢钠固体后的溶液为碳酸氢钠的(填“饱和”或“不饱和”)溶液;(4)、“侯氏制碱法”是在氨碱法基础上,向滤出碳酸氢钠晶体后的氯化铵溶液中加入食盐,使其中的氯化铵单独结晶析出用作氮肥,氯化钠溶液则可循环利用,请写出“侯氏制碱法”的优点(写一条)。15. 利用海水(含氯化钠、氯化镁)可回收镁。(假设每步都恰好完全反应)
(1)、步骤Ⅱ和Ⅲ发生反应的化学方程式为;(2)、氨碱法制纯碱的过程中要先通入氨气,再通入二氧化碳,这样做的目的是;(3)、氨盐水吸收二氧化碳后生成碳酸氢钠和氯化铵,析出碳酸氢钠固体后的溶液为碳酸氢钠的(填“饱和”或“不饱和”)溶液;(4)、“侯氏制碱法”是在氨碱法基础上,向滤出碳酸氢钠晶体后的氯化铵溶液中加入食盐,使其中的氯化铵单独结晶析出用作氮肥,氯化钠溶液则可循环利用,请写出“侯氏制碱法”的优点(写一条)。15. 利用海水(含氯化钠、氯化镁)可回收镁。(假设每步都恰好完全反应) (1)、操作A是。(2)、写出生成氢氧化镁的化学方程式。(3)、得到氢氧化镁需要洗净,为证明是否洗净,可取洗涤液少量,向其中加入下列试剂中______。A、石灰水 B、硝酸银溶液 C、碳酸钠溶液 D、氢氧化钠溶液
(1)、操作A是。(2)、写出生成氢氧化镁的化学方程式。(3)、得到氢氧化镁需要洗净,为证明是否洗净,可取洗涤液少量,向其中加入下列试剂中______。A、石灰水 B、硝酸银溶液 C、碳酸钠溶液 D、氢氧化钠溶液