鲁教版初中化学九年级下册第七单元 第一节 酸及其性质
试卷更新日期:2022-02-07 类型:同步测试
一、单选题
-
1. 生活中常见的柠檬汁、番茄汁等物质中都含有酸类物质,它们具有相似的化学性质,这是由于( )A、溶于水时都能电离出氢离子 B、溶液中都含有酸分子 C、组成中都含有氢元素 D、溶于水时都生成了盐酸2. 下列对实验意外事故的处理错误的是( )A、若不慎将腐蚀性药液溅入眼睛,要先用手揉眼睛,再立即用水冲洗 B、若不慎将烧碱溶液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液 C、若不慎将燃着的酒精灯碰倒,洒出的酒精在桌上燃烧,应立刻用湿抹布扑盖 D、若不慎将浓硫酸沾到皮肤上应立即用大量水冲洗,然后涂上3%~5%的碳酸氢钠溶液3. 下图是物质X溶于水发生解离后的微观示意图,其中能说明X是一种盐的是( )A、
 B、
B、 C、
C、 D、
D、 4. 物质的性质决定其用途。稀盐酸常用于除铁锈,是利用了酸的一种化学通性,下列酸的用途中也利用了该通性的是( )A、用锌粒和稀硫酸制取氢气 B、用氧化铜和稀硫酸制备硫酸铜 C、用稀盐酸除去氯化钠中的碳酸钠 D、用硼酸处理皮肤上沾有的碱5. 物质的分类非常重要,下列按照酸、碱、盐的顺序排列的是( )A、HCl Na2SO4 NaCl B、Ca(OH)2 HCl Na2SO4 C、NaOH H2CO3 NaCl D、HCl NaOH Na2CO36. 下列关于浓盐酸及浓硫酸的说法中有错误的是( )A、浓盐酸稀释后可以用来给金属除锈 B、浓硫酸是油状粘稠的液体,有刺激性气味 C、浓硫酸被稀释时会放出大量的热 D、打开浓盐酸的试剂瓶盖可以看到有白雾出现7. 下列实验操作错误的是( )A、倾倒液体药品
4. 物质的性质决定其用途。稀盐酸常用于除铁锈,是利用了酸的一种化学通性,下列酸的用途中也利用了该通性的是( )A、用锌粒和稀硫酸制取氢气 B、用氧化铜和稀硫酸制备硫酸铜 C、用稀盐酸除去氯化钠中的碳酸钠 D、用硼酸处理皮肤上沾有的碱5. 物质的分类非常重要,下列按照酸、碱、盐的顺序排列的是( )A、HCl Na2SO4 NaCl B、Ca(OH)2 HCl Na2SO4 C、NaOH H2CO3 NaCl D、HCl NaOH Na2CO36. 下列关于浓盐酸及浓硫酸的说法中有错误的是( )A、浓盐酸稀释后可以用来给金属除锈 B、浓硫酸是油状粘稠的液体,有刺激性气味 C、浓硫酸被稀释时会放出大量的热 D、打开浓盐酸的试剂瓶盖可以看到有白雾出现7. 下列实验操作错误的是( )A、倾倒液体药品 B、过滤
B、过滤  C、稀释浓硫酸
C、稀释浓硫酸 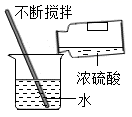 D、取少量固体药品
D、取少量固体药品  8. 盛有下列物质的容器敞口放置在空气中一段时间后,容器内物质质量减少的是( )A、铁钉 B、浓盐酸 C、生石灰 D、浓硫酸
8. 盛有下列物质的容器敞口放置在空气中一段时间后,容器内物质质量减少的是( )A、铁钉 B、浓盐酸 C、生石灰 D、浓硫酸二、综合题
-
9. 某实验小组的学生把一定量的生铁屑放入烧杯中,并注入稀硫酸,使之充分反应,请回答下列问题:(1)、生铁表面有产生,溶液逐渐变为色。(2)、充分反应后,发现烧杯底部有少量黑色残渣,该残渣主要为。(3)、该反应的化学方程式可表示为。10. 构建模型和构建知识网络是化学学习中重要的学习方法,李华同学利用左手构建酸的性质知识网络,如图所示,请结合图示回答下列问题:
 (1)、如用湿润的pH试纸测定盐酸的pH,则结果会(填“偏大”、“偏小”、或“无影响”);(2)、图中①的现象是。(3)、图中性质④属反应(填基本反应类型)。(4)、图中⑤的性质在工业上可用于盐酸除铁锈,反应的化学方程式为。11. 学习了酸的化学性质后,小华同学以稀硫酸为主题绘制了“多彩酸世界”思维导图。
(1)、如用湿润的pH试纸测定盐酸的pH,则结果会(填“偏大”、“偏小”、或“无影响”);(2)、图中①的现象是。(3)、图中性质④属反应(填基本反应类型)。(4)、图中⑤的性质在工业上可用于盐酸除铁锈,反应的化学方程式为。11. 学习了酸的化学性质后,小华同学以稀硫酸为主题绘制了“多彩酸世界”思维导图。 (1)、若用Cu(OH)2实现②的现象,会得到色溶液,该反应的化学方程式为。(2)、若想实现③得到浅绿色溶液可选用单质(写化学式)。(3)、得到黄色溶液的反应可用于工业除锈,写出该反应的化学方程式。(4)、若想看到⑤的现象,可用溶液(填化学式)与稀硫酸反应。12. 多角度认识盐酸。多角度认识物质,能帮助我们更全面了解物质。以盐酸为例,回答下列问题:(1)、认识盐酸的性质和检验
(1)、若用Cu(OH)2实现②的现象,会得到色溶液,该反应的化学方程式为。(2)、若想实现③得到浅绿色溶液可选用单质(写化学式)。(3)、得到黄色溶液的反应可用于工业除锈,写出该反应的化学方程式。(4)、若想看到⑤的现象,可用溶液(填化学式)与稀硫酸反应。12. 多角度认识盐酸。多角度认识物质,能帮助我们更全面了解物质。以盐酸为例,回答下列问题:(1)、认识盐酸的性质和检验①打开盛有浓盐酸的试剂瓶,可观察到瓶口有 , 说明浓盐酸具性。
②能区分稀盐酸与食盐水的一种试剂或相应的化学方程式是。
③区分稀盐酸与稀硫酸的一个化学方程式。
(2)、辩证地认识盐酸人体内胃酸的主要成分是盐酸,在食物的消化过程中起着重要的作用。但是胃酸过多会引起多种疾病。治疗胃酸过多服用的铝碳酸镁(其主要成分的化学式为AlMg(OH)3CO3)成分中能与胃酸发生反应的的粒子是(填粒子符号)。
13. 溶液的配制是重要的实验操作,请回答下列问题:(1)、浓硫酸具有强烈的腐蚀性,稀释浓硫酸的正确操作为 。(2)、将浓溶液配制成稀溶液时,主要步骤有:①量取、②混匀、③计算、④转移,操作时正确的顺序为(填数字序号)。(3)、将50g 98%的浓硫酸稀释成20%的稀硫酸,需要水的质量是 。(4)、实验后,所配制溶液溶质质量分数偏小的原因可能是 (填字母序号)。A、量取水的体积时仰视读数 B、使用量筒量取浓硫酸时俯视读数 C、从量筒倾倒出浓硫酸时,浓硫酸洒出 D、转移配制好的溶液时,液体溅出三、实验探究题
-
14. 写出造成下列不良后果的可能的原因。(1)、铝条与盐酸的反应开始阶段没有气泡。(2)、细口瓶的标签污损。(3)、用试管加热液体时,液体喷出试管。(4)、过滤操作中,滤液浑浊。15. 如图所示,在白色点滴板1-6的孔穴中,分别滴加适量稀盐酸。
 (1)、反应后溶液颜色有变化的是(填序号)。(2)、孔穴3中发生反应的化学方程式为。(3)、再向孔穴4中滴加氢氧化钠溶液,溶液不变色,此时溶液中一定有的溶质是。
(1)、反应后溶液颜色有变化的是(填序号)。(2)、孔穴3中发生反应的化学方程式为。(3)、再向孔穴4中滴加氢氧化钠溶液,溶液不变色,此时溶液中一定有的溶质是。四、计算题
-
16. 黄铜(铜锌合金)因性能优良,被广泛用于制作钱币、饰品和生产中,铜的质量分数在59%~ 65%之间的黄铜性能优良。兴趣小组为了解某黄铜螺母的材料性能进行如下实验:取多个黄铜螺母放入烧杯中,另取80g稀硫酸,分四次等质量加入,每次均充分反应,得到实验数据如下表所示:
实验次数
1
2
3
4
稀硫酸的用量/g
20
20
20
20
剩余固体的质量/g
20.0
17.4
m
13.5
(1)、m=。所取黄铜螺母中铜的质量为g。(2)、通过计算说明该黄铜螺母的材料性能 (填“优良”或“不优良”)。(3)、计算稀硫酸中溶质的质量分数(写出计算过程)。(4)、分析实验数据,在如图坐标中画出加入80g稀硫酸过程中相应的曲线图(纵坐标为自行设定物质的质量;并标出曲线中必要的数据)