人教版初中化学九年级下册第八单元 课题3 金属资源的利用和保护
试卷更新日期:2022-02-07 类型:同步测试
一、单选题
-
1. 常见的金属矿石赤铁矿的主要成分是( )A、Fe2O3 B、Fe3O4 C、FeCO3 D、Al2O32. 化学实验是我们应用化学知识、拓展化学思维和培养化学素养的重要途径。下列实验能达到实验目的的是( )A、探究燃烧条件
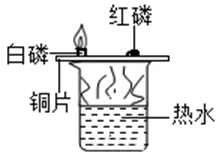 B、探究质量守恒定律
B、探究质量守恒定律 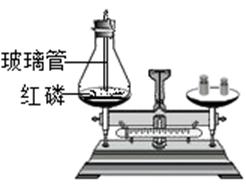 C、探究铁钉生锈条件
C、探究铁钉生锈条件 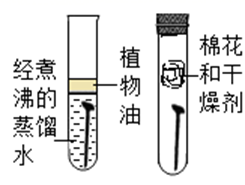 D、探究金属和合金的硬度
D、探究金属和合金的硬度 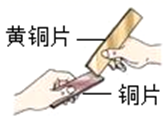 3. 为了防止钢铁制品锈蚀,下列做法不当的是( )A、在铁制品表面镀上一层锌 B、在车船的表面喷涂油漆 C、将使用后的菜刀用布擦干 D、家中门把手表面涂防锈油4. 下列有关对自行车的做法不合理的是( )A、车架表面喷涂油漆 B、钢圈表面镀防护金属 C、露天放置,日晒雨淋 D、链条表面涂机油5. 工业上利用黄铁矿(主要成分是FeS2)煅烧的产物冶炼铁和生产硫酸,其反应方程如下:
3. 为了防止钢铁制品锈蚀,下列做法不当的是( )A、在铁制品表面镀上一层锌 B、在车船的表面喷涂油漆 C、将使用后的菜刀用布擦干 D、家中门把手表面涂防锈油4. 下列有关对自行车的做法不合理的是( )A、车架表面喷涂油漆 B、钢圈表面镀防护金属 C、露天放置,日晒雨淋 D、链条表面涂机油5. 工业上利用黄铁矿(主要成分是FeS2)煅烧的产物冶炼铁和生产硫酸,其反应方程如下:① ②
③ ④
下列说法错误的是( )
A、反应①②③均需要较高的温度 B、反应③④属于化合反应 C、①③④中硫元素化合价均发生了变化 D、只有①②③发生了氧化反应6. 铜制品长期暴露在空气中表面生成铜锈(主要成分Cu2(OH)2CO3),下列物质与铜制品生锈无关的是( )A、N2 B、O2 C、H2O D、CO27. 下列说法错误的是( ) A、铁钉是由铁合金制成的 B、根据甲图,铁钉生锈过程中O2体积不变 C、根据甲图,铁钉在潮湿环境更容易生锈 D、根据乙图,铁钉生锈过程中温度升高8. 已知CO+CuO Cu+CO2 , 该反应中发生还原反应的物质是( )A、CO B、CuO C、Cu D、CO2
A、铁钉是由铁合金制成的 B、根据甲图,铁钉生锈过程中O2体积不变 C、根据甲图,铁钉在潮湿环境更容易生锈 D、根据乙图,铁钉生锈过程中温度升高8. 已知CO+CuO Cu+CO2 , 该反应中发生还原反应的物质是( )A、CO B、CuO C、Cu D、CO2二、综合题
-
9. 铁合金在生产、生活中应用广泛。(1)、地球上的铁元素以(“单质”或“化合物”)的形式存在。可用于炼铁的一种矿石是。(2)、用生铁制防盗门而不用纯铁的主要原因是。在防盗门表面喷漆,其防锈原理是 , 喷漆前用稀盐酸除铁锈的化学方程式为。10. 我国自行研发的大型客机C919于近年成功试飞,请根据所学知识回答问题。(1)、下列金属制品的用途,利用金属导热性的是____。A、
 铁锅
B、
铁锅
B、 铜导线
C、
铜导线
C、 钢丝绳
D、
钢丝绳
D、 黄金饰品
(2)、选用铝合金做飞机机身而不选用纯铝,主要原因是铝合金硬度和强度(填“大于”或“小于”)纯铝。(3)、飞机所用的下列材料属于合成材料的是____。(填序号)A、塑料扶手 B、纯羊毛毯 C、真皮座套 D、铜制扣件(4)、飞机上的镀铬铁制品能防锈蚀,其防锈原理是阻止了铁与接触。(5)、若要验证飞机材料中的Fe、Cu和Al的金属活动性顺序,只需一种试剂直接与上述三种金属反应就能达到目的,该试剂是____(填序号)。A、硫酸铝溶液 B、硫酸亚铁溶液 C、硫酸铜溶液(6)、某炼铁厂现用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁97%的生铁的质量是t。(计算结果精确到0.1)11. “大单元”整合是一种新的学习化学的思维方法,结合铁的探究实验,回答下列问题:
黄金饰品
(2)、选用铝合金做飞机机身而不选用纯铝,主要原因是铝合金硬度和强度(填“大于”或“小于”)纯铝。(3)、飞机所用的下列材料属于合成材料的是____。(填序号)A、塑料扶手 B、纯羊毛毯 C、真皮座套 D、铜制扣件(4)、飞机上的镀铬铁制品能防锈蚀,其防锈原理是阻止了铁与接触。(5)、若要验证飞机材料中的Fe、Cu和Al的金属活动性顺序,只需一种试剂直接与上述三种金属反应就能达到目的,该试剂是____(填序号)。A、硫酸铝溶液 B、硫酸亚铁溶液 C、硫酸铜溶液(6)、某炼铁厂现用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁97%的生铁的质量是t。(计算结果精确到0.1)11. “大单元”整合是一种新的学习化学的思维方法,结合铁的探究实验,回答下列问题:
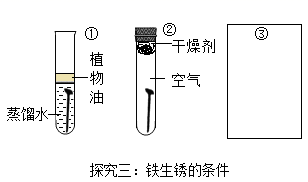 (1)、探究一:Fe2O3中,铁元素的化合价为。(2)、探究二:A中细铁丝在氧气中燃烧实验,需要预先在集气瓶中加入少量水,原因是;B中的反应化学方程式为;依据C实验的现象可判断出Fe的活动性比铜;A、B、C三个实验,体现了大多数金属具有的三点化学性质:与氧气反应、与酸反应、。(3)、探究三:探究铁生锈的条件,画出③中的实验装置图。(4)、探究四:图为冬季人们常用的“暖贴”,其成分如下:
(1)、探究一:Fe2O3中,铁元素的化合价为。(2)、探究二:A中细铁丝在氧气中燃烧实验,需要预先在集气瓶中加入少量水,原因是;B中的反应化学方程式为;依据C实验的现象可判断出Fe的活动性比铜;A、B、C三个实验,体现了大多数金属具有的三点化学性质:与氧气反应、与酸反应、。(3)、探究三:探究铁生锈的条件,画出③中的实验装置图。(4)、探究四:图为冬季人们常用的“暖贴”,其成分如下:

(提出问题)使用暖贴时为什么会很快产生热量呢?
(猜想假设)猜想一:活性炭能加快铁粉生锈的速率;猜想二:食盐能加快铁粉生锈速率。
(进行实验)下表是2g铁粉、5g水与不同量活性炭、不同量食盐均匀混合后,在10分钟内温度上升的实验记录。
实验编号
活性炭/g
食盐/g
温度上升值/℃
1
0
0
0.1
2
0.2
0
22.0
3
0
0.1
3.1
4
0.2
0.1
56.3
(解释与结论)
①对比实验1和3,得出的结论是。
②欲得出结论“活性炭与食盐同时存在会大幅度加快铁生锈速率”,需要对比。(填实验编号)
(5)、(反思与评价)下列说法正确的是_____________。A、暖贴在使用前要密封保存 B、暖贴使用后剩余物可以回收利用 C、利用铁生锈的原理,铁粉还可用于食品保鲜 D、铁资源取之不尽用之不竭12. 2021年3月,四川"三星堆遗址"已出土黄金面具、青铜艺术品、象牙、残存的丝织品等重要文物,其中青铜为合金。(1)、下列物质中属于金属材料的有_____A、象牙 B、黄金 C、丝织品 D、青铜(2)、青铜的硬度比纯铜(填大或"小")。(3)、铜制品长期暴露在空气中能与空气中的 O2、H2O 和化合生成铜锈(主要成分是 Cu(OH)2 , CO3)。(4)、黄铜是铜锌合金,区分黄铜和纯铜发生反应的化学方程式为。13. 金属制品与我们的日常生活密不可分。(1)、钢铁是应用最普遍的金属材料,某些铁制零件防锈措施是涂油,其防锈原理是。(2)、铝的化学性质比铁活泼,但是铝制品具有很好的防腐蚀性能,其原因是铝表面容易形成。(3)、为验证Zn、Cu、Ag三种金属的活动性强弱,某同学选用如下试剂组进行验证,其中不合理的一组是①Zn、CuSO4溶液、Ag ②ZnSO4溶液、Cu、AgNO3溶液 ③Zn、Cu、AgNO3溶液
(4)、将一定量的铝、铜粉末混合物加入硝酸银溶液中,充分反应后过滤,滤液为蓝色。滤渣中一定含有 , 滤液中溶质的组成可能是或(填化学式)。三、实验探究题
-
14. 依据下图所示实验回答问题。
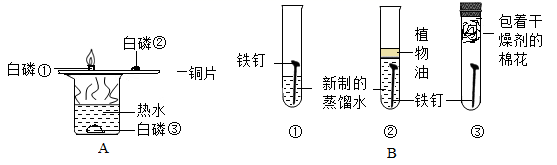 (1)、A 实验探究燃烧的条件。得出可燃物燃烧需要达到着火点依据的现象是。(2)、B 实验探究铁生锈的条件,植物油的作用是 , ①和③对比,研究的影响因素是15. 结合下列有关铁的实验,回答下列问题:
(1)、A 实验探究燃烧的条件。得出可燃物燃烧需要达到着火点依据的现象是。(2)、B 实验探究铁生锈的条件,植物油的作用是 , ①和③对比,研究的影响因素是15. 结合下列有关铁的实验,回答下列问题: (1)、A实验,观察到铁片表面有气泡产生,溶液逐渐变成。(2)、B实验,通过明显现象,由此可判断铁的活动性比铜强;(3)、C实验
(1)、A实验,观察到铁片表面有气泡产生,溶液逐渐变成。(2)、B实验,通过明显现象,由此可判断铁的活动性比铜强;(3)、C实验(实验目的)。
(4)、(实验现象)试管c中铁钉表面生锈,试管a和试管b中铁钉表面。(5)、(实验结论)试管对比,说明铁生锈需要氧气;试管对比,说明铁生锈需要水。(6)、(问题交流)试管a中用植物油密封的目的是。16. 古文献记载:距今5000~4000年我国古代人们已开始冶铸青铜器(如图1)。青铜器表面常会有一层铜锈,同学们对铜锈开展了以下探究活动。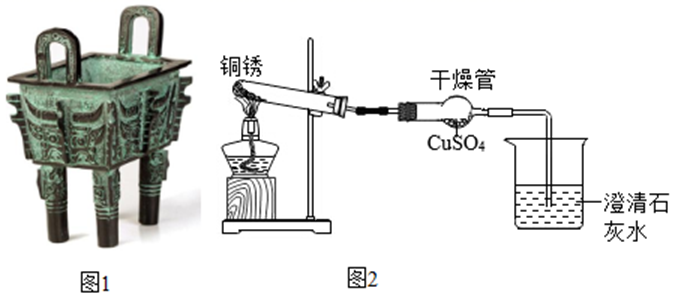
查阅资料:
(1)、活动一:探究铜锈的组成用图2所示的实验装置隔绝空气加热铜锈,观察到澄清石灰水变浑浊,干燥管内白色粉末变为蓝色,试管中固体由绿色变为黑色。
(交流讨论)
由活动一推测,铜锈中含有的元素有;烧杯中发生反应的化学方程式为。
(2)、活动二:探究铜生锈的条件(做出猜想)在活动一的基础上,猜想铜生锈的条件是铜与H2O、CO2同时接触。
(进行实验)
序号
①
②
③
④
实验
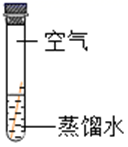

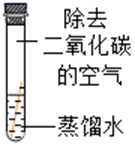
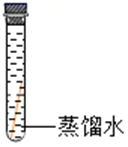
现象
铜片表面有绿色物质
无明显现象
无明显现象
无明显现象
(得出结论)铜生锈的条件是与H2O、CO2同时接触。
(反思评价)
小组同学做出“铜生锈的条件是铜与H2O、CO2同时接触”这一猜想的理由是。
(3)、对比实验①③得到的结论是。(4)、能说明铜生锈与H2O有关的实验是(填序号)(5)、经过反思,小刚同学对所得结论提出疑问:与氧气接触也可能是铜生锈的条件之一。小丽同学认为实验①、④对比即可说明铜生锈与氧气有关。请判断小丽的说法是否正确并说明理由:。(6)、通过实验证明,铜生锈的条件是铜与氧气、二氧化碳和水同时接触。由此,你对保存铜制品的建议是。17. 认识金属的性质。如图是关于金属的几个实验。
 (1)、实验一中能证明铁生锈与水有关的实验是(填序号);(2)、实验二是先向试管中加入一小段打磨过的镁条,然后加入 , 待镁片完全溶解后,再向试管中加入铜片,铜片表面无变化,可验证活动性顺序是Mg>H>Cu;(3)、实验三中玻璃管内产生的现象为;实验三涉及了CO具有的化学性质为(填序号)。
(1)、实验一中能证明铁生锈与水有关的实验是(填序号);(2)、实验二是先向试管中加入一小段打磨过的镁条,然后加入 , 待镁片完全溶解后,再向试管中加入铜片,铜片表面无变化,可验证活动性顺序是Mg>H>Cu;(3)、实验三中玻璃管内产生的现象为;实验三涉及了CO具有的化学性质为(填序号)。A.氧化性 B.可燃性 C.还原性 D.不与石灰水发生反应