山东省济南市历下区2021-2022学年九年级上学期期末化学试题
试卷更新日期:2022-01-26 类型:期末考试
一、单选题
-
1. 物质世界充满了变化。下列过程中,没有发生化学变化的是( )A、光合作用
 B、冰雪融化
B、冰雪融化 C、钢铁生锈
C、钢铁生锈 D、粮食酿酒
D、粮食酿酒 2. 2021年世界环境日中国主题为“人与自然和谐共生”。下列做法中,不利于保护环境的是。( )A、垃圾分类处理 B、倡导绿色出行 C、就地焚烧秸秆 D、坚持一水多用3. 规范的实验操作是进行科学实验的重要保障。下列实验操作中,正确的是( )A、稀释浓硫酸
2. 2021年世界环境日中国主题为“人与自然和谐共生”。下列做法中,不利于保护环境的是。( )A、垃圾分类处理 B、倡导绿色出行 C、就地焚烧秸秆 D、坚持一水多用3. 规范的实验操作是进行科学实验的重要保障。下列实验操作中,正确的是( )A、稀释浓硫酸 B、闻气体的气味
B、闻气体的气味 C、量取95mL液体
C、量取95mL液体 D、验满CO2
D、验满CO2 4. 学习化学可提高我们的安全意识和规避风险的能力。下列做法中,不符合安全要求的是( )A、乘坐公共交通工具时,禁止携带易燃易爆物品 B、为防止一氧化碳中毒,可在室内洒水 C、厨房里天然气泄漏后,应立即关闭阀门、开窗通风 D、高层建筑物起火,不可乘坐电梯,应从安全通道撤离5. 氯元素是人体必需常量元素之一。根据如图信息,判断下列有关说法中错误的是( )
4. 学习化学可提高我们的安全意识和规避风险的能力。下列做法中,不符合安全要求的是( )A、乘坐公共交通工具时,禁止携带易燃易爆物品 B、为防止一氧化碳中毒,可在室内洒水 C、厨房里天然气泄漏后,应立即关闭阀门、开窗通风 D、高层建筑物起火,不可乘坐电梯,应从安全通道撤离5. 氯元素是人体必需常量元素之一。根据如图信息,判断下列有关说法中错误的是( )
 A、氯元素属于非金属元素 B、氯原子的核内质子数为17 C、氯原子的最外电子层有7个电子 D、氯原子的相对原子质量为35.45g6. 宏观辨识与微观探析是化学学科的核心素养之一。下列微粒观点的解释中,错误的是( )A、瘪乒乓球放入热水中重新鼓起一一气体分子本身变大 B、水通电生成氢气和氧气一一分子分成原子,原子重组成新分子 C、钠原子和钠离子属于同种元素一一质子数相同 D、酸有相似的化学性质一一酸溶液中都含有大量的H+7. 下列有关氯化钠溶液的说法中,错误的是( )
A、氯元素属于非金属元素 B、氯原子的核内质子数为17 C、氯原子的最外电子层有7个电子 D、氯原子的相对原子质量为35.45g6. 宏观辨识与微观探析是化学学科的核心素养之一。下列微粒观点的解释中,错误的是( )A、瘪乒乓球放入热水中重新鼓起一一气体分子本身变大 B、水通电生成氢气和氧气一一分子分成原子,原子重组成新分子 C、钠原子和钠离子属于同种元素一一质子数相同 D、酸有相似的化学性质一一酸溶液中都含有大量的H+7. 下列有关氯化钠溶液的说法中,错误的是( ) A、氯化钠溶于水时,溶液温度基本不变 B、氯化钠溶液中含有钠离子、氯离子、水分子 C、氯化钠溶液是均一、稳定的混合物 D、室温下,氯化钠饱和溶液不能再溶解任何物质8. 小颖同学按如图所示进行了实验探究,下列有关分析中错误的是( )
A、氯化钠溶于水时,溶液温度基本不变 B、氯化钠溶液中含有钠离子、氯离子、水分子 C、氯化钠溶液是均一、稳定的混合物 D、室温下,氯化钠饱和溶液不能再溶解任何物质8. 小颖同学按如图所示进行了实验探究,下列有关分析中错误的是( ) A、该实验能证明分子在不断地运动 B、浓氨水和酚酞都具有挥发性 C、氨气的水溶液显碱性 D、小烧杯B起参照对比作用9. 下列有关燃烧的说法中,错误的是( )A、燃烧不一定有火焰产生 B、增大氧气的浓度可促进可燃物燃烧 C、物质跟氧气的反应就是燃烧 D、有限空间内急速燃烧容易引发爆炸10. 碳循环和氧循环是自然界中的重要循环。下列有关分析中,错误的是( )
A、该实验能证明分子在不断地运动 B、浓氨水和酚酞都具有挥发性 C、氨气的水溶液显碱性 D、小烧杯B起参照对比作用9. 下列有关燃烧的说法中,错误的是( )A、燃烧不一定有火焰产生 B、增大氧气的浓度可促进可燃物燃烧 C、物质跟氧气的反应就是燃烧 D、有限空间内急速燃烧容易引发爆炸10. 碳循环和氧循环是自然界中的重要循环。下列有关分析中,错误的是( ) A、变化观:碳循环和氧循环过程中均发生了化学反应 B、守恒观:碳、氧循环过程中各元素质量均保持不变 C、微粒观:绿色植物的作用是使自然界中的氧原子总数增加 D、平衡观:碳、氧循环有利于维持大气中O2和CO2含量的相对稳定
A、变化观:碳循环和氧循环过程中均发生了化学反应 B、守恒观:碳、氧循环过程中各元素质量均保持不变 C、微粒观:绿色植物的作用是使自然界中的氧原子总数增加 D、平衡观:碳、氧循环有利于维持大气中O2和CO2含量的相对稳定二、多选题
-
11. 2021年12月9日15时40分,中国空间站开启“天宫课堂”第一课,神舟十三号乘组航天员叶光富介绍了空间站里的氧气源自电解水,同时所得的H2还可与CO2反应生成H2O和CH4 , 增强了资源循环利用。该反应的微观过程如下图所示,则下列有关说法中正确的是( )
 A、上图中x的数值为3 B、反应前、后氢元素的化合价不变 C、CO2与H2O均为氧化物 D、反应生成H2O和CH4的分子个数比为2:112. 下列说法中,正确的是( )A、金属锈蚀、动植物体腐烂等都属于缓慢氧化 B、复分解反应前后,各元素化合价均保持不变 C、镁条燃烧后固体质量增加了,说明该反应不遵守质量守恒定律 D、根据空气中各成分的沸点不同,可将各气体从液态空气中逐一分离出来13. 下列实验方案设计中,能顺利达到实验目的的是( )
A、上图中x的数值为3 B、反应前、后氢元素的化合价不变 C、CO2与H2O均为氧化物 D、反应生成H2O和CH4的分子个数比为2:112. 下列说法中,正确的是( )A、金属锈蚀、动植物体腐烂等都属于缓慢氧化 B、复分解反应前后,各元素化合价均保持不变 C、镁条燃烧后固体质量增加了,说明该反应不遵守质量守恒定律 D、根据空气中各成分的沸点不同,可将各气体从液态空气中逐一分离出来13. 下列实验方案设计中,能顺利达到实验目的的是( )选项
实验目的
实验操作
A
除去N2中的O2
将气体缓慢通过足量的灼热铜粉
B
除去粗盐中的泥沙
加入足量水溶解、过滤、蒸发结晶
C
鉴别氢氧化钠固体和硝酸铵固体
取样,加水溶解,测量溶液温度
D
制备FeCl3
将铁粉加入足量稀盐酸中
A、A B、B C、C D、D14. 推理是化学学习中常用的思维方法。下列推理正确的是( )A、中和反应生成盐和水,则生成盐和水的反应一定是中和反应 B、镁能与稀盐酸反应产生气体,则能与稀盐酸反应产生气体的一定是金属 C、化学反应前后元素的种类不变,则制取氧气必须用含氧元素的物质 D、化学反应需要一定的条件,则控制反应条件可以促进或抑制化学反应15. 常温下,向一定质量的CaCO3和CaO的固体混合物中,加入过量稀盐酸,充分反应,得到不饱和溶液甲和气体乙。再将气体乙通入足量NaOH溶液中,反应结束后(气体全部被吸收),测得溶液质量增加了2.2g。下列有关说法中,正确的是( )A、该实验中共生成4.4g CO2气体 B、原混合物中含有碳酸钙5.0g C、溶液甲中至少含有两种溶质 D、该实验中发生的反应均为复分解反应三、填空题
-
16. 化学学科有专用的符号语言,我们应充分学好、用好它们。(1)、请按要求从氧气、氢气、氢氧化钙、碳酸、氯化钠中选择合适的物质,将其化学式填写在下列横线上。
①可做燃料的气体单质。
②生活中做调味品的盐。
③能改良酸性土壤的碱。
④汽水中含有的酸。
(2)、2021年6月23日,中国集邮有限公司特别推出了《北京2022年冬奥会一竞赛场馆》小型张首日封。北京冬奥会将成为奥运历史上第一届全部使用绿色清洁电能的奥运会,所有场馆将实现100%使用可再生能源及“绿电”。试回答:
①下列属于可再生能源的是(填选项序号之一)。
A.煤炭 B.石油 C.风能 D.天然气
②北京2008年夏季奥运会的“祥云”火炬采用丙烷(化学式C3H8)作为燃料,北京2022年冬季奥运会的“飞扬”火炬采用氢气作为燃料。火炬燃料由氢气替代了丙烷(C3H8),其优点是:(至少答一条)。

③在丙烷分子中,碳原子和氢原子的个数比为(填最简整数比),丙烷中(C3H8),质量分数最小的元素是。(填元素符号)
④请写出丙烷(C3H8)在空气中充分燃烧的化学方程式:。
17. 我国海岸线长3.2万千米,海洋资源非常丰富,我们合理开发同时,须保护好海洋环境。(1)、山东海盐产量占全国总产量的七成以上,目前从海水中提取食盐的方法主要为“盐田法”,生产流程如右图所示:
①在蒸发池中促进水分蒸发,主要是利用了(填选项序号之一)。
A.太阳能 B.潮汐能 C.地热能 D.化学能
②上述流程中得到的卤水是该温度下氯化钠的溶液(填“饱和”或“不饱和”)。
(2)、金属镁广泛应用于生活、生产和国防工业。从海水中提取金属镁,可按下图工艺流程进行:
根据上述流程图,下列说法中错误的是____(填选项序号之一)。
A、步骤I、Ⅱ的目的是从海水中提纯氯化镁 B、步骤Ⅱ中发生了中和反应 C、步骤Ⅲ中化学能转化为电能 D、步骤Ⅲ中生成的Cl2可用于自来水消毒(3)、我国化学家侯德榜在“氨碱法”基础上,创立了“侯氏制碱法”,促进了世界制碱业的发展。其部分工艺流程如图所示:
①通入氨气后,饱和氨盐水的pH7(选填“>”、“<”或“=”之一),因此更易吸收CO2。
②饱和氨盐水通入CO2后,发生反应的化学方程式为 , 由此可推知X的化学式为。
③将碳酸氢钠固体加热,它会分解生成纯碱、二氧化碳和水,写出该反应的化学方程式:。
(4)、海水中除了蕴含大量的钠元素、镁元素外,还含有大量的钾元素。已知KCl和KNO3的溶解度曲线如图所示,试回答:
①t2℃时,KCl的溶解度KNO3的溶解度。(选填“大于”、“小于”或“等于”之一)
②t1℃时,将30g硝酸钾固体放入100g水中,所得溶液的质量为g。
③若KNO3中混有少量KCl,可采用的方法提纯KNO3。(选填“蒸发结晶”或“降温结晶”)
18. 下图为实验室中常见的气体制备、净化、收集和性质实验的部分仪器。 (1)、某化学小组以石灰石和稀盐酸为原料,在实验室中制取并收集干燥的二氧化碳气体。他们按照要求设计了实验装置,连接仪器,并检查了装置的气密性。
(1)、某化学小组以石灰石和稀盐酸为原料,在实验室中制取并收集干燥的二氧化碳气体。他们按照要求设计了实验装置,连接仪器,并检查了装置的气密性。①制取二氧化碳时,发生反应的化学方程式为。
②他们所选装置的连接顺序应为→→(填写仪器序号字母)。
(2)、化学小组采用对比实验的方法探究了二氧化碳的部分性质。他们首先向三个容积相等的盛有CO2的软塑料瓶中分别注入等体积的饱和石灰水、饱和NaOH溶液和蒸馏水,然后将3个软塑料瓶充分振荡,观察现象。根据该实验信息及已学化学知识,试回答下列问题:

①实验过程中,小梅同学观察到A瓶内澄清石灰水变白色浑浊,她认为此现象可以用于鉴定CO2 , 该反应的化学方程式为。
②小琳同学通过对照B、C两个软塑料瓶的现象差异(填具体现象),猜想CO2与NaOH能发生化学反应。为了验证这个猜想,她继续做了新产物的探究实验:用试管取少量B瓶内振荡后的溶液,向其中滴加足量 , 若出现现象,则可以得出CO2能与NaOH反应的结论。
③小颖同学认为,仅通过C瓶变瘪的现象,无法证明CO2能与水反应,因为CO2能溶于水,也会导致瓶内气压减小。于是,她选用了干燥的蓝色石蕊试纸,设计了一组下图所示的对比实验进一步探究,当观察到试纸现象为(填序号)时,即可证明CO2能与水反应。

A.①③变红色,②④不变色 B.①④变红色,②③不变色
C.①③④变红色,②不变色 D.①②③变红色,④不变色
④反思与评价:根据上述实验结论,同学们认为二氧化碳可以与水、等物质反应。(选填“酸”、“碱”、“盐”之一)
19. 回答下列问题。(1)、化学与生活密切相关。某化学兴趣小组的同学欲探究洁厕灵(主要成分是稀盐酸)和厨房清洁剂(主要成分是氢氧化钠溶液)的性质,他们取样带入化学实验室,进行了以下探究:①小郑同学用pH试纸粗略测定了两种样品的酸碱性强弱,请你描述pH试纸的正确使用方法:。
②小黄同学用两支试管分别取两种样品各少量,再各滴入适量硫酸铜溶液,观察到其中一支试管里出现蓝色沉淀,该反应的化学方程式为。
③小路同学将两种样品各取少量并混合,发现其去污清洁效果明显降低。请你结合如图,从微观角度帮她分析出现这种现象的原因(即中和反应的微观实质):。
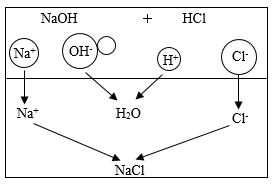 (2)、硫酸是一种重要的化工生产原料,也是实验室中常用的试剂。为了探究稀硫酸的化学性质,化学小组又做了如图所示的实验:(已知:六支试管中均发生化学反应)
(2)、硫酸是一种重要的化工生产原料,也是实验室中常用的试剂。为了探究稀硫酸的化学性质,化学小组又做了如图所示的实验:(已知:六支试管中均发生化学反应)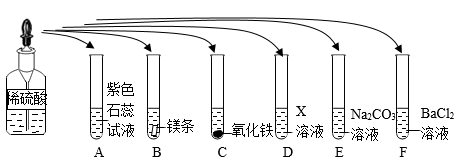
①上述实验中,有气体产生的一个反应的化学方程式为。
②试管C中,可观察到的明显实验现象为(至少写一条)。
③物质X是与其他试管中类别不同的物质,请举例其一(填化学式)。
④充分反应后,小娜同学取试管F中的上层清液,继续进行实验探究。她向其中加入了少量AgNO3溶液和足量稀硝酸,出现白色沉淀,从而得出原试管F中反应物BaCl2过量的结论。你(填“同意”或“不同意”)她的看法,请说明理由:。
20. 烧碱年产量是衡量一个国家化学工业水平的重要标志。工业上常用纯碱和石灰石为原料制取烧碱,其主要工艺流程如下图所示:(部分反应物及生成物已略去)。 (1)、上图步骤Ⅱ中,发生反应的化学方程式为。(2)、氢氧化钠有很强的腐蚀性,如果不小心沾到皮肤上,要立即用大量的水冲洗,然后涂上____(填选项序号之一)。A、硼酸溶液 B、3%~5%的碳酸氢钠溶液 C、生理盐水(3)、室温下,向盛有一定量石灰水(即Ca(OH)2溶液)的烧杯中加入溶质质量分数为10%的Na2CO3溶液,经测定,产生沉淀的质量与加入Na2CO3溶液的质量关系如图所示:根据题目信息,试回答下列问题:
(1)、上图步骤Ⅱ中,发生反应的化学方程式为。(2)、氢氧化钠有很强的腐蚀性,如果不小心沾到皮肤上,要立即用大量的水冲洗,然后涂上____(填选项序号之一)。A、硼酸溶液 B、3%~5%的碳酸氢钠溶液 C、生理盐水(3)、室温下,向盛有一定量石灰水(即Ca(OH)2溶液)的烧杯中加入溶质质量分数为10%的Na2CO3溶液,经测定,产生沉淀的质量与加入Na2CO3溶液的质量关系如图所示:根据题目信息,试回答下列问题:
①当加入Na2CO3溶液53g时(即图中A点),此时所得溶液中大量存在的溶质是(填化学式)。
②当加入106g溶质质量分数为10%的Na2CO3溶液时,(即图中B点),经测定,恰好完全反应。试通过化学方程式计算,求此时生成NaOH的质量。(计算结果精确至0.1g)