黑龙江省鸡西市虎林市2021-2022学年九年级上学期期末化学试题
试卷更新日期:2022-01-24 类型:期末考试
一、单选题
-
1. 厨房是家庭中重要的组成部分。以下在厨房发生的变化中,不属于化学变化的是( )A、苹果腐烂
 B、榨取果汁
B、榨取果汁 C、面包发霉
C、面包发霉 D、菜刀生锈
D、菜刀生锈 2. 4月22日是世界地球日,2021年世界地球日主题是“修复我们的地球”。下列措施中不符合该主题的是( )A、发展清洁能源 B、回收利用废旧金属 C、禁止焚烧秸秆 D、多使用一次性筷子3. 规范的实验操作是实验成功的保证。下图所示实验操作,错误的是( )A、稀释浓硫酸
2. 4月22日是世界地球日,2021年世界地球日主题是“修复我们的地球”。下列措施中不符合该主题的是( )A、发展清洁能源 B、回收利用废旧金属 C、禁止焚烧秸秆 D、多使用一次性筷子3. 规范的实验操作是实验成功的保证。下图所示实验操作,错误的是( )A、稀释浓硫酸 B、倾倒液体
B、倾倒液体  C、测定溶液的pH
C、测定溶液的pH 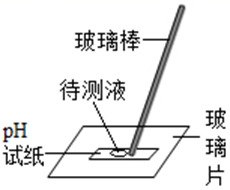 D、过滤
D、过滤  4. “民以食为天”,我们青少年正是长身体的关键时期,要注意营养的均衡补充.下列有关健康叙述正确的是( )
4. “民以食为天”,我们青少年正是长身体的关键时期,要注意营养的均衡补充.下列有关健康叙述正确的是( )①正常人每天去都应摄入一定量的蛋白质②油脂会使人发胖,故禁食油脂③维生素由200多种,多数在人体内不能合成,需要从食物中摄取,饮食中要注意补充蔬菜水果等含维生素较多的食品④青少年正处于生长发育阶段,需要多摄入钙,成年人体格已经健全,可以不补充钙.
A、②③ B、①② C、①③ D、③④5. 下列实验现象的描述正确的是( )A、点燃羊毛纤维,产生烧焦羽毛的气味 B、铵态氮肥和熟石灰混合研磨,生成无味的气体 C、白磷自燃产生大量的白色烟雾 D、电解水时正极产生的气体体积比负极的大6. 建立宏观与微观之间的联系是化学学科特有的思维方式。下列对宏观事实的微观解释正确的是( )A、50mL酒精与50mL水混合后体积小于100mL,是因为分子变小了 B、过氧化氢溶液能分解出氧气,是因为过氧化氢中含有氧气分子 C、氦、氖等稀有气体化学性质比较稳定,是因为它们原子最外层都有8个电子 D、春暖花开的季节,处处鸟语花香,闻到香味是因为分子在不断运动7. 金属钛被誉为“未来金属”,在航天、航空、精密仪器等方面有广阔前景。如图是钛元素在元素周期表中的信息。则下列说法正确的是( ) A、钛元素的相对原子质量为47.87 g B、钛离子Ti3+中含有25个电子 C、钛原子核内有22个质子 D、金属钛的化学式为Ti28. CO2和O2是生命活动不可缺少的两种气体,下列对它们的认识中,错误的是( )A、二氧化碳是植物进行光合作用必不可少的原料 B、物质与氧气发生的反应都是氧化反应 C、氧气可以支持燃烧,说明氧气具有可燃性 D、固态二氧化碳俗称干冰,升华时可吸收大量热,因而用作制冷剂9. 汉黄芩素(C16H12O5)是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述错误的是( )A、汉黄芩素中含有16个碳原子、12个氢原子和5个氧原子 B、汉黄芩素中碳、氧元素的质量比为12∶5 C、汉黄芩素在氧气中完全燃烧生成二氧化碳和水 D、汉黄芩素由碳、氢、氧三种元素组成10. 下列说法以及对应的化学方程式的书写都正确的是( )A、金属镁的化学性质很活泼,它在空气中很容易被氧气氧化;Mg+O2 MgO2 B、硫在氧气中燃烧时产生明亮的蓝紫色火焰,可以生成SO3;2S+3O2 2SO3 C、由于焦炭具有还原性,钢铁厂可以直接用焦炭来还原赤铁矿炼铁;3C+2Fe2O3 4Fe+3CO2↑ D、盛放石灰水试剂瓶内壁有一层白膜;CO2+Ca(OH)2=CaCO3↓+H2O11. 甲、乙两种固体物质的溶解度曲线如图所示,下列说法正确的是( )
A、钛元素的相对原子质量为47.87 g B、钛离子Ti3+中含有25个电子 C、钛原子核内有22个质子 D、金属钛的化学式为Ti28. CO2和O2是生命活动不可缺少的两种气体,下列对它们的认识中,错误的是( )A、二氧化碳是植物进行光合作用必不可少的原料 B、物质与氧气发生的反应都是氧化反应 C、氧气可以支持燃烧,说明氧气具有可燃性 D、固态二氧化碳俗称干冰,升华时可吸收大量热,因而用作制冷剂9. 汉黄芩素(C16H12O5)是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述错误的是( )A、汉黄芩素中含有16个碳原子、12个氢原子和5个氧原子 B、汉黄芩素中碳、氧元素的质量比为12∶5 C、汉黄芩素在氧气中完全燃烧生成二氧化碳和水 D、汉黄芩素由碳、氢、氧三种元素组成10. 下列说法以及对应的化学方程式的书写都正确的是( )A、金属镁的化学性质很活泼,它在空气中很容易被氧气氧化;Mg+O2 MgO2 B、硫在氧气中燃烧时产生明亮的蓝紫色火焰,可以生成SO3;2S+3O2 2SO3 C、由于焦炭具有还原性,钢铁厂可以直接用焦炭来还原赤铁矿炼铁;3C+2Fe2O3 4Fe+3CO2↑ D、盛放石灰水试剂瓶内壁有一层白膜;CO2+Ca(OH)2=CaCO3↓+H2O11. 甲、乙两种固体物质的溶解度曲线如图所示,下列说法正确的是( )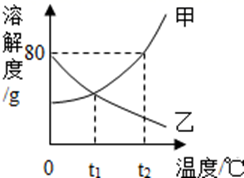 A、甲的溶解度大 B、t1℃,甲、乙两种物质的饱和溶液质质量分数相等 C、t2℃时,向100g水中加入100g甲后形成溶液的质量为200g D、将t2℃甲、乙的饱和溶液分别降到t1℃时,两溶液的溶质质量分数相等12. 下列各组离子在pH=1的溶液中能大量共存的是( )A、Na+、Cl-、OH- B、K+、Ca2+、CO32- C、Ag+、Na+、Cl- D、NO3-、Mg2+、Cu2+13. 下列关于化学与生活的说法中,正确的是( )A、蚊虫叮咬后,要在皮肤上用大量的碳酸汽水清洗才能减轻痛痒 B、为了减小污染,应根据作物、虫害和农药的特点按规定合理施用农药化肥 C、面粉加工厂的工人,所穿的劳保制服要用耐腐蚀的化纤面料 D、室内失火时,立即打开所有门窗,尽量让浓烟从门窗排出14. 通过下列实验可以得出的结论,其中不合理的是( )A、
A、甲的溶解度大 B、t1℃,甲、乙两种物质的饱和溶液质质量分数相等 C、t2℃时,向100g水中加入100g甲后形成溶液的质量为200g D、将t2℃甲、乙的饱和溶液分别降到t1℃时,两溶液的溶质质量分数相等12. 下列各组离子在pH=1的溶液中能大量共存的是( )A、Na+、Cl-、OH- B、K+、Ca2+、CO32- C、Ag+、Na+、Cl- D、NO3-、Mg2+、Cu2+13. 下列关于化学与生活的说法中,正确的是( )A、蚊虫叮咬后,要在皮肤上用大量的碳酸汽水清洗才能减轻痛痒 B、为了减小污染,应根据作物、虫害和农药的特点按规定合理施用农药化肥 C、面粉加工厂的工人,所穿的劳保制服要用耐腐蚀的化纤面料 D、室内失火时,立即打开所有门窗,尽量让浓烟从门窗排出14. 通过下列实验可以得出的结论,其中不合理的是( )A、 甲实验中黄铜片能在铜片上刻画出痕迹,可以说明黄铜的硬度比铜片大
B、
甲实验中黄铜片能在铜片上刻画出痕迹,可以说明黄铜的硬度比铜片大
B、 乙实验既可以说明分子在不停的运动着,又可以说明氨水显碱性
C、
乙实验既可以说明分子在不停的运动着,又可以说明氨水显碱性
C、 丙实验既可以说明二氧化碳易溶于水,又可以说明二氧化碳具有酸性
D、
丙实验既可以说明二氧化碳易溶于水,又可以说明二氧化碳具有酸性
D、 丁实验既可以说明一氧化碳具有还原性,又可以说明一氧化碳具有可燃性
15. 在AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一些铁粉,待反应完全后过滤,不可能存在的情况是( )A、滤纸上有Ag、Cu、Fe,滤液中有Zn2+、Fe2+ B、滤纸上有Ag、Cu,滤液中有Zn2+、Fe2+ C、滤纸上有Ag、Cu,滤液中有Cu2+、Zn2+、Fe2+ D、滤纸上有Ag、Cu、Fe、Zn,滤液中有Zn2+、Fe2+16. 推理是化学学习中常用的思维方法.下列推理正确的是( )A、氧化物中都含有氧元素,所以含氧元素的化合物一定是氧化物 B、NaOH溶液中的OH﹣能与酸反应,则KOH溶液中的OH﹣也能与酸反应 C、饱和溶液不能继续溶解某种溶质,则饱和溶液也不能继续溶解其他溶质 D、盐是由金属离子和酸根离子组成的,NH4NO3中没有金属离子,不属于盐17. 由乙炔(C2H2)、乙烯(C2H4)、乙烷(C2H6)组成的混合物28g,在足量的氧气中燃烧,生成36gH2O和一定质量的CO2 , 混合物中C2H2、C2H4、C2H6的分子个数比可能为( )A、3∶2∶3 B、3∶2∶1 C、1∶2∶3 D、6∶3∶2
丁实验既可以说明一氧化碳具有还原性,又可以说明一氧化碳具有可燃性
15. 在AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一些铁粉,待反应完全后过滤,不可能存在的情况是( )A、滤纸上有Ag、Cu、Fe,滤液中有Zn2+、Fe2+ B、滤纸上有Ag、Cu,滤液中有Zn2+、Fe2+ C、滤纸上有Ag、Cu,滤液中有Cu2+、Zn2+、Fe2+ D、滤纸上有Ag、Cu、Fe、Zn,滤液中有Zn2+、Fe2+16. 推理是化学学习中常用的思维方法.下列推理正确的是( )A、氧化物中都含有氧元素,所以含氧元素的化合物一定是氧化物 B、NaOH溶液中的OH﹣能与酸反应,则KOH溶液中的OH﹣也能与酸反应 C、饱和溶液不能继续溶解某种溶质,则饱和溶液也不能继续溶解其他溶质 D、盐是由金属离子和酸根离子组成的,NH4NO3中没有金属离子,不属于盐17. 由乙炔(C2H2)、乙烯(C2H4)、乙烷(C2H6)组成的混合物28g,在足量的氧气中燃烧,生成36gH2O和一定质量的CO2 , 混合物中C2H2、C2H4、C2H6的分子个数比可能为( )A、3∶2∶3 B、3∶2∶1 C、1∶2∶3 D、6∶3∶2二、多选题
-
18. 四种物质在一定的条件下充分混合反应,测得反应前后各物质的质量分数如图所示,则有关说法中错误的( )
 A、生成的甲、丙两物质的质量比为8:1 B、乙一定是这个反应的催化剂 C、参加反应的丁的质量一定等于生成甲和丙的质量之和 D、丁一定是化合物19. 除去下列物质中的杂质,所选用的试剂或操作方法有错误的是( )
A、生成的甲、丙两物质的质量比为8:1 B、乙一定是这个反应的催化剂 C、参加反应的丁的质量一定等于生成甲和丙的质量之和 D、丁一定是化合物19. 除去下列物质中的杂质,所选用的试剂或操作方法有错误的是( )选项
物质(括号内物质为杂质)
选用试剂
操作方法
A
CO2(CO)
过量O2
点燃
B
Cu(CuO)
适量稀盐酸
溶解、过滤、洗涤、干燥
C
NaCl溶液(CaCl2)
适量Na2CO3溶液
过滤
D
稀硝酸(H2SO4)
适量BaCl2溶液
过滤
A、A B、B C、C D、D20. 下列图像不能正确反应其对应的实验操作的是( )A、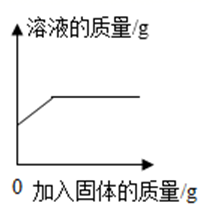 一定温度下,向接近饱和的硝酸钾溶液中不断加入硝酸钾固体
B、
一定温度下,向接近饱和的硝酸钾溶液中不断加入硝酸钾固体
B、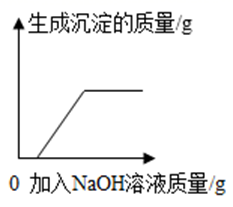 向硫酸和硫酸铜混合溶液中滴加过量的氢氧化钠溶液
C、
向硫酸和硫酸铜混合溶液中滴加过量的氢氧化钠溶液
C、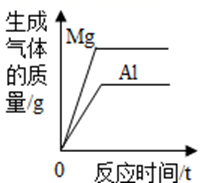 将等质量的镁粉和铝粉分别与足量等浓度的稀硫酸反应
D、
将等质量的镁粉和铝粉分别与足量等浓度的稀硫酸反应
D、 向盛有一定量稀硫酸的烧杯中不断加水稀释
向盛有一定量稀硫酸的烧杯中不断加水稀释
三、填空题
-
21. 化学用语是学习化学的基本工具。请用化学符号或化学式填空:(1)、铵根离子;(2)、保持双氧水化学性质的最小微粒;(3)、治疗胃酸过多的盐;(4)、氧化铝中铝元素的化合价。22. 能源利用和环境保护问题一直受到社会高度关注。(1)、新能源汽车的研发和使用是时代发展的需要。锂电池可为能源汽车提供动力,下列结构示意图表示的粒子与锂原子的化学性质最为相似的是_______(填序号)。A、
 B、
B、 C、
C、 D、
D、 (2)、锂(Li)的金属活泼性强于铝,它与稀硫酸反应的化学方程式为 , 新能源汽车除了节约化石能源外,其主要优点是。(3)、2021年我国全面禁止“洋垃圾”入境,大量垃圾对我国大气、地表水等造成严重污染。
(2)、锂(Li)的金属活泼性强于铝,它与稀硫酸反应的化学方程式为 , 新能源汽车除了节约化石能源外,其主要优点是。(3)、2021年我国全面禁止“洋垃圾”入境,大量垃圾对我国大气、地表水等造成严重污染。①“洋垃圾”中含有多种金属。若摄入下列金属不会造成中毒的是(填字母序号)。
a、铅 b、铁 c、汞
②无用“洋垃圾”直接露天焚烧会产生许多有毒气体,其中(填化学式)极易与血液中血红蛋白结合,引起中毒。
23. 根据图文回答问题: (1)、烹调食物时观察到火焰呈黄色或橙色时,需将灶具的空气进风口调(填“大”或“小”)。(2)、鱼是人体摄入铁元素的食物来源之一,人体缺铁会引起。(3)、聚乙烯能制成薄膜,因为它具有(填“热塑”或“热固”)性。废弃塑料不回收会造成。24. 人类生活和工农业生产都离不开水,下图是自来水厂净化水的过程示意图:
(1)、烹调食物时观察到火焰呈黄色或橙色时,需将灶具的空气进风口调(填“大”或“小”)。(2)、鱼是人体摄入铁元素的食物来源之一,人体缺铁会引起。(3)、聚乙烯能制成薄膜,因为它具有(填“热塑”或“热固”)性。废弃塑料不回收会造成。24. 人类生活和工农业生产都离不开水,下图是自来水厂净化水的过程示意图:请根据图示回答下列问题:
 (1)、自来水厂生产自来水时,使用的净水方法有 ________ (填序号)。A、沉淀 B、过滤 C、煮沸 D、蒸馏 E、吸附(2)、取水后加入絮凝剂(明矾)的作用是 。(3)、自来水厂用ClO2消毒,漂白粉2可用于饮用水消毒。工业上制备漂白粉的化学方程式为:2Cl2+2Ca(OH)2=X+Ca(ClO)2+2H2O, X的化学式为 。(4)、节约用水人人有责,请举出一种节水的措施 。25. 建立宏观与微观之间的联系,是化学学科特有的思维方式。工业上常将煤洗选加工后用于制备水煤气,其主要反应的微观示意图如下:
(1)、自来水厂生产自来水时,使用的净水方法有 ________ (填序号)。A、沉淀 B、过滤 C、煮沸 D、蒸馏 E、吸附(2)、取水后加入絮凝剂(明矾)的作用是 。(3)、自来水厂用ClO2消毒,漂白粉2可用于饮用水消毒。工业上制备漂白粉的化学方程式为:2Cl2+2Ca(OH)2=X+Ca(ClO)2+2H2O, X的化学式为 。(4)、节约用水人人有责,请举出一种节水的措施 。25. 建立宏观与微观之间的联系,是化学学科特有的思维方式。工业上常将煤洗选加工后用于制备水煤气,其主要反应的微观示意图如下: (1)、写出该反应的化学方程式。(2)、在该反应中,化合价升高的元素是(填元素符号)。(3)、在该反应中,(填化学式)具有氧化性。26. A、B、C、D、E是初中化学常见的物质。其中A是通常状况下密度最小的气体,B和C反应可形成蓝色溶液,D在农业上可用来改良酸性土壤。它们的相互关系如图所示(图中“一”表示两端的物质能发生化学反应,“→”表示物质间的转化关系部分反应物、生成物及反应条件已略去)。请回答。
(1)、写出该反应的化学方程式。(2)、在该反应中,化合价升高的元素是(填元素符号)。(3)、在该反应中,(填化学式)具有氧化性。26. A、B、C、D、E是初中化学常见的物质。其中A是通常状况下密度最小的气体,B和C反应可形成蓝色溶液,D在农业上可用来改良酸性土壤。它们的相互关系如图所示(图中“一”表示两端的物质能发生化学反应,“→”表示物质间的转化关系部分反应物、生成物及反应条件已略去)。请回答。 (1)、B的化学式是。(2)、C的类别是(填“氧化物”“酸”“碱”或“盐”)。(3)、反应E→A的化学方程式为。
(1)、B的化学式是。(2)、C的类别是(填“氧化物”“酸”“碱”或“盐”)。(3)、反应E→A的化学方程式为。反应D→E的化学方程式为。
四、综合题
-
27. 化学是一门以实验为基础的科学,根据下图所示的实验,请回答下列问题:
 (1)、A图所示的实验中,玻璃棒的作用。(2)、B图所示的实验中,由铜片上的白磷燃烧而热水中的白磷不燃烧的事实,说明燃烧需要;烧杯中热水的作用。(答出一点即可)(3)、通过C图所示的实验,可以得出铁制品锈蚀的条件为:铁与反应。(4)、D图所示的实验中,加入酚酞的作用是;实验中逐滴加入稀盐酸的目的是。28. 图1是实验室制取气体的常用装置,请根据图示回答问题。
(1)、A图所示的实验中,玻璃棒的作用。(2)、B图所示的实验中,由铜片上的白磷燃烧而热水中的白磷不燃烧的事实,说明燃烧需要;烧杯中热水的作用。(答出一点即可)(3)、通过C图所示的实验,可以得出铁制品锈蚀的条件为:铁与反应。(4)、D图所示的实验中,加入酚酞的作用是;实验中逐滴加入稀盐酸的目的是。28. 图1是实验室制取气体的常用装置,请根据图示回答问题。 (1)、实验室常用过氧化氢溶液和二氧化锰制取氧气,若要控制反应速率并收集较为纯净的氧气,应选择的发生和收集装置是(填字母,下同);写出该反应的化学方程式。(2)、实验室用大理石和稀盐酸反应制取二氧化碳,写出该反应的化学方程式: ;若用图2装置干燥二氧化碳,气体应从(填“a”或“b”)端通入;若用图2装置检验二氧化碳,写出发生反应的化学方程式;(3)、液氨是液态的氨气,常温下,氨气(NH3)是一种无色、有刺激性气味的气体,密度比空气小。实验室常用氯化铵固体与碱石灰固体共热制取氨气。制取和收集氨气的装置应选择上图中的。液氨泄漏时,可用喷水的方法除去空气中的氨气,说明氨气具有的物理性质。根据氨气的性质推测,发生液氨泄漏时正确的逃生方法是(列举一条即可)。29. 学习了空气中氧气含量测定实验后,小李同学对集气瓶内压强的变化产生极大的兴趣,他利用物理兴趣小组的压强传感设备(如图1)将集气瓶内气体压强精确地记录下来。图2、图3是用该装置测得的红磷和木炭分别在集气瓶中燃烧的压强﹣时间关系图。
(1)、实验室常用过氧化氢溶液和二氧化锰制取氧气,若要控制反应速率并收集较为纯净的氧气,应选择的发生和收集装置是(填字母,下同);写出该反应的化学方程式。(2)、实验室用大理石和稀盐酸反应制取二氧化碳,写出该反应的化学方程式: ;若用图2装置干燥二氧化碳,气体应从(填“a”或“b”)端通入;若用图2装置检验二氧化碳,写出发生反应的化学方程式;(3)、液氨是液态的氨气,常温下,氨气(NH3)是一种无色、有刺激性气味的气体,密度比空气小。实验室常用氯化铵固体与碱石灰固体共热制取氨气。制取和收集氨气的装置应选择上图中的。液氨泄漏时,可用喷水的方法除去空气中的氨气,说明氨气具有的物理性质。根据氨气的性质推测,发生液氨泄漏时正确的逃生方法是(列举一条即可)。29. 学习了空气中氧气含量测定实验后,小李同学对集气瓶内压强的变化产生极大的兴趣,他利用物理兴趣小组的压强传感设备(如图1)将集气瓶内气体压强精确地记录下来。图2、图3是用该装置测得的红磷和木炭分别在集气瓶中燃烧的压强﹣时间关系图。

根据所学知识和关系图回答以下问题:
(1)、最终小李确定可以用红磷燃烧法测定空气中氧气含量,反应的化学方程式为 , 为保证实验成功,小李应注意的问题有(答出一点即可)。(2)、通过图3可知,不能使用木炭的原因是;如何改进,实验也能成功?。(3)、小红同学观察关系图后发现反应开始时集气瓶中压强瞬间变大,原因是。小红建议燃烧前集气瓶内装少量的水,目的是。小红想到化学实验也可能对环境造成影响,为响应2022年北京办成绿色冬奥会的号召,我们在化学实验中要注意哪些问题(答出一点即可)。30. 某兴趣小组在实验室里准备常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中,有一瓶未盖瓶塞且标签破损的溶液(如图),他们决定对这瓶溶液的成分进行探究。
(提出问题)这瓶溶液的溶质是什么?
(获得信息)
酸、碱、盐的性质实验中用到含钠元素的物质有氯化钠、氢氧化钠、碳酸钠、碳酸氢钠。
实验室里盛放碱性溶液的试剂瓶通常使用橡胶塞。
碳酸氢钠溶液与氯化钡溶液不反应;氯化钡溶液呈中性。
(提出猜想)猜想一:氢氧化钠;猜想二:碳酸钠;猜想三:碳酸氢钠。
(1)、(实验探究)小军取样滴加稀盐酸有气泡产生,得出结论:该溶液的溶质是。
(2)、小军另取样加入过量的氯化钡溶液,观察到有产生,进而得出结论:该溶液的溶质是碳酸钠。(3)、小华认为小军的结论不完全正确,理由是。小组同学讨论后一致认为还需要进行如下实验:取小军第二次实验后的上层清液,滴入无色酚酞溶液,溶液呈红色。
(4)、(实验结论)这瓶溶液的原溶质是。
(5)、(探究启示)实验中取用液体药品时,应注意。
五、计算题
