四川省达州市2021-2022学年高三上学期第一次诊断考试理科综合化学试题
试卷更新日期:2022-01-17 类型:高考模拟
一、单选题
-
1. 下列生产生活中的变化或应用与氧化还原反应无关的是( )A、铁盐净水 B、煤气化 C、液态油脂变奶油 D、蓄电池放电2. 有机物a、b、c的结构简式如下所示,下列说法错误的是( )
 A、a、b、c中均只含一种官能团 B、a、b、c均能发生加成反应和被酸性高锰酸钾氧化 C、b中与苯环直接相连的原子都在同一平面上 D、c存在芳香族异构体3. 设NA为阿伏加德罗常数的值,下列叙述错误的是( )A、1L0.2mol/L硫酸铁溶液中含有的SO数目为0.6NA B、1molCnH2n含有的共用电子对数为(3n+1)NA C、电解精炼Cu时,若阴极质量增加64g,则电路中转移电子数为2NA D、1mol丙烯和乙烷的混合物完全燃烧生成水分子数为3NA4. 除去下列物质中的杂质,所选的试剂与分离方法不能达到目的的是( )
A、a、b、c中均只含一种官能团 B、a、b、c均能发生加成反应和被酸性高锰酸钾氧化 C、b中与苯环直接相连的原子都在同一平面上 D、c存在芳香族异构体3. 设NA为阿伏加德罗常数的值,下列叙述错误的是( )A、1L0.2mol/L硫酸铁溶液中含有的SO数目为0.6NA B、1molCnH2n含有的共用电子对数为(3n+1)NA C、电解精炼Cu时,若阴极质量增加64g,则电路中转移电子数为2NA D、1mol丙烯和乙烷的混合物完全燃烧生成水分子数为3NA4. 除去下列物质中的杂质,所选的试剂与分离方法不能达到目的的是( )物质
除杂试剂
分离方法
A
NaCl溶液(I2)
CCl4
分液
B
CH3CH2OH(CH3COOH)
NaOH溶液
蒸馏
C
HCl(Cl2)
饱和食盐水
洗气
D
CaCO3(CaSO4)
Na2CO3溶液
过滤
A、A B、B C、C D、D5. a、b、c、d、e是原子序数依次增大的短周期元素,a的最外层电子数是内层电子数的三倍,上述元素中b原子半径最大,a与e形成的多种化合物中一种可用于自来水消毒杀菌,c、d原子序数为奇数。下列说法正确的是( )A、元素非金属性:a>e B、d、e不能形成各原子均达8e—结构的化合物 C、工业上电解c、e形成的化合物制c的单质 D、a、b、e形成的化合物均呈碱性6. 下列实验对应的离子方程式书写正确的是( ) A、①:H2S+CO=S2-+H2O+CO2 B、②:2Al3++3SO+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ C、③:SO+Cl2+H2O=SO+2Cl-+2H+ D、④:2Cl-+2H2O2OH-+H2↑+Cl2↑7. 用0.100mol/LNaOH溶液滴定20.00mLcmol/L二元酸H2A溶液,滴定曲线如图所示,下列叙述正确的是( )
A、①:H2S+CO=S2-+H2O+CO2 B、②:2Al3++3SO+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ C、③:SO+Cl2+H2O=SO+2Cl-+2H+ D、④:2Cl-+2H2O2OH-+H2↑+Cl2↑7. 用0.100mol/LNaOH溶液滴定20.00mLcmol/L二元酸H2A溶液,滴定曲线如图所示,下列叙述正确的是( ) A、HA—的电离常数的数量级是10-5 B、a点:c(HA-)>c (Na+)>c(H+)>c(A2-)>c(OH-) C、b点:c(H+)=c(A2-)+c(OH-) D、c点:c(Na+)<c(HA-)+2c(A2-)
A、HA—的电离常数的数量级是10-5 B、a点:c(HA-)>c (Na+)>c(H+)>c(A2-)>c(OH-) C、b点:c(H+)=c(A2-)+c(OH-) D、c点:c(Na+)<c(HA-)+2c(A2-)二、综合题
-
8. 氨是重要的化工原料,回答下列问题:(1)、I.氨气的制备

制取并收集一瓶干燥氨气,上述装置的连接顺序为A→→→C→ , 制气时的化学方程式为 , 收集时气体从口进入(2)、II.氨气的性质装置如图所示,打开止水夹,用热毛巾将烧瓶捂热,水上喷形成红色喷泉,说明氨气。
 (3)、III.氨气的用途
(3)、III.氨气的用途利用下图装置由氨制硝酸,实验时戊中溶液呈淡黄色时关闭分液漏斗活塞。

Na2O2的作用 , 证明有硝酸生成的实验是 , 发生反应的离子方程式。
(4)、实验中的氮氧化物(NOx)尾气折算成标准状况下的体积为aL,完全吸收时,烧杯中c(NaOH)至少是mol/L(忽略溶液体积变化)。9. 甘氨酸亚铁[(H2NCH2COO)2Fe]是一种补血剂,工业上用赤铁矿(含少量铝、铜、硅、锰的氧化物)制备甘氨酸亚铁的流程图如下:
已知:甘氨酸(H2NCH2COOH),易溶于水,微溶于乙醇,具有两性。
回答下列问题:
(1)、“碱浸”去除的元素是 , “滤渣1”是(填化学式)。(2)、“还原”时的还原产物是(3)、“沉淀”的离子方程式 , “副产品”是(写名称)。(4)、柠檬酸的作用防止Fe2+氧化,“反应”的化学方程式为(5)、FeSO4·7H2O也是一种常用的补血剂,在空气中易变质,检验其是否变质的试剂是 , 某同学通过如下实验测定该补血剂中Fe2+的含量:①配制:用分析天平称取1.400gFeSO4·7H2O样品,再用煮沸并冷却的蒸馏水配制100mL溶液。配制时还需要的定量仪器是
②滴定:用酸化的KMnO4溶液滴定:用移液管移取25.00mLFeSO4溶液于锥形瓶中,用0.0100mol·L-1的KMnO4溶液滴定,平行滴定3次,KMnO4溶液的平均用量为24.00mL,则样品Fe2+的含量为%(保留2位小数)。
10. SO2是一种污染性气体,减少SO2在大气中的排放是环境保护的重要内容回答下列问题:(1)、已知:S(s)+O2(g)=SO2(g) ∆H=-297.2kJ·mol-1 , CH4(g)+2SO2(g)=CO2(g)+2S(s)+2H2O(l) ∆H=-295.9kJ·mol-1 , 若CH4(g)+2O2(g)=CO2(g)+2H2O(l)反应物的能量为E1 , 则生成物的能量E2是(2)、利用反应:C(s)+SO2(g)CO2(g)+S(g),可减少SO2在大气中的排放,在密闭容器中投入足量的反应物,不同实验条件下达到平衡,测得T=600℃下的x(SO2)—p和p=105Pa下—1gKc—t如图所示[x(SO2)表示SO2平衡时含量,Kc表示平衡常数]。该反应的正反应是反应(填“放热”、“吸热”),理由是。 (3)、恒温恒容条件下,下列事实不能说明反应C(s)+SO2(g)CO2(g)+S(g)达到平衡状态的是____(填字母)A、不变 B、v(CO2)正=v(SO2)逆 C、混合气体的总压强不再改变 D、混合气体的密度不再改变(4)、800℃,在1.0L的恒容密闭容器中投入1.0molSO2和120gC,容器中压强为p0kPa,发生反应C(s)+SO2(g)CO2(g)+S(g),5min时容器中CO2的体积分数为20%,10min时达平衡,容器中压强为pkPa时。0~5minv(SO2)kPa·min-1 , 800℃的化学平衡常数Kc=mol/L。(5)、用电化学原理吸收烟道气中SO2以减少其排放,其装置示意图。H2O2从口进入,电路中通过1mol电子时,正极区溶液的c(H+)将 , 负极区n(H2SO4)=。
(3)、恒温恒容条件下,下列事实不能说明反应C(s)+SO2(g)CO2(g)+S(g)达到平衡状态的是____(填字母)A、不变 B、v(CO2)正=v(SO2)逆 C、混合气体的总压强不再改变 D、混合气体的密度不再改变(4)、800℃,在1.0L的恒容密闭容器中投入1.0molSO2和120gC,容器中压强为p0kPa,发生反应C(s)+SO2(g)CO2(g)+S(g),5min时容器中CO2的体积分数为20%,10min时达平衡,容器中压强为pkPa时。0~5minv(SO2)kPa·min-1 , 800℃的化学平衡常数Kc=mol/L。(5)、用电化学原理吸收烟道气中SO2以减少其排放,其装置示意图。H2O2从口进入,电路中通过1mol电子时,正极区溶液的c(H+)将 , 负极区n(H2SO4)=。 11. 金属钛(Ti)及化合物在化工、医药、材料等领城具有广泛应用。回答下列问题:(1)、Li4Ti5O12是电池的电极材料。与Li不同族但性质相似的元素是 , 其电子占据最高能级的电子云轮廓图是(2)、K与Ti位于同一周期,K和Ti的第一电离能(I1)较大的是 , 它们的第二电离能(I2)分别为3051kJ/mol、1310kJ/mol,其原因是。(3)、钛与卤素形成的化合物TiX4熔点如下表
11. 金属钛(Ti)及化合物在化工、医药、材料等领城具有广泛应用。回答下列问题:(1)、Li4Ti5O12是电池的电极材料。与Li不同族但性质相似的元素是 , 其电子占据最高能级的电子云轮廓图是(2)、K与Ti位于同一周期,K和Ti的第一电离能(I1)较大的是 , 它们的第二电离能(I2)分别为3051kJ/mol、1310kJ/mol,其原因是。(3)、钛与卤素形成的化合物TiX4熔点如下表TiX4
TiF4
TiCl4
TiBr4
TiI4
熔点℃
377
-24
38.3
153
它们熔点差异的原因
(4)、Ti(IV)的某配合物可用于催化环烯烃聚合,其结构如图所示,该配合物中:Ti的配位数为 , 与Ti形成配位键的元素是 , 碳碳键类型是;所含非金属元素的含氧酸根离子中心原子杂化轨道类型是sp2的是、立体构型是V形的是 (5)、已知N与Ti形成的化合物的晶胞结构如图所示,晶胞中Ti原子与N原子的最近距离为apm;晶胞的密度为p=g/cm3(阿伏加德罗常数值为NA , N、Ti的相对原子质量分别用Ar(N)和Ar(Ti)表示)
(5)、已知N与Ti形成的化合物的晶胞结构如图所示,晶胞中Ti原子与N原子的最近距离为apm;晶胞的密度为p=g/cm3(阿伏加德罗常数值为NA , N、Ti的相对原子质量分别用Ar(N)和Ar(Ti)表示)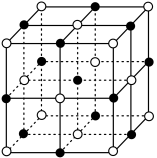 12. A(C7H8)是煤干馏产物之一,可用来合成一种药物中间体F(
12. A(C7H8)是煤干馏产物之一,可用来合成一种药物中间体F( )其合成路线如下:
)其合成路线如下: (1)、A的结构简式为C的官能团名称为(2)、试剂I为 , E→F的反应类型为(3)、E与足量NaHCO3溶液反应的化学方程式为(4)、与
(1)、A的结构简式为C的官能团名称为(2)、试剂I为 , E→F的反应类型为(3)、E与足量NaHCO3溶液反应的化学方程式为(4)、与 分子式相同,满足下列条件的同分异构体有种,写出其苯环上一氯代物有2种的结构简式。
分子式相同,满足下列条件的同分异构体有种,写出其苯环上一氯代物有2种的结构简式。①能与NaHCO3溶液反应
②有3个取代基的芳香族化合物
(5)、设计以对硝基甲苯和乙醇为原料,合成麻醉药物苯佐卡因( )的路线为:(已知:
)的路线为:(已知:
 )。
)。