江苏省镇江市丹徒区共同体2021-2022学年九年级上学期12月月考化学试题
试卷更新日期:2022-01-07 类型:月考试卷
一、单选题
-
1. 下列物质属于纯净物的是( )A、洁净空气 B、赤铁矿 C、金刚石 D、加碘盐2. 下列变化中,属于化学变化的是( )A、海水晒盐 B、葡萄酿酒 C、工业制氧 D、干冰升华3. 下列化学用语表达正确的是( )A、铁锈的主要成分:Fe3O4 B、水银:Ag C、镁离子:Mg+2 D、3个氢原子:3H4. 下列说法错误的是( )A、用钢丝球洗刷铝锅 B、限放鞭炮,保护环境 C、回收垃圾,节约资源 D、被困火灾区,可蹲下或匍匐逃生5. 下列对物质的归类正确的是( )
选项
归类
物质(或变化)
A
人体中常见微量元素
碘、硒、镁、铁等
B
大气污染物
粉尘、二氧化硫、二氧化碳
C
常见合金
不锈钢、生铁、黄铜
D
氧化反应
钢铁生锈、光合作用、食物腐烂
A、A B、B C、C D、D6. 实验室用双氧水和MnO2制取氧气的实验中,下列操作正确的是( ) A、用装置甲可以控制反应的发生和停止 B、用装置乙分离回收MnO2 C、用装置丙可以验满氧气 D、用装置丁可观察到火星四射7. 下列实验设计错误的是( )A、用点燃的方法除去CO2中CO B、加热含有石蕊的碳酸溶液可证明碳酸发生了分解 C、用托盘天平称取10.2g蔗糖 D、用肥皂水区别软水和氯化钙溶液8. 下列排序正确的是( )A、Mn元素的化合价 B、金属冶炼与使用历史 C、碳元素的质量分数 D、地壳中元素的含量9. 下列对实验现象的描述或实验操作正确的是( )A、红磷在空气中燃烧,产生大量白雾 B、10.0mL酒精与10.0mL蒸馏水混合,溶液的体积为20.0mL C、滴瓶上的滴管使用后无需用蒸馏水清洗,直接放回原滴瓶 D、用高锰酸钾制取O2后,应先熄灭酒精灯再从水中取出导气管10. 以甲为原料合成产品丁微观过程如下图。下列说法正确的是( )
A、用装置甲可以控制反应的发生和停止 B、用装置乙分离回收MnO2 C、用装置丙可以验满氧气 D、用装置丁可观察到火星四射7. 下列实验设计错误的是( )A、用点燃的方法除去CO2中CO B、加热含有石蕊的碳酸溶液可证明碳酸发生了分解 C、用托盘天平称取10.2g蔗糖 D、用肥皂水区别软水和氯化钙溶液8. 下列排序正确的是( )A、Mn元素的化合价 B、金属冶炼与使用历史 C、碳元素的质量分数 D、地壳中元素的含量9. 下列对实验现象的描述或实验操作正确的是( )A、红磷在空气中燃烧,产生大量白雾 B、10.0mL酒精与10.0mL蒸馏水混合,溶液的体积为20.0mL C、滴瓶上的滴管使用后无需用蒸馏水清洗,直接放回原滴瓶 D、用高锰酸钾制取O2后,应先熄灭酒精灯再从水中取出导气管10. 以甲为原料合成产品丁微观过程如下图。下列说法正确的是( ) A、甲中氢元素质量分数小于丁 B、转化①中乙和丙分子个数比为1∶1 C、乙、丁为氧化物 D、该过程体现无机物与有机物可相互转化11. 下列指定反应的化学方程式正确的是( )A、盐酸除铁锈:Fe2O3+6HCl=2FeCl3+3H2O B、铁片溶于稀硫酸:2Fe+3H2SO4=Fe2(SO4)3+3H2↑ C、镁条燃烧: Mg + O2 MgO2 D、实验室制备CO2:CaCO3 CaO+CO2↑12. 物质的用途与性质密切相关。下列说法错误的是( )A、金刚石硬度大,可用于刻划玻璃 B、氩气性质稳定,可用做焊接金属保护气 C、铁粉在空气中能生锈,可用做食品脱氧剂 D、液体二氧化碳吸热气化,可降低可燃物着火点13. 下列实验操作中(括号内为待检测物质或杂质)不能达到实验目的的是( )
A、甲中氢元素质量分数小于丁 B、转化①中乙和丙分子个数比为1∶1 C、乙、丁为氧化物 D、该过程体现无机物与有机物可相互转化11. 下列指定反应的化学方程式正确的是( )A、盐酸除铁锈:Fe2O3+6HCl=2FeCl3+3H2O B、铁片溶于稀硫酸:2Fe+3H2SO4=Fe2(SO4)3+3H2↑ C、镁条燃烧: Mg + O2 MgO2 D、实验室制备CO2:CaCO3 CaO+CO2↑12. 物质的用途与性质密切相关。下列说法错误的是( )A、金刚石硬度大,可用于刻划玻璃 B、氩气性质稳定,可用做焊接金属保护气 C、铁粉在空气中能生锈,可用做食品脱氧剂 D、液体二氧化碳吸热气化,可降低可燃物着火点13. 下列实验操作中(括号内为待检测物质或杂质)不能达到实验目的的是( )序号
物质
实验目的
所用试剂或方法
A
N2(O2)
除杂
通过灼热的木炭粉
B
CO、CH4
鉴别
点燃,火焰上方罩干冷烧杯,观察现象
C
Cu(Fe)
检验
加入稀盐酸,观察有无气泡产生
D
CaCO3和CaCl2的混合物
分离
溶解、过滤、洗涤、干燥、蒸发
A、A B、B C、C D、D14. 下列物质的转化在给定条件下均能一步实现的是( )A、Cu CuSO4 Cu(OH)2 B、H2O H2 H2O2 C、CaCO3 CO2 CO D、KClO3 O2 Fe2O315. 氢能是一种极具发展潜力的清洁能源.以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法.其反应过程如图所示,下列说法错误的是( ) A、该流程可实现太阳能向化学能的转化 B、制得H2中氢元素最初来源于水和硫酸 C、所有涉及的反应中,有四种元素的化合价发生了改变 D、反应I中,发生反应的化学方程式为SO2+I2+2H2O=2HI+H2SO416. 下列说法正确的是( )A、CO2能灭火,所以能使燃着的木条熄灭的无色气体一定是CO2 B、置换反应生成单质和化合物,所以生成单质和化合物的反应一定是置换反应 C、分子是构成物质的微粒,所以物质都是由分子构成的 D、金属和酸反应能生成气体,所以和酸反应生成气体的物质不一定是金属17. 对于化学反应R+2HCl=RCl2+H2↑,下列说法错误的是( )A、R不可能是Al B、R若是Fe,则反应前后溶液颜色有变化 C、该反应是置换反应 D、因生成气体,反应后溶液质量减小18. 在64.0g铁粉中先后加稀硫酸和CuSO4溶液,固体质量(g)与所加溶液质量的关系如图示。下列说法错误的是( )
A、该流程可实现太阳能向化学能的转化 B、制得H2中氢元素最初来源于水和硫酸 C、所有涉及的反应中,有四种元素的化合价发生了改变 D、反应I中,发生反应的化学方程式为SO2+I2+2H2O=2HI+H2SO416. 下列说法正确的是( )A、CO2能灭火,所以能使燃着的木条熄灭的无色气体一定是CO2 B、置换反应生成单质和化合物,所以生成单质和化合物的反应一定是置换反应 C、分子是构成物质的微粒,所以物质都是由分子构成的 D、金属和酸反应能生成气体,所以和酸反应生成气体的物质不一定是金属17. 对于化学反应R+2HCl=RCl2+H2↑,下列说法错误的是( )A、R不可能是Al B、R若是Fe,则反应前后溶液颜色有变化 C、该反应是置换反应 D、因生成气体,反应后溶液质量减小18. 在64.0g铁粉中先后加稀硫酸和CuSO4溶液,固体质量(g)与所加溶液质量的关系如图示。下列说法错误的是( )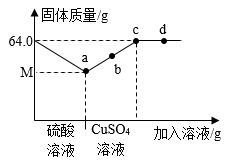 A、b点固体能完全溶于足量稀硫酸 B、d点对应溶液含两种溶质 C、M的值为56.0 D、a、c点对应溶液中FeSO4质量比为1∶819. 利用括号内所给试剂或方法,不能被鉴别出的是( )A、N2、O2、空气三种无色气体(插入燃着木条) B、Fe粉、C粉、MnO2三种黑色粉末(在O2中灼烧) C、FeSO4、FeCl2、稀H2SO4三种溶液(观察颜色) D、CaCO3、无水CuSO4、NaCl三种白色固体(蒸馏水)20. 已知:Cu2O+H2SO4=Cu+CuSO4+H2O.将28.8gCu2O、Cu混合物溶于200.0g溶质质量分数为9.8%的稀H2SO4中,搅拌使之充分反应,过滤、洗涤、干燥得20.8g固体.下列说法正确的是( )A、20.8g固体是反应生成的铜的质量 B、原混合物中Cu2O与Cu的质量之比为1∶1 C、反应后溶液呈蓝色,溶质只有一种 D、反应后溶液中CuSO4的溶质质量分数为8.0%
A、b点固体能完全溶于足量稀硫酸 B、d点对应溶液含两种溶质 C、M的值为56.0 D、a、c点对应溶液中FeSO4质量比为1∶819. 利用括号内所给试剂或方法,不能被鉴别出的是( )A、N2、O2、空气三种无色气体(插入燃着木条) B、Fe粉、C粉、MnO2三种黑色粉末(在O2中灼烧) C、FeSO4、FeCl2、稀H2SO4三种溶液(观察颜色) D、CaCO3、无水CuSO4、NaCl三种白色固体(蒸馏水)20. 已知:Cu2O+H2SO4=Cu+CuSO4+H2O.将28.8gCu2O、Cu混合物溶于200.0g溶质质量分数为9.8%的稀H2SO4中,搅拌使之充分反应,过滤、洗涤、干燥得20.8g固体.下列说法正确的是( )A、20.8g固体是反应生成的铜的质量 B、原混合物中Cu2O与Cu的质量之比为1∶1 C、反应后溶液呈蓝色,溶质只有一种 D、反应后溶液中CuSO4的溶质质量分数为8.0%二、填空题
-
21. 用化学用语填空:(1)、5个氨分子;(2)、3个亚铁离子;(3)、人体缺元素易患侏儒症;(4)、硝酸钙中氮元素的化合价。22. 选择下列适当物质填空(用物质的序号):
A、氢气 B、活性炭 C、一氧化碳 D、二氧化碳 E、石灰石 F、生石灰 G、二氧化硫 H、武德合金
(1)、常用来制保险丝的是;(2)、最理想的“绿色能源”是;(3)、可以用作冰箱除味剂的是;(4)、用于工业炼铁的原料的是;(5)、能导致酸雨的是;(6)、可用作食品干燥剂的是。23. 用氧气传感器测定铁粉生锈过程中氧气浓度的变化如图 (1)、滤纸上涂浓食盐水的目的是 。(2)、集气瓶内的压强逐渐 。(选填“变大”、“变小”或“不变”)24. 氮气无色无味,大气中约含有78%,很稳定,常温下很难与其他物质发生反应,但在较高温度下,氮气可能对金属和合金具有侵蚀性。用氮气和氢气为原料可合成氨气,氨气可用于生产氮肥,从而为解决人类面临的粮食危机作出重大贡献。下图表示氮及其化合物在一定条件下的转化关系。
(1)、滤纸上涂浓食盐水的目的是 。(2)、集气瓶内的压强逐渐 。(选填“变大”、“变小”或“不变”)24. 氮气无色无味,大气中约含有78%,很稳定,常温下很难与其他物质发生反应,但在较高温度下,氮气可能对金属和合金具有侵蚀性。用氮气和氢气为原料可合成氨气,氨气可用于生产氮肥,从而为解决人类面临的粮食危机作出重大贡献。下图表示氮及其化合物在一定条件下的转化关系。
请回答以下问题:
(1)、工业上分离液态空气得到氧气和氮气是根据它们的(选填序号)不同。a.沸点 b.密度 c.溶解性
(2)、已知: 3Mg+N2 Mg3N2。Mg3N2的名称是。(3)、上图中反应I的化学方程式为 , 反应Ⅱ可用于生产尿素[CO(NH2)2],反应中NH3与CO2的质量比为。(4)、上图中反应Ⅲ为: 4CO(NH2)2 +6NO2 4X +7N2+8H2O,则X的化学式为。(5)、以二氧化碳和氢气为原料制备甲醇(CH4O),写出对应的方程式。25. 控制一定的温度,焙烧MnCO3可制得制取MnO2(装置如左图)。
 (1)、实验中观察到石灰水变浑浊,玻璃管中反应化学方程式为。(2)、加热MnCO3时,测得残留固体质量随温度变化如图所示,图中b点对应固体是锰的另一氧化物,其化学式为。
(1)、实验中观察到石灰水变浑浊,玻璃管中反应化学方程式为。(2)、加热MnCO3时,测得残留固体质量随温度变化如图所示,图中b点对应固体是锰的另一氧化物,其化学式为。三、综合题
-
26. 从含FeSO4和CuSO4的废液中回收Cu并制FeSO4•7H2O实验方案如下:
 (1)、金属X应选用(填序号)。
(1)、金属X应选用(填序号)。a.Zn b.Cu c.Fe
(2)、操作a、b中所用玻璃仪器有:烧杯、、玻璃棒。(3)、证明所加稀硫酸过量的方法是:取操作b所获固体,加入 , 无现象。(4)、用加热方法干燥固体,所得Cu不纯,原因是。上述所制产品中FeSO4质量(填“大于”、“小于”或“等于”)原废液中的FeSO4。27. 请结合下图回答问题: (1)、写标号仪器名称:① , ②。(2)、实验室制氧气、二氧化碳、氢气都可选用(选填序号)做发生装置。用该装置制氧气时,其反应化学方程式为。(3)、实验室制二氧化碳,可选下列药品中的(选填序号)。
(1)、写标号仪器名称:① , ②。(2)、实验室制氧气、二氧化碳、氢气都可选用(选填序号)做发生装置。用该装置制氧气时,其反应化学方程式为。(3)、实验室制二氧化碳,可选下列药品中的(选填序号)。A.石灰石、浓盐酸 B.石灰石、稀硫酸 C.石灰石、稀盐酸
若用E装置收集CO2 , 气体应从(选填“a”或“b”)端通入。
(4)、M是可能含CaCO3的CaSO3(CaSO3和稀HCl反应产生SO2 , SO2能使KMnO4溶液褪色,也能使石灰水浑浊)。为证明M中是否含CaCO3 , 设计如图装置。
①若H中(填现象,下同)。I中 , 说明M中含CaCO3。
②用F制气体相对于B的优点有。
28. 某碱式碳酸铜成分可表示为Cua(OH)b(CO3)c , 兴趣小组为探究其性质和组成,取3.46g样品持续加强热,观察到固体先变成黑色,然后变成红色,同时得到气体。(一)气体成分的探究
(资料1)①无水硫酸铜遇水变蓝;
②氢氧化钠溶液可以充分吸收CO2。
(1)、(实验)将生成的气体通入到下图装置
(现象)实验中观察到A中 , 说明有水生成, B中澄清石灰水变浑浊,说明生成了 , B中发生反应的化学方程式为。
(2)、(数据)充分吸收生成的气体后测定,A装置增重0.18g, B和C装置共增重0.88g,(计算) a:b:c=。
(3)、(二)红色固体成分的探究(资料2)1、Cu和Cu2O均为红色固体;2、Cu2O+ H2SO4=CuSO4+Cu+H2O。
(猜想)红色固体可能是:猜想1:Cu 猜想2:Cu2O 猜想3:
(4)、(实验)①取适量红色固体,加入足量稀硫酸,观察到(填现象),则猜想1是错误的。②反应后测得红色固体质量为2.16g
(5)、(结论)结合以上数据,写出该碱式碳酸铜分解的化学方程式。29. 某固体由CaCO3、NH4HCO3、C粉、NaCl、CuSO4中的一种或几种组成。(1)、取固体样品充分加热,未闻到氨味,则原固体中一定不含。(2)、另取该固体样品,加足量水,经充分溶解、过滤,得蓝色滤液与滤渣。则原固体中一定含。(3)、在滤渣中加足量稀盐酸,固体完全溶解且产生气泡。则原固体中一定不含。实验中,产生气泡的化学方程式为。30. 金属材料是人类社会发展见证者,人类文明和社会进步同金属材料关系十分密切。(1)、(一)生活中的金属没有镁的存在,就不能形成叶绿素,也就没有光合作用,这里的镁是指______。
A、单质 B、元素 C、原子(2)、家用热水瓶内胆上的银白色金属是 , 铝制品在空气中耐腐蚀的原因是(用化学方程式表示)。(3)、为了减少和避免雷电对高层建筑的危害,需安装由金属材料制成的避雷装置,这主要是利用了金属材料的______。(填序号)A、密度大 B、导电性 C、导热性 D、熔点高(4)、(二)一氧化碳还原氧化铁(查阅资料)①氢氧化钙溶液能吸收二氧化碳;
②一氧化碳还原氧化铁是逐步失去氧元素的过程。
铁及铁的氧化物
Fe
FeO
Fe2O3
Fe3O4
颜色
黑色
黑色
红棕色
黑色
能否被磁铁吸引
能
不能
不能
能

(实验探究)兴趣小组设计了如上图实验装置进行实验。将24.0g氧化铁粉末放入玻璃管中,反应一段时间后,得到黑色固体粉末,并能全被磁铁吸引。
兴趣小组猜想黑色粉末可能是:(1)铁粉;(2)四氧化三铁;(3)你的猜想是。
(5)、反应前后称量相关装置和物质的总质量,其数据如下表:反应前
反应一段时间后
Ⅰ组
玻璃管和红色粉末的总质量为44.0 g
玻璃管和固体物质的总质量为43.2g
Ⅱ组
试管和所盛溶液的总质量为30.0 g
洗气瓶和瓶中物质的总质量为32.1g
(交流讨论)
实验前应该先。
(6)、在装置A中先通CO气体的作用是。(7)、应该选择组的实验数据计算来确定黑色粉末的成分,不选择另一组的理由是。最终计算结果表明:黑色粉末是 , 请写出该变化的化学方程式。
(8)、(三)碱式碳酸镁晶体成分的确定(查阅资料)①Mg(OH)2:白色固体,难溶于水,受热会分解成氧化镁和水;
②MgCO3:白色固体,微溶于水,受热会分解成氧化镁和二氧化碳;
③MgCO3的热稳定性比Mg(OH)2的热稳定性更强。
工业生产中得到的碱式碳酸镁晶体是xMgCO3•yMg(OH)2•zH2O,为精确测量晶体的组成,小组同学取4.66g该晶体,用热分析仪对固体进行热分解(加热使之逐步分解,首先失去结晶水,最后完全反应),测定剩余固体质量与分解温度之间关系。
(数据处理)剩余固体质量与加热时间关系如图所示:

请回答下列问题:
0~t1固体质量没有发生变化的原因可能是。
(9)、晶体中结晶水的质量为g。(10)、t4~t5段固体为和MgO(写化学式)。(11)、根据图中数据推算xMgCO3•yMg(OH)2•zH2O中x:y:z的最简比为。